Přesmyk divinylcyklopropan-cykloheptadien - Divinylcyclopropane-cycloheptadiene rearrangement - Wikipedia
The přesmyk divinylcyklopropan-cykloheptadien je organická chemická transformace, která zahrnuje izomeraci 1,2-divinylcyklopropanu na cykloheptadien nebo -trien. Koncepčně to souvisí s Vyrovnejte přeskupení, ale má tu výhodu, že má silnou termodynamickou hnací sílu v důsledku uvolnění namáhání prstence. Tato termodynamická síla je v poslední době považována za alternativní zdroj energie.[1]
Úvod
V roce 1960 Vogel zjistil, že 1,2-divinylcyklopropan se přeskupuje na cykloheptan-1,4-dien.,[2] Po jeho objevu následovala v 60. letech řada intenzivních mechanistických zkoumání reakce, když si vědci uvědomili, že se podobá (strukturální i mechanická) souvisejícímu přeskupení vinylcyklopropanu na cyklopenten. V 70. letech dosáhlo přeskupení syntetické užitečnosti[3] a dodnes je užitečnou metodou pro formování sedmičlenných prstenů. Byly hlášeny variace obsahující heteroatomy (viz níže).
(1)

Výhody: Jelikož jde o přeskupení, proces vykazuje ideální atomovou ekonomiku. Často probíhá spontánně bez potřeby katalyzátoru. Konkurenční cesty jsou u celokarbonového přesmyku minimální.
Nevýhody: Konfiguraci výchozích materiálů je třeba v mnoha případech kontrolovat—trans-divinylcyklopropany často vyžadují zahřátí, aby se usnadnila izomerizace, než dojde k přesmyku. Přesmyky zahrnující heteroatomy mohou vykazovat snížené výtěžky v důsledku tvorby vedlejších produktů.
Mechanismus a stereochemie
Převládající mechanismus
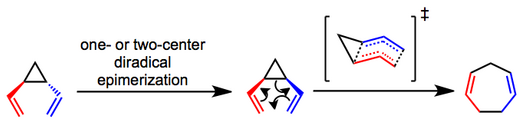
Primární debata týkající se mechanismu přesmyku se soustředí na to, zda se jedná o koordinovaný (sigmatropní) nebo postupný (diradical) proces. Mechanické experimenty to ukázaly trans-divinylcyklopropany epimerizují na odpovídající cis izomery a podstoupit přeskupení prostřednictvím pravděpodobně společné cesty.[4][5] Byl navržen lodní přechodový stav, který pomáhá vysvětlit pozorovanou stereospecifitu procesu. Zda počáteční epimerizace trans k substrátům dochází prostřednictvím procesu s jedním nebo dvěma centry, je ve většině případů nejasný.
(2)
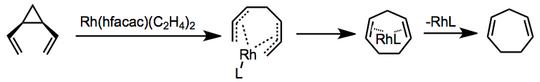
Jsou známy verze přesmyku katalyzované přechodovým kovem a mechanismy se liší. V jednom příkladu používajícím rhodiumbis (ethylen) hexafluoracetylacetonát koordinaci a tvorbu bis-n-allylového komplexu předchází uzavření elektrocyklického kruhu a uvolnění katalyzátoru.[6]
(3)
Stereoselektivní varianty
Reakce divinylcyklopropanů obsahující substituované dvojné vazby jsou stereospecifické s ohledem na konfigurace na dvojných vazbách—cis,cis izomery dávají cis výrobky cis,trans izomery dávají trans produkty. Chirální neracemické výchozí materiály tedy dávají vznik chirálním produktům bez ztráty enantiomerní čistoty. V níže uvedeném příkladu byly v každém případě pozorovány pouze zobrazené izomery.[7]
(4)

Rozsah a omezení
Titulární reakci podstupuje široká škála divinylcyklopropanů. Tyto prekurzory byly generovány řadou metod, včetně přidání cyklopropyl nukleofilů (solí lithia,[8] nebo měď[9]) na aktivované dvojné nebo trojné vazby, eliminace bis (2-halogenethyl) cyklopropanů[10] a cyklopropanace.[11]
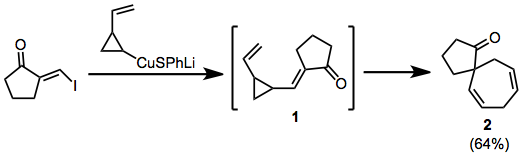
V níže uvedeném příkladu generuje přidání a vylučování měďnatých přechodný enon 1, který přeskupuje na spirocyklus 2.
(5)
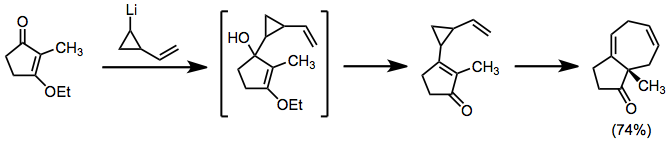
Organolithia mohou být použita v podobné roli, ale přidávají se přímo do karbonylu. Produkty s výsledkem topované topologie.[8]
(6)
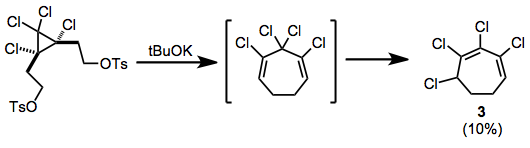
Bylo pozorováno přeskupení po eliminaci ditosylátů; takto vyrobený chlorovaný cykloheptadien izomerizuje na konjugovaný heptadien 3 během reakce.[10]
(7)
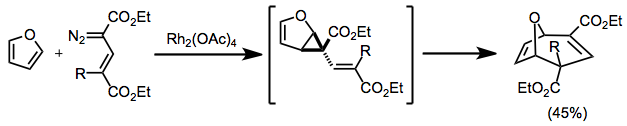
Cyklopropanací s konjugovanými diazo sloučeninami vznikají divinylcyklopropany, které pak podléhají přesmyku. Pokud se použijí cyklické výchozí materiály, vzniknou přemostěné produkty.[12]
(8)
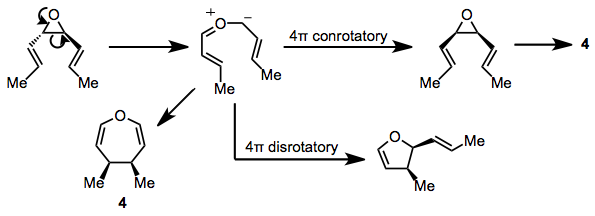
Reakci mohou také projít substráty obsahující tříčlenné heterocyklické kruhy. cis-Divinylepoxidy dávají oxepiny při zvýšených teplotách (100 ° C). trans Izomery procházejí zajímavým konkurenčním přesmykem na dihydrofurany prostřednictvím meziproduktu karbonylu ylid[13] a stejný ylidový meziprodukt byl navržen jako přímý předchůdce oxepinového produktu 4.[14] Konjugované dienyl epoxidy tvoří podobné produkty, což podporuje existenci ylidového meziproduktu.[15]
(9)
Divinyl aziridiny podstoupit podobnou sadu poskytujících reakcí azepiny nebo vinyl pyrroliny v závislosti na relativní konfiguraci výchozí látky aziridinu.[16] Divinyl thiiranes může poskytnout thiepines nebo dihydrothiofeny, i když tyto reakce jsou pomalejší než reakce odpovídajících sloučenin obsahujících dusík a kyslík.
Syntetické aplikace
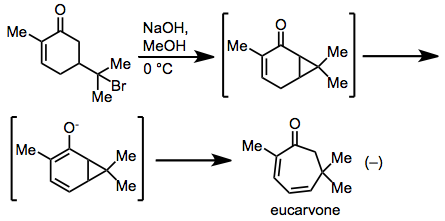
Nejstarší pozorování cykloheptadienu přeskupením názvu bylo provedeno Baeyerem při jeho syntéze eukarvon z karvon hydrobromidu.[17] Mechanické studie odhalily, že přesmyk skutečně probíhal prostřednictvím koordinovaného mechanismu typu Cope.[18]
(10)
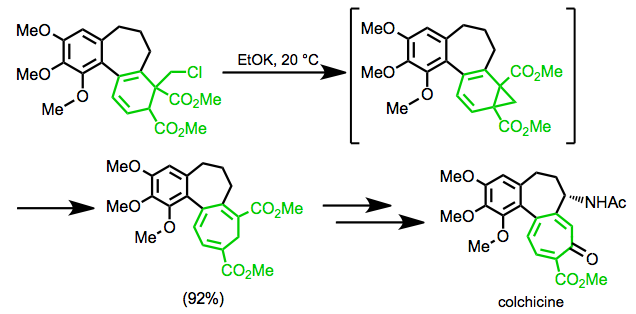
V Eschenmoserově syntéze kolchicin, přesmyk se používá k vytvoření sedmičlenného prstence terče.[19]
(11)
Racemická syntéza sireninu využívá a Wittigova reakce za vzniku klíčového divinylcyklopropanu. Hydrogenace přesmykového produktu poskytla cíl.[20]
(12)

Experimentální podmínky a postup
Typické podmínky
Typicky se přesmyk provádí těsně po vytvoření divinylcyklopropanu ve stejné nádobě. Topení je někdy nutné, zejména pro trans substráty, které musí před přeskupením podstoupit epimerizaci. S dostatkem energie k překonání aktivačních bariér je však izomerizace obvykle velmi účinná.
Příklad postupu[21]
(13)

Do studeného (–78 °) míchaného roztoku lithium diisopropylamid (1,4–1,5 mmol / mmol ketonu) v suchu THF (4 ml / mmol báze) se pod atmosférou argonu pomalu přidá roztok n-butyl-trans-2-vinylcyklopropylketonu (1,19 mmol) v suchém stavu THF (1 ml / mmol ketonu) a výsledný roztok se míchal 45 minut při -78 ° C. Roztok čerstvě sublimovaného terc-butyldimethylsilylchloridu (1,6 mmol / mmol ketonu) v suchu THF Byl přidán (1 ml / mmol chloridu), následovaný sušením HMPA (0,5 ml / mmol ketonu). Roztok se míchá 15 minut při -78 ° C a 2 až 3 hodiny při teplotě místnosti a poté se rozdělí mezi nasycený vodný roztok. hydrogenuhličitan sodný a pentan (10 ml, respektive 20 ml / mmol ketonu). Vodná fáze byla dvakrát promyta pentanem. Spojený extrakt se promyje čtyřikrát nasyceným vodným hydrogenuhličitanem sodným a dvakrát solanka a poté sušené (MgSO4 ). Odstraněním rozpouštědla a následnou destilací zbývajícího oleje mezi baňkami se získá odpovídající silyl enol ether jako bezbarvý olej, který nevykazoval žádnou absorpci roztažení IR karbonylu. Termolýza silyl enol etheru byla provedena zahříváním (čistá, argonová atmosféra) na 230 ° (teplota vzduchové lázně) po dobu 30–60 minut. Přímá destilace (140–150 ° / 12 torrů) výsledných materiálů poskytla cykloheptadien v 85% výtěžku: IR (film) 1660, 1260, 840 cm – 1; 1H NMR (CDCI3 ) 5 0,09 (s, 6H), 0,88 (s, 9H), 0,7-2,75 (m, 14H), 4,8 (t, 1H, J = 5,5 Hz), 5,5-5,9 (m, 2H).
Reference
- ^ Hudlicky, T .; Fan, R .; Reed, J. W .; Gadamasetti, K. G. Org. Reagovat. 1992, 41, 1-133. doi:10.1002 / 0471264180.nebo 041.01
- ^ Vogel, E. Angew. Chem. 1960, 72, 4.
- ^ Wender, P. A .; Eissenstat, M. A .; Filosa, M. P. J. Am. Chem. Soc. 1979, 101, 2196.
- ^ Arai, M .; Crawford, R. J. Umět. J. Chem. 1972, 50, 2158.
- ^ Baldwin, J. E.; Fleming, R. H.J. Am. Chem. Soc. 1973, 95, 5256.
- ^ Alcock, N. W .; Brown, J. M .; Conneely, J. A .; Stofko, Jr., J. J. J. Chem. Soc., Chem. Commun., 1975, 234.
- ^ Brule, D .; Chalchat, J. C .; Vessiere, R. Býk. Soc. Chim. Fr. 1978, Ne. 7-8, II-385.
- ^ A b Wender, P. A .; Filosa, M. P. J. Org. Chem. 1976, 41, 3490.
- ^ Marino, J. P .; Browne, L. J. Tetrahedron Lett. 1976, 3245.
- ^ A b Muller, P .; Rey, M. Helv. Chim. Acta, 1982, 65, 1191.
- ^ Hudlicky, T .; Rulin, F .; Lovelace, T .; Reed, J. W. in Studie v chemii přírodních produktů, Atta-ur-Rahman, Ed., Elsevier, Amsterdam, 1989, část B, s. 3.
- ^ Davies, H. M. L .; Clark, D. M .; Smith, T. K. Tetrahedron Lett. 1985, 26, 5659.
- ^ Pommelet, J. C .; Manisse, N .; Chuche, J. Čtyřstěn, 1972, 28, 3929.
- ^ Braun, R. A. J. Org. Chem. 1963, 28, 1383.
- ^ Eberbach, W .; Roser, J. Tetrahedron Lett. 1987, 28, 2685.
- ^ Manisse, N .; Chuche, J. Čtyřstěn, 1977, 33, 2399.
- ^ Baeyer, A. Ber. 1894, 27810; tamtéž. 1898, 31, 2067.
- ^ Vogel, E .; Ott, K.-H .; Gajek, K. Justus Liebigs Ann. Chem. 1961, 644, 172.
- ^ Schreiber, von J .; Leimgruber, W .; Pesaro, M .; Schudel, P .; Threlfall, T .; Eschenmoser, A. Helv. Chim. Acta 1961, 44, 540.
- ^ Jaenicke, L .; Akintobi, T .; Muller, D. G. Angew. Chem. Int. Vyd. Angl. 1971, 10, 492.
- ^ Piers, E .; Burmeister, M. S .; Reissig, H. U. Umět. J. Chem. 1986, 64, 180.
