Cyklooktan - Cyclooctane
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Cyklooktan | |
| Ostatní jména Cyklooktan | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.005.484 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C8H16 | |
| Molární hmotnost | 112,21 g / mol |
| Hustota | 0,834 g / cm3 |
| Bod tání | 14,59 ° C (58,26 ° F; 287,74 K) |
| Bod varu | 149 ° C (300 ° F; 422 K) |
| 7,90 mg / l | |
| −91.4·10−6 cm3/ mol | |
| Související sloučeniny | |
Příbuzný cykloalkany | Cykloheptan |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Cyklooktan je cykloalkan s molekulární vzorec (CH2)8.[1] Je to jednoduchý bezbarvý produkt uhlovodík, ale často se jedná o referenční sloučeninu pro sloučeniny nasyceného osmičlenného kruhu obecně.
Cyklooktan má kafrový zápach.[2]
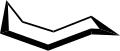
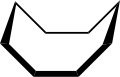
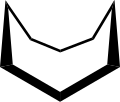
Konformace
The konformace cyklooktanu bylo intenzivně studováno za použití výpočetní metody. Hendrickson poznamenal, že „cyklooktan je nepochybně konformačně nejsložitější cykloalkan vzhledem k existenci mnoha konformérů srovnatelné energie“. Konformace křesla (níže) je nejstabilnější formou.[3] Tato konformace byla potvrzena Allingerem a spolupracovníky.[4] Korunní konformace (níže)[5] je o něco méně stabilní. Mezi mnoha sloučeninami vykazujícími konformaci koruny (struktura II) je S8, elementární síra.
Syntéza a reakce
Hlavní cestou k derivátům cyklooktanu je dimerizace butadien, katalyzované komplexy niklu (0), jako je nikl bis (cyklooktadien).[8] Tento proces mimo jiné poskytuje 1,5-cyklooktadien (COD), který lze hydrogenovat. CHSK je široce používán pro přípravu prekatalyzátorů pro homogenní katalýza. Aktivace těchto katalyzátorů pod H2, produkuje cyklooktan, který se obvykle vyhodí nebo spálí:
- C8H12 + 2 H2 → C.8H16
Cyklooktan se neúčastní žádných reakcí kromě těch, které jsou typické pro jiné nasycené uhlovodíky, spalování a halogenace volných radikálů. Práce v roce 2009 na funkcionalizaci alkanů, při nichž se používají peroxidy, jako je dikumylperoxid, do určité míry otevřely chemii, což umožnilo například zavedení fenylaminoskupiny.[9]
 Aminace cyklooktanu nitrobenzenem
Aminace cyklooktanu nitrobenzenem
Reference
- ^ Mackay, Donald (2006). Příručka fyzikálně-chemických vlastností a osudu životního prostředí pro organické chemikálie. CRC Press. p. 258. ISBN 978-1-56670-687-2.
- ^ Sell, C. S. (2006). „O nepředvídatelnosti zápachu“. Angew. Chem. Int. Vyd. 45 (38): 6254–6261. doi:10.1002 / anie.200600782. PMID 16983730.
- ^ Hendrickson, James B. (1967). "Molekulární geometrie V. Vyhodnocení funkcí a konformací středních kruhů". Journal of the American Chemical Society. 89 (26): 7036–7043. doi:10.1021 / ja01002a036.
- ^ Dorofeeva, O. V .; Mastryukov, V. S .; Allinger, N.L .; Almenningen, A. (1985). "Molekulární struktura a konformace cyklooktanu stanovená elektronovou difrakcí a výpočty molekulární mechaniky". The Journal of Physical Chemistry. 89 (2): 252–257. doi:10.1021 / j100248a015.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “konformace koruny ". doi:10.1351 / goldbook.C01422
- ^ A b C d E Pakes, P. W .; Rounds, T. C .; Strauss, H.L. (1981). "Konformace cyklooktanu a některých souvisejících oxokanů". The Journal of Physical Chemistry. 85 (17): 2469–2475. doi:10.1021 / j150617a013. ISSN 0022-3654.
- ^ Moss, G. P. (1996). „Základní terminologie stereochemie (doporučení IUPAC 1996)“. Čistá a aplikovaná chemie. 68 (12): 2193–2222. doi:10.1351 / pac199668122193. ISSN 0033-4545.
- ^ Thomas Schiffer, Georg Oenbrink, „Cyclododecatriene, Cyclooctadiene, and 4-Vinylcyclohexene“ v Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a08_205.
- ^ Deng, Guojun; Wenwen Chen; Chao-Jun Li (únor 2009). „Neobvyklá peroxidem zprostředkovaná aminace cykloalkanů nitroareny“. Pokročilá syntéza a katalýza. 351 (3): 353–356. doi:10.1002 / adsc.200800689.