SCF komplex - SCF complex
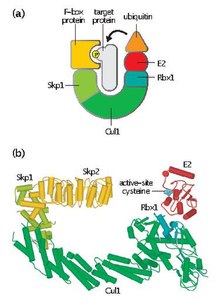
Skp, Cullin, F-box obsahující komplex (nebo SCF komplex) je multiproteinový E3 ubikvitin ligáza komplex, který katalyzuje ubikvitinace proteinů určených pro 26S proteazomální degradace.[1] Spolu s komplex podporující anafázi,[2] SCF má důležité role v ubikvitinace bílkovin zapojených do buněčného cyklu. Komplex SCF také označuje různé jiné buněčné proteiny ke zničení.[3]
Základní komponenty
SCF obsahuje variabilní protein F-box a tři základní podjednotky:
- F-box protein (FBP) - FBP přispívá k substrátové specificitě komplexu SCF první agregací do cílových proteinů nezávisle na komplexu. Každý FBP (např. Skp2) může rozpoznat několik různých substrátů způsobem, který je závislý na posttranslačních modifikacích, jako je fosforylace nebo glykosylace. FBP se poté váže na Skp1 komplexu SCF pomocí motivu F-boxu a přibližuje tak cílový protein k funkčnímu enzymu konjugujícímu s E2 ubikvitinem. FBP je také nezbytný při regulaci aktivity SCF v průběhu buněčného cyklu. Úrovně SCF se považují za konstantní během celého buněčného cyklu. Místo toho je afinita FBP k proteinovým substrátům regulována prostřednictvím fosforylace cílových proteinů zprostředkovanou cyklinem-CDK.[4]
- Skp1 - Skp1 je adaptorový protein, který je nezbytný pro rozpoznávání a vazbu proteinů F-boxu.
- Cullin (CUL1 ) - Cullin tvoří hlavní strukturální lešení komplexu SCF a spojuje doménu skp1 s doménou Rbx1. Různé kombinace Cullin a FBP mohou generovat v řádu stovek typů E3 ubikvitinových ligáz, které cílí na různé substráty.[5]
- RBX1 - Rbx1 obsahuje malou zinkovou vazebnou doménu prstu Opravdu zajímavý nový gen (RING), na kterou se váže enzym konjugující s ubikvitinem E2. Tato vazebná událost umožňuje přenos ubikvitinu z E2 na lysinový zbytek na cílovém proteinu.
Objev
První náznak, který vedl k objevu komplexu SCF, pochází z genetických obrazovek Saccharomyces cerevisiae, také známý jako začínající droždí. Mutanti teplotně citlivých cyklů buněčného dělení (Cdc) - jako Cdc4, Cdc34 a Cdc53[6]—Zatčen v G1 s nereplikovanou DNA a několika podlouhlými pupeny.[7] Fenotyp byl přičítán selhání degradace Sicí, inhibitoru komplexů S cyklin-CDK.[6] Tato zjištění naznačují, že proteolýza je důležitá v přechodu G1 / S.
Dále biochemické studie odhalily, že Cdc34 je enzym E2, který fyzicky interaguje s komplexem E3 ubikvitinové ligázy obsahujícím Skpl, Cdc4 a několik dalších proteinů.[6] Bylo zjištěno, že známí vazební partneři Skp1 - konkrétně Skp2, Cyclin F a Cdc4 - sdílejí přibližně 40 zbytkový motiv, který byl vytvořen jako motiv F-boxu. Hypotéza F-boxu[8] které následovaly po těchto objevech, navrhly, aby proteiny F-boxu přijímaly substráty zaměřené na degradaci a že Skp1 spojuje protein F-boxu s ubikvitinačním komplexem jádra.
Následné genetické studie v Caenorhabditis elegans později přispěl k objasnění dalších komplexních složek SCF.[8]
Regulace buněčného cyklu
Eukaryotický buněčný cyklus[9] je regulován syntézou, degradací, vazebnými interakcemi, posttranslačními úpravami regulačních proteinů. Z těchto regulačních proteinů jsou dvě ubikvitinové ligázy rozhodující pro postup kontrolními body buněčného cyklu. Komplex podporující anafázi (APC) řídí přechod metafáze-anafáze, zatímco komplex SCF řídí přechody G1 / S a G2 / M. Konkrétně se ukázalo, že SCF reguluje štěpení centriolu z pozdní telofázy na přechod G1 / S.[1]
Aktivita SCF je do značné míry regulována posttranslačními úpravami. Například autokatalytická degradace FBP zprostředkovaná ubikvitinem je mechanismem snižování aktivity SCF.
Dobře charakterizované substráty buněčného cyklu komplexů SCF zahrnují:
- proteiny rodiny cyklinů: cyklin D, cyklin E[2]
- transkripční regulátory: Myc, E2f1, p130[2]
- inhibitory kinázy závislé na cyklinu (CKI): p27Kip1, str.21, Wee1[2]
- proteiny centriolu: Cep250, Ninein[1]
Existuje přibližně sedmdesát lidských FBP, z nichž některé se podílejí na řízení buněčného cyklu jako součást komplexů SCF.[10]
Skp2 je FBP, který váže CKI, jako je p27Kip1 a str.[11] Skp2 váže p27Kip1 pouze pokud jsou splněny dvě podmínky: strKip1 je fosforylován E / A / CKD2 a vázán na Cks1. V důsledku vazby Skp2, s. 27Kip1 je ubikvitinovaný a cílený na degradaci v pozdním G1 a časném S.[4] SCF-Skp2 také cílí na p130 pro degradaci způsobem závislým na fosforylaci.
Beta-transducinový protein obsahující repetice (βTRCP) je FBP, který se zaměřuje na emi1 - inhibitor APC / C-Cdh1 - a wee1 na degradaci během časné mitózy.[2] βTRCP rozpoznává tyto substráty poté, co jsou fosforylovány Polo-podobnou kinázou 1 nebo cyklinem B-CDK1.
Fbw7, který je lidským homologem cdc4 v kvasnicích, je FBP, který se zaměřuje na degradaci cyklin E, Myc, Notch a c-Jun.[4] Fbw7 je stabilní během buněčného cyklu[12] a je lokalizován do jádra v důsledku přítomnosti nukleární lokalizační sekvence (NLS).[13] SCF-Fbw7 cílí na Sic1 - když je alespoň šest z devíti možných míst fosforylováno - a na Swi5 pro degradaci.[14] Protože Sic1 normálně brání předčasnému vstupu do S-fáze tím, že inhibuje cyklin B-CDK1, cílení na Sic1 pro degradaci podporuje vstup S-fáze. Je známo, že Fbw7 je haplo-nedostatečný tumor supresorový gen podílející se na několika sporadických karcinomech, pro který stačí jedna mutantní alela k narušení fenotypu divokého typu.[15]
Fbxo4 je další tumor-supresorový FBP, který se podílí na lidských karcinomech. SCF-fbxo4 hraje roli v řízení buněčného cyklu tím, že zacílí na degradaci cyklinu D1.[4]
Cyklin F je FBP, který je spojen s amyotrofickou laterální sklerózou (ALS) a frontotemporální demencí (FTD).[16][17] Mutace, které zabraňují fosforylaci cyklinu F, mění aktivitu SCF-cyklinu F, který pravděpodobně ovlivňuje následné procesy související s degenerací neuronů v ALS a FTD.[17] Normálně je cyklin F zaměřen na degradaci E2f1.
Rakovina
V poslední době se komplexy SCF staly atraktivním protirakovinovým cílem kvůli jejich upregulaci u některých lidských rakovin a jejich biochemicky odlišných aktivních míst.[18] Ačkoli mnoho z výše zmíněných FBP bylo zahrnuto do rakoviny, cytotoxicita byla limitujícím faktorem vývoje léčiva.[19]
Antisense oligonukleotidy a siRNA zaměřené na Skp2 jsou v procesu vývoje léčiv. Předběžné studie ukázaly, že downregulace Skp2 může inhibovat růst melanomů, buněk rakoviny plic, buněk rakoviny orálně a buněk glioblastomu.[19]
Ukázalo se, že siRNA zaměřené na βTRCP senzibilizují buňky rakoviny prsu a buňky rakoviny děložního čípku na stávající chemoterapie.[19]
Signalizace rostlinných hormonů
Rostlinný hormon auxin váže Tir1 (Transport Inhibitor Response 1). Tir1 je protein A-signalizující signalizace F-boxu (AFB), který působí jako auxinový receptor. Tir1 vázaný na auxin stimuluje vazbu SCF-Tir1 na represor AUX / IAA. Následná degradace represoru vede k aktivaci genů AUX / IAA (tj. Reagujících na auxin).[20]
Rostlinný hormon Jasmonate váže Coi1, FBP. SCF-Coi1 poté váže transkripční faktor JAZ a cílí jej na degradaci. Degradace transkripčního faktoru JAZ umožňuje transkripci genů reagujících na jasmonát.[21]
Reference
- ^ A b C Ou, Young; Rattner, J. B. (2004), „Centrozom ve vyšších organizmech: struktura, složení a duplikace“, International Review of Cytology, Elsevier, 238: 119–182, doi:10.1016 / s0074-7696 (04) 38003-4, ISBN 978-0-12-364642-2, PMID 15364198
- ^ A b C d E Fischer, Martin; Dang, Chi V .; DeCaprio, James A. (2018), „Řízení buněčného dělení“, Hematologie, Elsevier, s. 176–185, doi:10.1016 / b978-0-323-35762-3.00017-2, ISBN 978-0-323-35762-3
- ^ Morgan, David "Degradace proteinů při kontrole buněčného cyklu", Buněčný cyklus; Zásady kontroly 2007
- ^ A b C d Molekulární základ rakoviny. Elsevier. 2008. doi:10.1016 / b978-1-4160-3703-3. X5001-7. ISBN 978-1-4160-3703-3.
- ^ Hegde, Ashok N. (2010), „Odbourávání bílkovin závislých na ubikvitinu“, Komplexní přírodní produkty II, Elsevier, str. 699–752, doi:10.1016 / b978-008045382-8.00697-3, ISBN 978-0-08-045382-8, vyvoláno 2019-12-01
- ^ A b C Patton, E (01.06.1998). „Kombinatorická kontrola v proteolýze závislé na ubikvitinu: nevynechávejte hypotézu F-boxu“. Trendy v genetice. 14 (6): 236–243. doi:10.1016 / s0168-9525 (98) 01473-5. ISSN 0168-9525. PMID 9635407.
- ^ Schwob, E (1994-10-21). „Inhibitor cyklinkinázy typu B p40SIC1 řídí přechod G1 na S u S. cerevisiae“. Buňka. 79 (2): 233–244. doi:10.1016/0092-8674(94)90193-7. ISSN 0092-8674. PMID 7954792.
- ^ A b Willems, Andrew R .; Schwab, Michael; Tyers, Mike (listopad 2004). „Stopařův průvodce po cullin ubikvitinové ligázy: SCF a jeho příbuzní“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1695 (1–3): 133–170. doi:10.1016 / j.bbamcr.2004.09.027. ISSN 0167-4889. PMID 15571813.
- ^ Vodermaier, Hartmut C. (září 2004). "APC / C a SCF: vzájemné ovládání a buněčný cyklus". Aktuální biologie. 14 (18): R787 – R796. doi:10.1016 / j.cub.2004.09.020. ISSN 0960-9822. PMID 15380093.
- ^ Lambrus, Bramwell G .; Moyer, Tyler C .; Holland, Andrew J. (2017-08-31). „Uplatnění systému auxinem indukovatelné degradace (AID) pro rychlé vyčerpání proteinů v savčích buňkách“. doi:10.1101/182840. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Frescas, David; Pagano, Michele (červen 2008). „Deregulovaná proteolýza proteiny F-boxu SKP2 a β-TrCP: naklonění váhy rakoviny“. Nature Reviews Cancer. 8 (6): 438–449. doi:10.1038 / nrc2396. ISSN 1474-175X. PMC 2711846. PMID 18500245.
- ^ Mathias, Neal; Steussy, C. Nic; Goebl, Mark G. (1998-02-13). "Pro navázání na komplex obsahující Cdc4p a Cdc53p inSaccharomyces cerevisiae je vyžadována základní doména v Cdc34p". Journal of Biological Chemistry. 273 (7): 4040–4045. doi:10.1074 / jbc.273.7.4040. ISSN 0021-9258. PMID 9461595.
- ^ Blondel, M. (2000-11-15). „Jaderně specifická degradace Far1 je řízena lokalizací proteinu F-box Cdc4“. Časopis EMBO. 19 (22): 6085–6097. doi:10.1093 / emboj / 19.22.6085. ISSN 1460-2075. PMC 305831. PMID 11080155.
- ^ Kishi, T .; Ikeda, A .; Koyama, N .; Fukada, J .; Nagao, R. (11.9.2008). „Vylepšený dvouhybridní systém odhaluje, že degradace Swi5 závislá na SCFCdc4 přispívá k regulačnímu mechanismu vstupu do S-fáze“. Sborník Národní akademie věd. 105 (38): 14497–14502. Bibcode:2008PNAS..10514497K. doi:10.1073 / pnas.0806253105. ISSN 0027-8424. PMC 2567208. PMID 18787112.
- ^ Calhoun, Eric S .; Jones, Jessa B .; Ashfaq, Raheela; Adsay, Volkan; Baker, Suzanne J .; Valentine, Virginie; Hempen, Paula M .; Hilgers, Werner; Yeo, Charles J .; Hruban, Ralph H .; Kern, Scott E. (říjen 2003). „Mutace BRAF a FBXW7 (CDC4, FBW7, AGO, SEL10) v odlišných podskupinách rakoviny pankreatu“. American Journal of Pathology. 163 (4): 1255–1260. doi:10.1016 / s0002-9440 (10) 63485-2. ISSN 0002-9440. PMC 1868306. PMID 14507635.
- ^ Yu, Yujiao; Nakagawa, Tadashi; Morohoshi, Akane; Nakagawa, Makiko; Ishida, Noriko; Suzuki, Naoki; Aoki, Masashi; Nakayama, Keiko (2019-09-30). „Patogenní mutace v genu ALS CCNF způsobují cytoplazmatickou mislokalizaci cyklinu F a zvýšenou aktivitu VCP ATPázy.“ Lidská molekulární genetika. 28 (20): 3486–3497. doi:10,1093 / hmg / ddz119. ISSN 0964-6906. PMID 31577344.
- ^ A b Lee, Albert; Rayner, Stephanie L .; De Luca, Alana; Gwee, Serene S.L .; Morsch, Marco; Sundaramoorthy, Vinod; Shahheydari, Hamideh; Ragagnin, Audrey; Shi, Bingyang; Yang, Shu; Williams, Kelly L. (říjen 2017). „Fosforylace kasein kinázy II cyklinu F na serinu 621 reguluje aktivitu Lys48-ubikvitylace E3 ligázy komplexu SCF (cyklin F)“. Otevřená biologie. 7 (10): 170058. doi:10.1098 / rsob.170058. ISSN 2046-2441. PMC 5666078. PMID 29021214.
- ^ Skaar, Jeffrey R .; Pagan, Julia K .; Pagano, Michele (prosinec 2014). „Terapie cílené na ubikvitin ligázu SCF“. Recenze přírody Objev drog. 13 (12): 889–903. doi:10.1038 / nrd4432. ISSN 1474-1776. PMC 4410837. PMID 25394868.
- ^ A b C Sun, L. Jia a Y. (2011-02-28). „SCF E3 ubikvitinové ligázy jako protirakovinné cíle“. Současné cíle proti rakovině. 11 (3): 347–356. doi:10.2174/156800911794519734. PMC 3323109. PMID 21247385.
- ^ Dharmasiri, Nihal; Dharmasiri, Sunethra; Estelle, Mark (květen 2005). „F-box protein TIR1 je auxinový receptor“. Příroda. 435 (7041): 441–445. Bibcode:2005 Natur.435..441D. doi:10.1038 / nature03543. ISSN 0028-0836. PMID 15917797.
- ^ Devoto, Alessandra; Nieto-Rostro, Manuela; Xie, Daoxin; Ellis, Christine; Harmston, Rebecca; Patrick, Elaine; Davis, Jackie; Sherratt, Leigh; Coleman, Mark; Turner, John G. (listopad 2002). „COI1 spojuje jasmonátovou signalizaci a plodnost s komplexem ubikvitin-ligázy SCF v Arabidopsis“. The Plant Journal. 32 (4): 457–466. doi:10.1046 / j.1365-313x.2002.01432.x. ISSN 0960-7412. PMID 12445118.

Morgan, David "Degradace proteinů při kontrole buněčného cyklu", Buněčný cyklus; Zásady kontroly 2007

Hartmut C. Vodermaier (2004). „APC / C a SCF: Controlling navzájem a buněčný cyklus“, Current Biology, 14 (787)


