Pom1 - Pom1
| Pom1 | |
|---|---|
| Identifikátory | |
| Organismus | |
| Symbol | SPAC2F7.03c |
| Entrez | 2541889 |
Pom1 je protein polarity kináza ve štěpných kvasnicích, Schizosaccharomyces pombe (S. pombe), který se lokalizuje na buněčné konce a reguluje buněčné dělení. Jak se buňka prodlužuje, hladina Pom1 ve středu klesá, což spouští mitózu.[1]
The gen pom1 kóduje protein dlouhý 1087 aminokyselin s proteinem kináza doména pravděpodobně umístěná na karboxylovém konci.[1] Pom1 reguluje signální cestu, která zahrnuje Cdk1 a nakonec reguluje mitotický vstup.[2] Buňky s mutovaným pom1 tvoří septa a růstovou zónu, ale vykazují řadu abnormalit, včetně nesprávně umístěných nebo nesprávně orientovaných septa, bipolárního růstu nahrazeného náhodným růstem na jednom konci nebo nesprávné lokalizace růstové osy vedoucí k abnormálnímu rozvětvení.[1][3]
Pom1 hraje důležitou roli při rozlišování starého a nového konce S. pombe buňka. Normální růst buněk začíná okamžitě na starém konci buňky a se zpožděním na novém konci.[3] pom1 mutanti vykazují okamžitý růst na obou koncích. Protože se ukázalo, že Pom1 je na novém konci vysoce koncentrovaný a na starém konci téměř chybí, je spolu s dalšími faktory součástí inhibičního signálu, který brání okamžitému růstu z nového konce.[1] Nadměrná exprese Pom1 může také vést k tvorbě nových růstových konců.[3]
Pom1 je relativně jedinečný protein kináza jako jeho nejbližší homolog v S. pombe je pouze 55% identická. Homology v jiných organismech zahrnují Dyrk u potkanů, Dyrk2 a Dyrk3 u lidí, Yak1p v S. cerevisiae,[4] a minibrain u Drosophily a lidí.[1][5]
Lokalizace buněk
V době mezifáze „Pom1 sídlí v celé buňce včetně mediálních kortikálních uzlin. Lokalizace Pom1 k pólům během buněčného dělení je regulována pomocí Tea1 a Tea2.[6][7] Při nepřítomnosti Tea1 a Tea2 si Pom1 udržuje svoji kináza aktivita, ale nelokalizuje se na konce buňky.[3][7] Mikrotubuly také pomozte lokalizovat Pom1 v buňce, protože bylo prokázáno, že přemístění Pom1 je výsledkem mikrotubul demontáž.[1] Strukturálně jsou pro lokalizaci na konci buněk nezbytné jak katalytické, tak nekatalytické oblasti Pom1.[3]
Cdr2, Cdr1, Wee1 Proteiny Mid1 a Blt1 jsou také lokalizovány v mediálním uzlu během mezifáze a předpokládá se, že jsou součástí signální dráhy pro mitotický vstup.[2][8] Lokalizace Cdr2 do středu buňky je regulována expresí Pom1 a dalších signálů, protože mutanty pom1 umožňují Cdr2 difundovat z lokalizace mediálního uzlu do jedné poloviny buňky.[2]
Velikost buňky a prostorový gradient
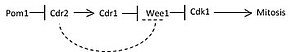
Pom1 vytváří prostorový gradient, když se buňky prodlužují Fáze G2.[2] Obrázek 1 ilustruje v karikatuře přechod Pom1 (znázorněný tmavým stínováním) napříč relativně malou buňkou během mezifáze a protáhlá buňka procházející skrz Fáze G2. Jak se buňky prodlužují, koncentrace Pom1 vrcholí na dvou pólech a klesá směrem ke středu buňky. Cdr2 čte klesající inhibiční signál z koncentračního gradientu Pom1 a aktivuje Cdr1 a Blt1, které byly lokalizovány v mediálním uzlu kvůli náboru Cdr2.[2] Cdr1 pak fosforyluje a inhibuje Wee1, také přijati do mediálního uzlu přítomností Cdr2.[2] Fosforylovaný Wee1 umožňuje Cdc25 defosforylovat Cdk1 a přesuňte buňku dovnitř mitóza.[2] Obrázek 2 zobrazuje zjednodušenou signalizační cestu pro velikostně závislý mitotický vstup na základě tohoto modelu. Inhibice Wee1 přímo Cdr2 zobrazené čárkovanou čarou ještě nebylo potvrzeno.
Zkoušky modelu Pom1

Ukázalo se, že Pom1 označený GFP vytváří gradient v podlouhlých buňkách, jak je charakterizováno na obrázku 1. Podle obrázku 2 snížená Pom1 v místě Cdr2 v mediálním uzlu snižuje inhibici Cdr2. Jako potvrzení interakce tohoto modelu výsledky ukazují, že buňky s delokalizovaným Pom1, které zůstávají plné kináza aktivita mutantů tea1 zpomaluje mitotický vstup. To je pravděpodobně způsobeno pokračující inhibicí Cdr2.[2] Další experimenty, které ektopicky lokalizovaly Pom1 v celé kůře, také ukázaly opožděný mitotický vstup ekvivalentní a cdr2 knockdown znovu naznačuje, že Pom1 inhibuje Cdr2 a jak Pom1 klesá s prodloužením buněk, Cdr2 začíná signální cestu k inhibici Wee1 a nakonec vstoupit mitóza.[2]
Budoucí výzkum
Zůstává nejasné, zda Cdr2 inhibuje Wee1 přímo nebo pokud jedná pouze nepřímo prostřednictvím Cdr1 nebo jiného kinázy. Kromě toho může Blt1, také lokalizovaný v mediálním uzlu, hrát roli v regulaci mitotického vstupu. Mutanti Blt1 vykazují prodlouženou délku v souladu se zpožděným mitotickým vstupem.[2] I když je v současné době nepotvrzeno, spekuluje se, že Blt1 působí inhibicí Wee1.[2]
Reference
- ^ A b C d E F Bahler, J. a Pringle, J. R. "Pom1p, štěpná kvasinková proteinová kináza, která poskytuje informace o poloze jak pro polarizovaný růst, tak pro cytokinézu." Genes and Development 12, 1356-1370 (1998).
- ^ A b C d E F G h i j k Moseley, J. B., Mayeux, A., Paoletti, A. a Nurse, P. „Prostorový gradient koordinuje velikost buněk a mitotický vstup do štěpných kvasinek.“ Nature 459, 857-861 (2009).
- ^ A b C d E Bahler, J. a Nurse, P. "Štěpná kvasinková aktivita kinázy Pom1p je regulována buněčným cyklem a je nezbytná pro buněčnou symetrii během růstu a dělení." EMBO Journal 20, 1064-1073 (2001).
- ^ Souza, G. M., Lu, S. a Kuspa, A. „YakA, protein kináza potřebné pro přechod od růstu k vývoji v Dictyostelium. Development 125, 2291-2302 (1998).
- ^ Tejedor, F., Zhu, X.R., Kaltenbach, E., Ackermann, A., Baumann, A., Canal, I., Heisenberg, M., Fischbach, K.F. a Pongs, O. „Minibrain: nový protein kináza rodina zapojená do postembryonální neurogeneze u Drosophila. Neuron 14, 287-301 (1995).
- ^ Browning, H., Hayles, J., Mata, J., Aveline, L., Nurse, P. a McIntosh, J. R. „Tea2p je protein podobný kinesinu potřebný pro generování polarizovaného růstu štěpných kvasinek.“ The Journal of Cell Biology 151,15-27 (2000).
- ^ A b Behrens, R. a Nurse, P. „Role štěpného droždí tea1p v lokalizaci faktorů polarity a při organizaci mikrotubulárního cytoskeletu.“ The Journal of Cell Biology 157, 783-793 (2002).
- ^ Morrell, J.L., Nichols, C.B. a Gould, K.L. "Kináza rodiny GIN4, Cdr2p, působí nezávisle na septinech ve štěpných kvasinkách." The Journal of Cell Science 117, 5293-5302 (2004).
