Capecitabin - Capecitabine
 | |
 | |
| Klinické údaje | |
|---|---|
| Výslovnost | /k…strɪˈsaɪtəbiːn/ |
| Obchodní názvy | Xeloda, Xitabin, Kapetral a další |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a699003 |
| Licenční údaje | |
| Těhotenství kategorie |
|
| Trasy z správa | Pusou |
| Třída drog | chemoterapeutický prostředek |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | Rozsáhlý |
| Vazba na bílkoviny | < 60% |
| Metabolismus | játra, na 5'-DFCR, 5'-DFUR (neaktivní); neoplastická tkáň, 5'-DFUR na aktivní fluorouracil |
| Odstranění poločas rozpadu | 38–45 minut |
| Vylučování | ledviny (95,5%), fekální (2,6%) |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.112.980 |
| Chemické a fyzikální údaje | |
| Vzorec | C15H22FN3Ó6 |
| Molární hmotnost | 359.354 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| (ověřit) | |
Capecitabin, prodávané pod značkou Xeloda mimo jiné je a chemoterapie léky používá se k léčbě rakovina prsu, rakovina žaludku a kolorektální karcinom.[1] U rakoviny prsu se často používá společně s docetaxel.[2] Je to přijato pusou.[2]
Mezi časté nežádoucí účinky patří bolest břicha, zvracení, průjem slabost a vyrážky.[2] Mezi další závažné nežádoucí účinky patří problémy se srážením krve, alergické reakce, srdeční problémy jako kardiomyopatie, a nízký počet krvinek.[2] Nedoporučuje se u lidí s problémy s ledvinami.[2] Používejte během těhotenství může mít za následek poškození dítěte.[2] Kapecitabin uvnitř těla se převádí na 5-fluorouracil (5-FU), jehož prostřednictvím jedná.[2] Patří do třídy léků známých jako fluoropyrimidiny, který také zahrnuje 5-fluorouracil a tegafur.[3]
Capecitabin byl patentován v roce 1992 a pro lékařské použití schválen v roce 1998.[4] Je na Seznam základních léčivých přípravků Světové zdravotnické organizace.[5]
Lékařské použití
Používá se při léčbě následujících druhů rakoviny:[6][7][8]
- Kolorektální karcinom (buď jako neoadjuvantní léčba ozařováním, adjuvantní léčba nebo pro metastatické případy)
- Rakovina prsu (metastazující nebo jako monoterapie / kombinovaná léčba; toto je ve Velké Británii licencováno jako léčba druhé linie)
- Rakovina žaludku (mimo USA v USA; toto je licencované označení ve Velké Británii)
- Rakovina jícnu (mimo označení v USA)
Nepříznivé účinky
Nežádoucí účinky podle frekvence:[9][10][11][12]
- Velmi časté (> 10% frekvence)
- Ztráta chuti k jídlu
- Průjem
- Zvracení
- Nevolnost
- Stomatitida
- Bolest břicha
- Únava
- Slabost
- Syndrom ruka-noha[13]
- Otok
- Horečka
- Bolest
- Bolest hlavy
- Ztráta vlasů
- Dermatitida
- Špatné trávení
- Dušnost
- Podráždění očí
- Myelosuprese[Poznámka 1]
Poznámky k nepříznivým účinkům:
- ^ Zahrnuje: anémie, lymfopenie, neutropenie a trombocytopenie
Kontraindikace
Kontraindikace zahrnují:[11]
- Přecitlivělost na fluorouracil, kapecitabin nebo na kteroukoli pomocnou látku tohoto přípravku v anamnéze
- Nedostatek DPD (vidět Farmakogenetika )
- Těhotenství a kojení
- Těžká leukopenie, neutropenie nebo trombocytopenie
- Těžké poškození jater nebo závažné poškození ledvin
- Léčba sorivudin nebo jeho chemicky příbuzné analogy, jako např brivudin
Lékové interakce
Léky, o kterých je známo, že s nimi interagují, zahrnují:[11]
- Sorivudin nebo jeho analogy, jako například brivudin.
- CYP2C9 substráty, včetně warfarin a další antikoagulancia s deriváty kumarinu
- Fenytoin, protože zvyšuje plazmatické koncentrace fenytoinu.
- Folinát vápenatý může zvýšit terapeutické účinky kapecitabinu prostřednictvím synergie s jeho metabolitem, 5-FU. Prostřednictvím této synergie může také vyvolat závažnější průjem.[6]
Farmakogenetika
The dihydropyrimidin dehydrogenáza Enzym (DPD) je zodpovědný za detoxikační metabolismus fluoropyrimidinů, což je třída léků, která zahrnuje kapecitabin, 5-fluorouracil a tegafur.[3] Genetické variace v genu DPD (DPYD) může vést ke snížení nebo absenci aktivity DPD a jednotlivcům, kteří jsou heterozygotní nebo homozygotní pro tyto varianty mohou být částečné nebo úplné Nedostatek DPD; odhaduje se, že 0,2% jednotlivců má úplnou Nedostatek DPD.[3][14] Pacienti s částečným nebo úplným nedostatkem DPD mají při léčbě fluoropyrimidiny významně zvýšené riziko závažné nebo dokonce smrtelné toxicity léčiva; příklady toxicit zahrnují myelosuprese, neurotoxicita a syndrom ruka-noha.[3][14]
Mechanismus účinku
Kliknutím na geny, bílkoviny a metabolity níže zobrazíte odkazy na příslušné články.[§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „FluoropyrimidinActivity_WP1601“.
Kapecitabin je metabolizován na 5-FU, což je a thymidylát syntáza inhibitor, tedy inhibuje syntézu thymidin monofosfát (ThMP), aktivní forma thymidinu, která je nezbytná pro de novo syntéza DNA.[7]
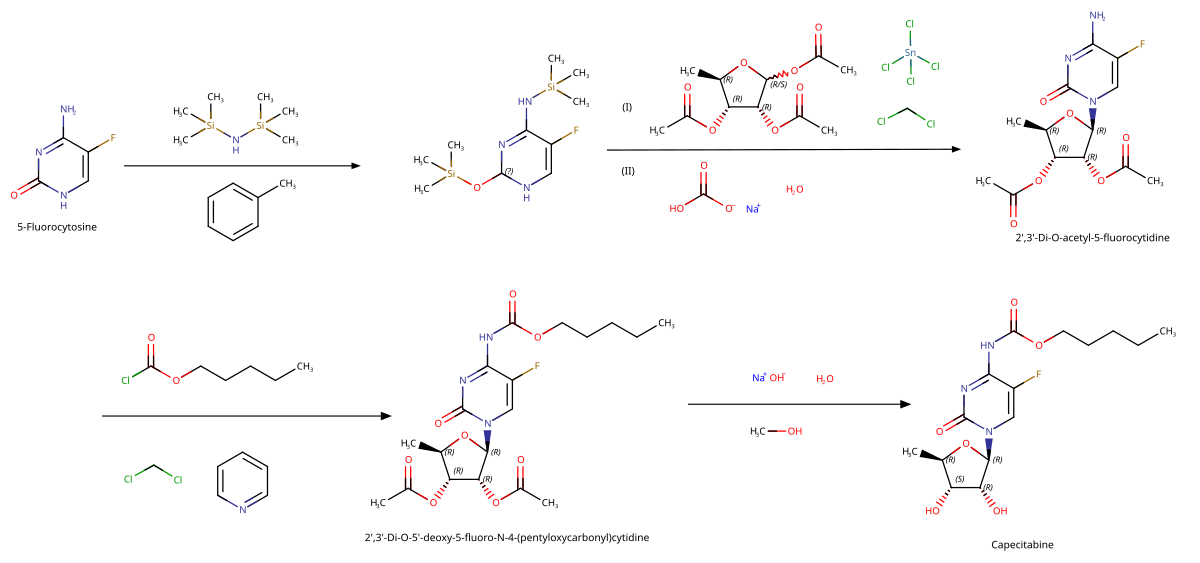
Syntéza léčiv
Společnost a kultura
Názvy značek
Jednou ze značek je Xeloda, prodávaná společností Genentech.
Mezi další patří Xitabin, Capcibin a Kapetral.
Reference
- ^ Britské národní složení: BNF 69 (69 ed.). Britská lékařská asociace. 2015. s. 585, 588. ISBN 9780857111562.
- ^ A b C d E F G "Capecitabine". Americká společnost farmaceutů zdravotnického systému. Archivováno z původního dne 15. dubna 2016. Citováno 8. prosince 2016.
- ^ A b C d Caudle KE, Thorn CF, Klein TE, Swen JJ, McLeod HL, Diasio RB, Schwab M (prosinec 2013). „Pokyny pro konsorcium pro klinickou farmakogenetiku pro genotyp dihydropyrimidin dehydrogenázy a dávkování fluoropyrimidinu“. Klinická farmakologie a terapeutika. 94 (6): 640–5. doi:10.1038 / clpt.2013.172. PMC 3831181. PMID 23988873.
- ^ Fischer J, Ganellin CR (2006). Analogový objev drog. John Wiley & Sons. str. 511. ISBN 9783527607495.
- ^ Světová zdravotnická organizace (2019). Seznam základních léků Světové zdravotnické organizace: 21. seznam 2019. Ženeva: Světová zdravotnická organizace. hdl:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Licence: CC BY-NC-SA 3.0 IGO.
- ^ A b Rossi S, ed. (2013). Příručka australských léčivých přípravků (Vyd. 2013). Adelaide: The Australian Medicines Handbook Unit Trust. ISBN 978-0-9805790-9-3.
- ^ A b „Dávkování přípravku Xeloda (kapecitabin), indikace, interakce, nežádoucí účinky a další“. Referenční příručka Medscape. WebMD. 25. ledna 2014. Archivováno z původního dne 2. února 2014.
- ^ Smíšený výbor pro formulaci (2013). British National Formulary (BNF) (65 ed.). London, UK: Pharmaceutical Press. ISBN 978-0-85711-084-8.
- ^ „Tableta XELODA (kapecitabin) potažená filmem [Genentech, Inc.]“. DailyMed. Genentech, Inc. prosinec 2013. Archivováno z původního dne 1. února 2014. Citováno 25. ledna 2014.
- ^ "Capecitabine Teva: EPAR - informace o produktu" (PDF). Evropská agentura pro léčivé přípravky. Teva Pharma B.V. 10. ledna 2014. Archivováno (PDF) z původního dne 4. února 2014. Citováno 25. ledna 2014.
- ^ A b C „Capecitabine 150mg - Souhrn údajů o přípravku (SPC)“. elektronické souhrn léků. Zentiva. 23. prosince 2013. Archivovány od originál dne 1. února 2014. Citováno 25. ledna 2014.
- ^ „NÁZEV LÉČIVÉHO PŘÍPRAVKU XELODA® Capecitabine“ (PDF). Služby eBusiness TGA. Roche Products Pty Limited. 5. prosince 2013. Archivováno z původního dne 11. září 2017. Citováno 25. ledna 2014.
- ^ Zčervenání, otoky, necitlivost a deskvamace na dlaních a chodidlech
- ^ A b Amstutz U, Froehlich TK, Largiadèr ČR (září 2011). „Gen dihydropyrimidin dehydrogenázy jako hlavní prediktor závažné toxicity 5-fluorouracilu“. Farmakogenomika. 12 (9): 1321–36. doi:10,2217 / str. 11,72. PMID 21919607.
Další čtení
- Dean L (2016). „Terapie kapecitabinem a genotyp DPYD“. In Pratt VM, McLeod HL, Rubinstein WS, et al. (eds.). Shrnutí lékařské genetiky. Národní centrum pro biotechnologické informace (NCBI). PMID 28520372. ID police: NBK385155.
externí odkazy
- "Capecitabine". Informační portál o drogách. Americká národní lékařská knihovna.

