Dihydrofolátreduktáza - Dihydrofolate reductase
| Dihydrofolátreduktáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
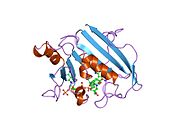
 Krystalová struktura kuřecích jater dihydrofolátreduktázy. Vstup PDB 8dfr | |||||||||
| Identifikátory | |||||||||
| EC číslo | 1.5.1.3 | ||||||||
| Číslo CAS | 9002-03-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Dihydrofolátreduktáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | DHFR_1 | ||||||||
| Pfam | PF00186 | ||||||||
| Pfam klan | CL0387 | ||||||||
| InterPro | IPR001796 | ||||||||
| STRÁNKA | PDOC00072 | ||||||||
| SCOP2 | 1dhi / Rozsah / SUPFAM | ||||||||
| |||||||||
| R67 dihydrofolátreduktáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
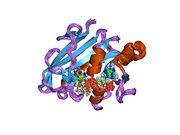
 Struktura plazmem kódované dihydrofolátreduktázy s vysokým rozlišením E-coli. Vstup PDB 2gqv | |||||||||
| Identifikátory | |||||||||
| Symbol | DHFR_2 | ||||||||
| Pfam | PF06442 | ||||||||
| InterPro | IPR009159 | ||||||||
| SCOP2 | 1vif / Rozsah / SUPFAM | ||||||||
| |||||||||
Dihydrofolátreduktázanebo DHFR, je enzym to snižuje kyselina dihydrofolová na kyselina tetrahydrofolová, použitím NADPH tak jako dárce elektronů, které lze převést na druhy tetrahydrofolátu kofaktory používá se v chemii přenosu 1-uhlíku. U lidí je enzym DHFR kódován DHFR gen.[5][6]Nachází se v oblasti q11 → q22 chromozomu 5.[7] Bakteriální druh mají odlišné DHFR enzymy (na základě jejich vzorce vazby diaminoheterocyklických molekul), ale savčí DHFR jsou velmi podobné.[8]
Struktura
Centrální osm pramenů skládaný list beta tvoří hlavní rys polypeptid skládání páteře z DHFR.[9] Sedm z těchto řetězců je paralelních a osmý probíhá antiparalelně. Čtyři alfa helixy připojte po sobě jdoucí řetězce beta.[10] Zbytky 9 - 24 se nazývají „Met20“ nebo „smyčka 1“ a spolu s dalšími smyčkami jsou součástí hlavní subdomény, která obklopuje Aktivní stránky.[11] The Aktivní stránky se nachází v N-terminál polovina sekvence, která zahrnuje a konzervovaný Pro -Trp dipeptid; the tryptofan bylo prokázáno, že je zapojen do vazby Podklad enzymem.[12]

Lidský DHFR s vázaným dihydrofolátem a NADPH
Funkce
Konvertuje dihydrofolátreduktáza dihydrofolát do tetrahydrofolát, protonový člun potřebný pro syntézu de novo puriny, kyselina thymidylová a jisté aminokyseliny. Zatímco funkční gen dihydrofolátreduktázy byl mapován na chromozom 5, bylo na samostatných chromozomech identifikováno několik intronless zpracovaných pseudogenů nebo genů podobných dihydrofolátreduktáze.[13]

Reakce katalyzovaná DHFR.

Cesta syntézy tetrahydrofolátu.
DHFR, který se nachází ve všech organismech, má zásadní roli v regulaci množství tetrahydrofolátu v buňce. Tetrahydrofolát a jeho deriváty jsou nezbytné pro purin a thymidylát syntéza, které jsou důležité pro buněčnou proliferaci a růst buněk.[14] DHFR hraje ústřední roli při syntéze nukleová kyselina prekurzory a ukázalo se, že mutantní buňky, které zcela postrádají DHFR, vyžadují ke svému růstu glycin, aminokyselinu a thymidin.[15] DHFR byl také prokázán jako enzym podílející se na záchraně tetrahydrobiopterinu z dihydrobiopterinu[16]
Mechanismus

Obecný mechanismus
DHFR katalyzuje přenos hydridu z NADPH na dihydrofolát s doprovodnou protonací k výrobě tetrahydrofolát.[14] Nakonec se dihydrofolát redukuje na tetrahydrofolát a NADPH se oxiduje na NADP +. Vysoká flexibilita Met20 a dalších smyček v blízkosti aktivního místa hraje roli při podpoře uvolňování produktu, tetrahydrofolátu. Zejména smyčka Met20 pomáhá stabilizovat nikotinamidový kruh NADPH, aby podporoval přenos hydridu z NADPH na dihydrofolát.[11]

Mechanismus tohoto enzymu je postupný a ustálený stav náhodný. Konkrétně katalytická reakce začíná NADPH a substrátem navázaným na vazebné místo enzymu, následovanou protonací a přenosem hydridu z kofaktoru NADPH na substrát. Dva poslední kroky však neprobíhají současně ve stejném přechodovém stavu.[17][18] Ve studii využívající výpočetní a experimentální přístupy Liu et al k závěru, že krok protonace předchází přenosu hydridu.[19]

Ukázalo se, že enzymatický mechanismus DHFR je závislý na pH, zejména na kroku přenosu hydridu, protože se ukázalo, že změny pH mají pozoruhodný vliv na elektrostatiku aktivního místa a ionizační stav jeho zbytků.[19] Kyselost cíleného dusíku na substrátu je důležitá při vazbě substrátu na vazebné místo enzymu, což se ukázalo jako hydrofobní, i když má přímý kontakt s vodou.[17][20] Asp27 je jediný nabitý hydrofilní zbytek ve vazebném místě a neutralizace náboje na Asp27 může změnit pKa enzymu. Asp27 hraje kritickou roli v katalytickém mechanismu tím, že pomáhá s protonací substrátu a omezuje substrát v konformaci příznivé pro přenos hydridů.[21][17][20] Ukázalo se, že protonační krok je spojen s tautomerizací enolů, i když tato přeměna není považována za příznivou pro darování protonu.[18] Je prokázáno, že molekula vody je zapojena do protonačního kroku.[22][23][24] Vstup molekuly vody do aktivního místa enzymu usnadňuje smyčka Met20.[25]
Konformační změny DHFR
Katalytický cyklus reakce katalyzovaný DHFR zahrnuje pět důležitých meziproduktů: holoenzym (E: NADPH), Michaelisův komplex (E: NADPH: DHF), ternární produktový komplex (E: NADP+: THF), binární komplex tetrahydrofolátu (E: THF) a komplex THF ‚NADPH (E: NADPH: THF). Krok disociace produktu (THF) z E: NADPH: THF na E: NADPH je krok určující rychlost během obratu v ustáleném stavu.[21]
Konformační změny jsou v katalytickém mechanismu DHFR zásadní.[26] Smyčka Met20 DHFR je schopna otevřít, zavřít nebo uzavřít aktivní místo.[23][17] Odpovídajícím způsobem jsou Met20 přiřazeny tři různé konformace klasifikované jako otevřené, uzavřené a uzavřené stavy. Kromě toho byla definována extra zkreslená konformace Met20 kvůli jeho nejasným výsledkům charakterizace.[23] Smyčka Met20 je pozorována v uzavřené konformaci ve třech meziproduktech ligujících produkt, kde je nikotinamidový kruh uzavřen z aktivního místa. Tato konformační funkce odpovídá za skutečnost, že substituce NADP+ NADPH je před disociací produktu. Další kolo reakce tedy může nastat po navázání substrátu.[21]


R67 DHFR
Díky své jedinečné struktuře a katalytickým vlastnostem je R67 DHFR široce studován. R67 DHFR je DHFR kódovaný R-plazmidem typu II bez genetického a strukturního vztahu k chromozomálnímu DHFR E. coli. Jedná se o homotetramer, který má symetrii 222 s jediným pórem aktivního místa, který je vystaven rozpouštědlu [null.][27] Tato symetrie aktivního místa vede k odlišnému způsobu vazby enzymu: Může se vázat se dvěma molekulami dihydrofolátu (DHF) s pozitivní kooperativitou nebo dvěma molekulami NADPH s negativní kooperativitou nebo jedním substrátem plus jeden, ale pouze ten druhý má katalytický aktivita.[28] Ve srovnání s E. coli chromozomálním DHFR má vyšší K.m ve vazbě dihydrofolátu (DHF) a NADPH. Mnohem nižší katalytická kinetika ukazuje, že přenos hydridů je spíše krokem určujícím rychlost než uvolňování produktu (THF).[29]
Ve struktuře R67 DHFR tvoří homotetramer póry aktivního místa. V katalytickém procesu vstupují DHF a NADPH do pórů z opačné polohy. Interakce skládání π-π mezi nikotinamidovým kruhem NADPH a pteridinovým kruhem DHF těsně spojuje dva reaktanty v aktivním místě. Po navázání však byla pozorována flexibilita p-aminobenzoylglutamátového konce DHF, což může podporovat tvorbu přechodového stavu.[30]
Klinický význam
Nedostatek dihydrofolát reduktázy byl spojen s megaloblastická anémie.[13] Léčba probíhá snížena formy kyseliny listové. Protože tetrahydrofolát, produkt této reakce, je u lidí aktivní formou folátu, může inhibice DHFR způsobit funkční nedostatek folátu. DHFR je atraktivní farmaceutický cíl pro inhibici díky své klíčové roli při syntéze prekurzoru DNA. Trimethoprim, an antibiotikum, zatímco inhibuje bakteriální DHFR methotrexát, a chemoterapie činidlo, inhibuje savčí DHFR. Nicméně, odpor se vyvinul proti některým lékům v důsledku mutačních změn samotného DHFR.[31]
Mutace DHFR způsobují vzácnou autozomálně recesivní vrozenou chybu metabolismu folátu, která vede megaloblastická anémie, pancytopenie a těžké nedostatek mozkových folátů kterou lze opravit pomocí kyselina folinová doplnění.[32][33]
Terapeutické aplikace
Vzhledem k tomu, že folát je nezbytný pro rychlé dělení buněk tymin lze tento účinek využít k terapeutické výhodě.
DHFR lze cílit při léčbě rakoviny a jako potenciální cíl proti bakteriálním infekcím. DHFR je zodpovědný za hladiny tetrahydrofolátu v buňce a inhibice DHFR může omezit růst a proliferaci buněk, které jsou charakteristické pro rakovinu a bakteriální infekce. Methotrexát, a kompetitivní inhibitor DHFR, je jedním z takových protinádorových léčiv, které inhibují DHFR.[34] Mezi další léky patří trimethoprim a pyrimethamin. Tyto tři jsou široce používány jako protinádorová a antimikrobiální činidla.[35] Jiné třídy sloučenin, které se obecně zaměřují na DHFR, a zejména bakteriální DHFR, patří do tříd, jako jsou diaminopteridiny, diaminotriaziny, diaminopyrrolochinazoliny, stilbeny, chalkony, deoxybenzoiny, abychom jmenovali jen několik.[36]
Trimethoprim prokázal aktivitu proti různým látkám Grampozitivní bakteriální patogeny.[37] Může však vzniknout rezistence na trimethoprim a další léky zaměřené na DHFR v důsledku různých mechanismů, které omezují úspěšnost jejich terapeutického použití.[38][39][40] Rezistence může vzniknout amplifikací genu DHFR, mutace v DHFR,[41][42] snížení absorpce drog, mimo jiné. Bez ohledu na to, trimethoprim a sulfamethoxazol v kombinaci se používá jako antibakteriální látka po celá desetiletí.[37]
Folát je nezbytný pro růst,[43] a cesta metabolismu folátu je cílem při vývoji léčby rakoviny. Jedním z takových cílů je DHFR. Režim fluorouracil, doxorubicin Bylo prokázáno, že methotrexát prodlužuje přežití u pacientů s pokročilým karcinomem žaludku.[44] Další studie týkající se inhibitorů DHFR mohou vést k dalším způsobům léčby rakoviny.
Bakterie také potřebují k růstu a množení DHFR, a proto našli inhibitory selektivní pro bakteriální DHFR uplatnění jako antibakteriální látky.[37]
Třídy malých molekul používaných jako inhibitory dihydrofolátreduktázy zahrnují diaminochinazolin a diaminopyrrolochinazolin,[45] diaminopyrimidin, diaminopteridin a diaminotriaziny.[46]
Potenciální léčba antraxu

Dihydrofolát reduktáza z Bacillus anthracis (BaDHFR) validovaný lékový cíl v léčbě infekční choroby, antraxu. BaDHFR je méně citlivý na trimethoprim analogy než je dihydrofolátreduktáza z jiných druhů, jako je např Escherichia coli, Zlatý stafylokok, a Streptococcus pneumoniae. Strukturální srovnání dihydrofolátreduktázy ze všech čtyř druhů ukazuje, že kombinaci má pouze BaDHFR fenylalanin a tyrosin v pozicích 96, respektive 102.
Odolnost vůči BaDHFR trimethoprim analogy je způsobeno těmito dvěma zbytky (F96 a Y102), které také propůjčují zlepšenou kinetiku a katalytickou účinnost.[47] Současný výzkum využívá mutanty aktivního místa v BaDHFR k vedení optimalizace olova pro nové antifolátové inhibitory.[47]
Jako výzkumný nástroj
DHFR byl použit jako nástroj k detekci interakce protein-protein v test komplementace proteinových fragmentů (PCA).
CHO buňky
DHFR chybí CHO buňky jsou nejčastěji používány buněčná linie pro produkci rekombinantních proteinů. Tyto buňky jsou transfektovaný s plazmid nesoucí dhfr gen a gen pro rekombinantní protein v jednom expresní systém, a poté podroben selektivní podmínky při nedostatku thymidinu střední. Přežívají pouze buňky s exogenním genem DHFR spolu s požadovaným genem.
Interakce
Bylo prokázáno, že dihydrofolátreduktáza interaguje s GroEL[48] a Mdm2.[49]
Interaktivní mapa cest
Kliknutím na geny, bílkoviny a metabolity níže zobrazíte odkazy na příslušné články.[§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „FluoropyrimidinActivity_WP1601“.
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000228716 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000021707 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Chen MJ, Shimada T, Moulton AD, Harrison M, Nienhuis AW (prosinec 1982). „Lidské geny dihydrofolátreduktázy bez intronu jsou odvozeny ze zpracovaných molekul RNA. Sborník Národní akademie věd Spojených států amerických. 79 (23): 7435–9. Bibcode:1982PNAS ... 79.7435C. doi:10.1073 / pnas.79.23.7435. PMC 347354. PMID 6961421.
- ^ Chen MJ, Shimada T, Moulton AD, Cline A, Humphries RK, Maizel J, Nienhuis AW (březen 1984). „Funkční gen lidské dihydrofolátreduktázy“. The Journal of Biological Chemistry. 259 (6): 3933–43. PMID 6323448.
- ^ Funanage VL, Myoda TT, Moses PA, Cowell HR (říjen 1984). „Přiřazení genu lidské dihydrofolátreduktázy do oblasti q11 ---- q22 chromozomu 5“. Molekulární a buněčná biologie. 4 (10): 2010–6. doi:10.1128 / mcb.4.10.2010. PMC 369017. PMID 6504041.
- ^ Smith SL, Patrick P, Stone D, Phillips AW, Burchall JJ (listopad 1979). "Dihydrofolátreduktáza z prasečích jater. Čištění, vlastnosti a sekvence aminokyselin". The Journal of Biological Chemistry. 254 (22): 11475–84. PMID 500653.
- ^ Matthews DA, Alden RA, Bolin JT, Freer ST, Hamlin R, Xuong N, Kraut J, Poe M, Williams M, Hoogsteen K (červenec 1977). „Dihydrofolátreduktáza: rentgenová struktura binárního komplexu s methotrexátem“. Věda. 197 (4302): 452–5. Bibcode:1977Sci ... 197..452M. doi:10.1126 / science.17920. PMID 17920.
- ^ Filman DJ, Bolin JT, Matthews DA, Kraut J (listopad 1982). "Krystalové struktury Escherichia coli a Lactobacillus casei dihydrofolátreduktáza rafinovaná při rozlišení 1,7 Á. II. Prostředí vázaného NADPH a důsledky pro katalýzu “. The Journal of Biological Chemistry. 257 (22): 13663–72. PMID 6815179.
- ^ A b Osborne MJ, Schnell J, Benkovic SJ, Dyson HJ, Wright PE (srpen 2001). „Dynamika páteře v komplexech dihydrofolátreduktázy: role pružnosti smyčky v katalytickém mechanismu“. Biochemie. 40 (33): 9846–59. doi:10.1021 / bi010621k. PMID 11502178.
- ^ Bolin JT, Filman DJ, Matthews DA, Hamlin RC, Kraut J (listopad 1982). "Krystalové struktury Escherichia coli a Lactobacillus casei dihydrofolátreduktáza rafinovaná při rozlišení 1,7 Á. I. Obecné vlastnosti a vazba methotrexátu ". The Journal of Biological Chemistry. 257 (22): 13650–62. PMID 6815178.
- ^ A b „Entrez Gene: DHFR dihydrofolate reductase“.
- ^ A b Schnell JR, Dyson HJ, Wright PE (2004). "Struktura, dynamika a katalytická funkce dihydrofolátreduktázy". Roční přehled biofyziky a biomolekulární struktury. 33 (1): 119–40. doi:10.1146 / annurev.biophys.33.110502.133613. PMID 15139807. S2CID 28611812.
- ^ Urlaub G, Chasin LA (červenec 1980). „Izolace mutantů buněk křečka čínského s deficitem aktivity dihydrofolátreduktázy“. Sborník Národní akademie věd Spojených států amerických. 77 (7): 4216–20. Bibcode:1980PNAS ... 77.4216U. doi:10.1073 / pnas.77.7.4216. PMC 349802. PMID 6933469.
- ^ Crabtree MJ, Tatham AL, Hale AB, Alp NJ, Channon KM (říjen 2009). „Kritická role recyklace tetrahydrobiopterinu dihydrofolátreduktázou při regulaci vazby endoteliální syntázy oxidu dusnatého: relativní význam syntézy biopterinů de novo versus záchranné cesty“. The Journal of Biological Chemistry. 284 (41): 28128–36. doi:10.1074 / jbc.M109.041483. PMC 2788863. PMID 19666465.
- ^ A b C d Rod TH, Brooks CL (červenec 2003). "Jak dihydrofolátreduktáza usnadňuje protonaci dihydrofolátu". Journal of the American Chemical Society. 125 (29): 8718–9. doi:10.1021 / ja035272r. PMID 12862454.
- ^ A b Wan Q, Bennett BC, Wilson MA, Kovalevsky A, Langan P, Howell EE, Dealwis C (prosinec 2014). „Směrem k vyřešení katalytického mechanismu dihydrofolátreduktázy pomocí neutronové a rentgenové krystalografie s vysokým rozlišením“. Sborník Národní akademie věd Spojených států amerických. 111 (51): 18225–30. Bibcode:2014PNAS..11118225W. doi:10.1073 / pnas.1415856111. PMC 4280638. PMID 25453083.
- ^ A b Liu CT, Francis K, Layfield JP, Huang X, Hammes-Schiffer S, Kohen A, Benkovic SJ (prosinec 2014). "Escherichia coli dihydrofolátreduktáza katalyzovaná přenosy protonů a hydridů: časový řád a role Asp27 a Tyr100 ". Sborník Národní akademie věd Spojených států amerických. 111 (51): 18231–6. Bibcode:2014PNAS..11118231L. doi:10.1073 / pnas.1415940111. PMC 4280594. PMID 25453098.
- ^ A b Czekster CM, Vandemeulebroucke A, Blanchard JS (leden 2011). "Kinetický a chemický mechanismus dihydrofolátreduktázy z Mycobacterium tuberculosis". Biochemie. 50 (3): 367–75. doi:10.1021 / bi1016843. PMC 3074011. PMID 21138249.
- ^ A b C Fierke CA, Johnson KA, Benkovic SJ (červen 1987). "Konstrukce a hodnocení kinetického schématu spojeného s dihydrofolátreduktázou z Escherichia coli". Biochemie. 26 (13): 4085–92. doi:10.1021 / bi00387a052. PMID 3307916.
- ^ Reyes VM, Sawaya MR, Brown KA, Kraut J (únor 1995). "Izomorfní krystalové struktury Escherichia coli dihydrofolátreduktáza v komplexu s folátem, 5-deazafolátem a 5,10-dideazatetrahydrofolátem: mechanické důsledky ". Biochemie. 34 (8): 2710–23. doi:10.1021 / bi00008a039. PMID 7873554.
- ^ A b C Sawaya MR, Kraut J (leden 1997). "Pohyb smyčky a subdomény v mechanismu Escherichia coli dihydrofolátreduktáza: krystalografické důkazy ". Biochemie. 36 (3): 586–603. doi:10.1021 / bi962337c. PMID 9012674.
- ^ Chen YQ, Kraut J, Blakley RL, Callender R (červen 1994). „Stanovení Ramanovou spektroskopií pKa N5 dihydrofolátu vázaného na dihydrofolátreduktázu: mechanické důsledky“. Biochemie. 33 (23): 7021–6. doi:10.1021 / bi00189a001. PMID 8003467.
- ^ Shrimpton P, Allemann RK (červen 2002). „Role vody v katalytickém cyklu dihydrofolátreduktázy E. coli“. Věda o bílkovinách. 11 (6): 1442–51. doi:10.1110 / ps.5060102. PMC 2373639. PMID 12021443.
- ^ Antikainen NM, Smiley RD, Benkovic SJ, Hammes GG (prosinec 2005). „Konformační vázaná enzymová katalýza: jednokomolekulární a přechodné kinetické zkoumání dihydrofolátreduktázy“. Biochemie. 44 (51): 16835–43. doi:10.1021 / bi051378i. PMID 16363797.
- ^ Narayana N, Matthews DA, Howell EE, Nguyen-huu X (listopad 1995). „Dihydrofolátreduktáza kódovaná plazmidem z bakterií rezistentních na trimetoprim má nové D2-symetrické aktivní místo“. Přírodní strukturní biologie. 2 (11): 1018–25. doi:10.1038 / nsb1195-1018. PMID 7583655. S2CID 11914241.
- ^ Bradrick TD, Beechem JM, Howell EE (září 1996). „Neobvyklé vazebné stechiometrie a kooperativita jsou pozorovány během tvorby binárních a ternárních komplexů v jediném aktivním póru dihydrofolátreduktázy R67, symetrického proteinu D2.“ Biochemie. 35 (35): 11414–24. doi:10.1021 / bi960205d. PMID 8784197.
- ^ Park H, Zhuang P, Nichols R, Howell EE (leden 1997). "Mechanické studie dihydrofolátreduktázy R67. Účinky pH a mutace H62C". The Journal of Biological Chemistry. 272 (4): 2252–8. doi:10.1074 / jbc.272.4.2252. PMID 8999931.
- ^ Kamath G, Howell EE, Agarwal PK (říjen 2010). "Ocas vrtí psem: pohledy na katalýzu v R67 dihydrofolátreduktáze". Biochemie. 49 (42): 9078–88. doi:10.1021 / bi1007222. PMID 20795731.
- ^ Cowman AF, Lew AM (listopad 1989). "Výběr antifolátových léků vede k duplikaci a přeskupení chromozomu 7 u Plasmodium chabaudi". Molekulární a buněčná biologie. 9 (11): 5182–8. doi:10,1128 / mcb. 9.11.5182. PMC 363670. PMID 2601715.
- ^ Banka S, Blom HJ, Walter J, Aziz M, Urquhart J, Clouthier CM a kol. (Únor 2011). „Identifikace a charakterizace vrozené poruchy metabolismu způsobené nedostatkem dihydrofolátreduktázy“. American Journal of Human Genetics. 88 (2): 216–25. doi:10.1016 / j.ajhg.2011.01.004. PMC 3035707. PMID 21310276.
- ^ Nyhan WL, Hoffmann GF, Barshop BA (30. prosince 2011). Atlas zděděných metabolických nemocí 3E. CRC Press. str. 141–. ISBN 978-1-4441-4948-7.
- ^ Li R, Sirawaraporn R, Chitnumsub P, Sirawaraporn W, Wooden J, Athappilly F, Turley S, Hol WG (leden 2000). „Trojrozměrná struktura M. tuberculosis dihydrofolátreduktáza odhaluje příležitosti pro vývoj nových léků na tuberkulózu “. Journal of Molecular Biology. 295 (2): 307–23. doi:10.1006 / jmbi.1999.3328. PMID 10623528. S2CID 24527344.
- ^ Benkovic SJ, Fierke CA, Naylor AM (březen 1988). "Pohledy na funkci enzymu ze studií na mutantech dihydrofolátreduktázy". Věda. 239 (4844): 1105–10. Bibcode:1988Sci ... 239.1105B. doi:10.1126 / science.3125607. PMID 3125607.
- ^ Srinivasan B, Tonddast-Navaei S, Roy A, Zhou H, Skolnick J (září 2018). "Chemický prostor Escherichia coli inhibitory dihydrofolát reduktázy: Nové přístupy k objevování nových léků pro staré brouky ". Recenze lékařského výzkumu. 39 (2): 684–705. doi:10,1002 / med.21538. PMC 6370515. PMID 30192413.
- ^ A b C Hawser S, Lociuro S, Islam K (březen 2006). "Inhibitory dihydrofolátreduktázy jako antibakteriální látky". Biochemická farmakologie. 71 (7): 941–8. doi:10.1016 / j.bcp.2005.10.052. PMID 16359642.
- ^ Narayana N, Matthews DA, Howell EE, Nguyen-huu X (listopad 1995). „Dihydrofolátreduktáza kódovaná plazmidem z bakterií rezistentních na trimetoprim má nové D2-symetrické aktivní místo“. Přírodní strukturní biologie. 2 (11): 1018–25. doi:10.1038 / nsb1195-1018. PMID 7583655. S2CID 11914241.
- ^ Huennekens FM (červen 1996). „Hledání dihydrofolátreduktázy“. Věda o bílkovinách. 5 (6): 1201–8. doi:10.1002 / pro.5560050626. PMC 2143423. PMID 8762155.
- ^ Banerjee D, Mayer-Kuckuk P, Capiaux G, Budak-Alpdogan T, Gorlick R, Bertino JR (červenec 2002). "Nové aspekty rezistence na léky zaměřené na dihydrofolát reduktázu a thymidylát syntázu". Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1587 (2–3): 164–73. doi:10.1016 / S0925-4439 (02) 00079-0. PMID 12084458.
- ^ Toprak E, Veres A, Michel JB, Chait R, Hartl DL, Kishony R (prosinec 2011). „Evoluční cesty k rezistenci na antibiotika při dynamicky udržovaném výběru léků“. Genetika přírody. 44 (1): 101–5. doi:10.1038 / ng.1034. PMC 3534735. PMID 22179135.
- ^ Rodrigues JV, Bershtein S, Li A, Lozovsky ER, Hartl DL, Shakhnovich EI (březen 2016). „Biofyzikální principy předpovídají fitness prostředí drogové rezistence“. Sborník Národní akademie věd Spojených států amerických. 113 (11): E1470-8. Bibcode:2016PNAS..113E1470R. doi:10.1073 / pnas.1601441113. PMC 4801265. PMID 26929328.
- ^ Bailey SW, Ayling JE (září 2009). „Extrémně pomalá a proměnlivá aktivita dihydrofolátreduktázy v lidských játrech a její důsledky pro vysoký příjem kyseliny listové“. Sborník Národní akademie věd Spojených států amerických. 106 (36): 15424–9. doi:10.1073 / pnas.0902072106. PMC 2730961. PMID 19706381.
- ^ Murad AM, Santiago FF, Petroianu A, Rocha PR, Rodrigues MA, Rausch M (červenec 1993). „Upravená léčba 5-fluorouracilem, doxorubicinem a methotrexátem u pokročilého karcinomu žaludku“. Rakovina. 72 (1): 37–41. doi:10.1002 / 1097-0142 (19930701) 72: 1 <37 :: AID-CNCR2820720109> 3.0.CO; 2-P. PMID 8508427.
- ^ Srinivasan B, Skolnick J (květen 2015). „Pohledy na pomalou inhibici těsného vázání Escherichia coli dihydrofolát reduktáza: podrobná mechanická charakterizace pyrrolo [3,2-f] chinazolin-1,3-diaminu a jeho derivátů jako nových inhibitorů těsné vazby ". Časopis FEBS. 282 (10): 1922–38. doi:10.1111 / febs.13244. PMC 4445455. PMID 25703118.
- ^ Srinivasan B, Tonddast-Navaei S, Skolnick J (říjen 2015). „Ligandové vazebné studie, předběžný vztah mezi strukturou a aktivitou a podrobná mechanická charakterizace derivátů 1-fenyl-6,6-dimethyl-1,3,5-triazin-2,4-diaminu jako inhibitorů Escherichia coli dihydrofolátreduktáza ". European Journal of Medicinal Chemistry. 103: 600–14. doi:10.1016 / j.ejmech.2015.08.021. PMC 4610388. PMID 26414808.
- ^ A b Beierlein JM, Karri NG, Anderson AC (říjen 2010). "Cílené mutace Bacillus anthracis dihydrofolátreduktázy kondenzují složité vztahy mezi strukturou a aktivitou". Journal of Medicinal Chemistry. 53 (20): 7327–36. doi:10.1021 / jm100727t. PMC 3618964. PMID 20882962.
- ^ Mayhew M, da Silva AC, Martin J, Erdjument-Bromage H, Tempst P, Hartl FU (únor 1996). „Protein skládání ve střední dutině chaperoninového komplexu GroEL-GroES“. Příroda. 379 (6564): 420–6. Bibcode:1996 Natur.379..420M. doi:10.1038 / 379420a0. PMID 8559246. S2CID 4310511.
- ^ Maguire M, Nield PC, Devling T, Jenkins RE, Park BK, Polański R, Vlatković N, Boyd MT (květen 2008). „MDM2 reguluje aktivitu dihydrofolátreduktázy prostřednictvím monoubikvitinace“. Výzkum rakoviny. 68 (9): 3232–42. doi:10.1158 / 0008-5472.CAN-07-5271. PMC 3536468. PMID 18451149.
Další čtení
- Joska TM, Anderson AC (říjen 2006). „Vztahy mezi strukturou a aktivitou Bacillus cereus a Bacillus anthracis dihydrofolát reduktázy: směrem k identifikaci nových silných potenciálních drog“. Antimikrobiální látky a chemoterapie. 50 (10): 3435–43. doi:10.1128 / AAC.00386-06. PMC 1610094. PMID 17005826.
- Chan DC, Fu H, Forsch RA, Queener SF, Rosowsky A (červen 2005). "Design, syntéza a antifolátová aktivita nových analogů piritreximu a dalších inhibitorů diaminopyrimidindihydrofolátreduktázy s substitucí omega-karboxyalkoxy nebo omega-karboxy-1-alkynyl v postranním řetězci". Journal of Medicinal Chemistry. 48 (13): 4420–31. doi:10.1021 / jm0581718. PMID 15974594.
- Banerjee D, Mayer-Kuckuk P, Capiaux G, Budak-Alpdogan T, Gorlick R, Bertino JR (červenec 2002). "Nové aspekty rezistence na léky zaměřené na dihydrofolát reduktázu a thymidylát syntázu". Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1587 (2–3): 164–73. doi:10.1016 / S0925-4439 (02) 00079-0. PMID 12084458.
- Stockman BJ, Nirmala NR, Wagner G, Delcamp TJ, DeYarman MT, Freisheim JH (leden 1992). "Sekvenčně specifické přiřazení rezonance 1H a 15N pro lidskou dihydrofolátreduktázu v roztoku". Biochemie. 31 (1): 218–29. doi:10.1021 / bi00116a031. PMID 1731871.
- Beltzer JP, Spiess M (prosinec 1991). „In vitro vazba asialoglykoproteinového receptoru na beta adapin vezikul potažených plazmatickou membránou“. Časopis EMBO. 10 (12): 3735–42. doi:10.1002 / j.1460-2075.1991.tb04942.x. PMC 453108. PMID 1935897.
- Davies JF, Delcamp TJ, Prendergast NJ, Ashford VA, Freisheim JH, Kraut J (říjen 1990). "Krystalové struktury rekombinantní lidské dihydrofolátreduktázy v komplexu s folátem a 5-deazafolátem". Biochemie. 29 (40): 9467–79. doi:10.1021 / bi00492a021. PMID 2248959.
- Will CL, Dolnick BJ (prosinec 1989). „5-Fluorouracil inhibuje zpracování mRNA prekurzoru dihydrofolát reduktázy a / nebo stabilitu jaderné mRNA v buňkách KB rezistentních na methotrexát“. The Journal of Biological Chemistry. 264 (35): 21413–21. PMID 2592384.
- Masters JN, Attardi G (březen 1985). „Diskrétní transkripty genů lidské dihydrofolát reduktázy přítomné v polysomální RNA mapě s jejich 5 'konci několik stovek nukleotidů před hlavním startovacím místem mRNA“. Molekulární a buněčná biologie. 5 (3): 493–500. doi:10,1 128 / mcb. 5. 3. 493. PMC 366741. PMID 2859520.
- Miszta H, Dabrowski Z, Lanotte M (listopad 1988). „In vitro vzorce exprese enzymatické tetrahydrofolát dehydrogenázy (EC 1.5.1.3) ve stromálních buňkách kostní dřeně“. Leukémie. 2 (11): 754–9. PMID 3185016.
- Oefner C, D'Arcy A, Winkler FK (červen 1988). "Krystalová struktura lidské dihydrofolátreduktázy v komplexu s folátem". European Journal of Biochemistry / FEBS. 174 (2): 377–85. doi:10.1111 / j.1432-1033.1988.tb14108.x. PMID 3383852.
- Yang JK, Masters JN, Attardi G (červen 1984). "Organizace genu pro lidskou dihydrofolátreduktázu. Rozsáhlá ochrana 5 'nekódující sekvence bohaté na G + C a silná odchylka velikosti intronů od homologních savčích genů". Journal of Molecular Biology. 176 (2): 169–87. doi:10.1016/0022-2836(84)90419-4. PMID 6235374.
- Masters JN, Yang JK, Cellini A, Attardi G (červen 1983). "Lidský dihydrofolát reduktázový pseudogen a jeho vztah k mnoha formám specifické messengerové RNA". Journal of Molecular Biology. 167 (1): 23–36. doi:10.1016 / S0022-2836 (83) 80032-1. PMID 6306253.
- Chen MJ, Shimada T, Moulton AD, Cline A, Humphries RK, Maizel J, Nienhuis AW (březen 1984). "Funkční gen lidské dihydrofolátreduktázy". The Journal of Biological Chemistry. 259 (6): 3933–43. PMID 6323448.
- Funanage VL, Myoda TT, Moses PA, Cowell HR (říjen 1984). „Přiřazení genu lidské dihydrofolátreduktázy do oblasti q11 ---- q22 chromozomu 5“. Molekulární a buněčná biologie. 4 (10): 2010–6. doi:10.1128 / mcb.4.10.2010. PMC 369017. PMID 6504041.
- Masters JN, Attardi G (1983). „Nukleotidová sekvence cDNA kódující reduktázu lidské dihydrofolické kyseliny“. Gen. 21 (1–2): 59–63. doi:10.1016/0378-1119(83)90147-6. PMID 6687716.
- Morandi C, Masters JN, Mottes M, Attardi G (duben 1982). „Mnohočetné formy lidské messenger RNA dihydrofolát reduktázy. Klonování a exprese v Escherichia coli jejich sekvence kódující DNA ". Journal of Molecular Biology. 156 (3): 583–607. doi:10.1016/0022-2836(82)90268-6. PMID 6750132.
- Bonifaci N, Sitia R, Rubartelli A (září 1995). „Jaderná translokace exogenního fúzního proteinu obsahujícího HIV Tat vyžaduje rozvinutí“. AIDS. 9 (9): 995–1000. doi:10.1097/00002030-199509000-00003. PMID 8527095. S2CID 8417864.
- Mayhew M, da Silva AC, Martin J, Erdjument-Bromage H, Tempst P, Hartl FU (únor 1996). „Protein skládání ve střední dutině chaperoninového komplexu GroEL-GroES“. Příroda. 379 (6564): 420–6. Bibcode:1996 Natur.379..420M. doi:10.1038 / 379420a0. PMID 8559246. S2CID 4310511.
- Gross M, Robinson CV, Mayhew M, Hartl FU, Radford SE (prosinec 1996). "Významná ochrana proti výměně vodíku v DHFR vázaném na GroEL je udržována během iteračních kol cyklování substrátu". Věda o bílkovinách. 5 (12): 2506–13. doi:10.1002 / pro.5560051213. PMC 2143321. PMID 8976559.
- Schleiff E, Shore GC, Goping IS (březen 1997). "Lidský mitochondriální importní receptor, Tom20p. Použití glutathionu k odhalení specifických interakcí mezi Tom20-glutathion S-transferázou a mitochondriálními prekurzorovými proteiny". FEBS Dopisy. 404 (2–3): 314–8. doi:10.1016 / S0014-5793 (97) 00145-2. PMID 9119086. S2CID 29177508.
- Cody V, Galitsky N, Luft JR, Pangborn W, Rosowsky A, Blakley RL (listopad 1997). „Srovnání dvou nezávislých krystalových struktur ternárních komplexů lidské dihydrofolátreduktázy redukovaných nikotinamidadeninindinukleotidfosfátem a velmi pevně vázajícím inhibitorem PT523“. Biochemie. 36 (45): 13897–903. doi:10.1021 / bi971711l. PMID 9374868.
- Vanguri VK, Wang S, Godyna S, Ranganathan S, Liau G (duben 2000). „Trombospondin-1 se váže na polyhistidin s vysokou afinitou a specificitou“. The Biochemical Journal. 347 (Pt 2): 469–73. doi:10.1042/0264-6021:3470469. PMC 1220979. PMID 10749676.
externí odkazy
- 1988 Nobelova přednáška v medicíně
- Proteopedia: Dihydrofolátreduktáza
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P00374 (Dihydrofolát reduktáza) na PDBe-KB.