Rakovina močového měchýře - Bladder cancer
| Rakovina močového měchýře | |
|---|---|
 | |
| Přechodný buněčný karcinom močového měchýře. Bílá v močovém měchýři je kontrastní. | |
| Specialita | Onkologie, urologie |
| Příznaky | Krev v moči, bolest s močením[1] |
| Obvyklý nástup | 65 až 84 let[2] |
| Typy | Karcinom přechodných buněk, spinocelulární karcinom, adenokarcinom[1] |
| Rizikové faktory | Kouření, rodinná anamnéza, předchozí radiační terapie, časté infekce močového měchýře, určité chemikálie[1] |
| Diagnostická metoda | Cystoskopie s tkáňové biopsie[1] |
| Léčba | Chirurgie, radiační terapie, chemoterapie, imunoterapie[1] |
| Prognóza | Míra pětiletého přežití ~ 77% (USA)[2] |
| Frekvence | 549 000 nových případů (2018)[3] |
| Úmrtí | 200,000 (2018)[3] |
Rakovina močového měchýře je některý z několika typů rakovina vyplývající z papírové kapesníky z močový měchýř.[1] Mezi příznaky patří krev v moči, bolest s močením a bolesti dolní části zad.[1]
Mezi rizikové faktory pro rakovinu močového měchýře patří kouření, rodinná anamnéza, předchozí radiační terapie, časté infekce močového měchýře a vystavení určitým chemikáliím.[1] Nejběžnějším typem je karcinom přechodných buněk.[1] Mezi další typy patří spinocelulární karcinom a adenokarcinom.[1] Diagnóza je obvykle cystoskopie s tkáňové biopsie.[4] Stupeň rakoviny je určen transuretrální resekce a lékařské zobrazování.[1][5][6]
Léčba závisí na stádium rakoviny.[1] Může zahrnovat nějakou kombinaci chirurgie, radiační terapie, chemoterapie nebo imunoterapie.[1] Chirurgické možnosti mohou zahrnovat transuretrální resekci, částečné nebo úplné odstranění močového měchýře nebo odklon moči.[1] Typický pětiletá míra přežití ve Spojených státech je to 77%, Kanada je 75% a Evropa je 68%.[2][7][8]
Rakovina močového měchýře od roku 2018 ovlivnila přibližně 1,6 milionu lidí na celém světě s 549 000 novými případy a 200 000 úmrtí.[3] Věk nástupu je nejčastěji mezi 65 a 84 lety.[2] Muži jsou častěji postiženi než ženy.[2] V roce 2018 se nejvyšší míra rakoviny močového měchýře vyskytla v jižní a západní Evropě a poté v Severní Americe s mírou 15, 13 a 12 případů na 100 000 lidí.[3] Nejvyšší míry úmrtí na rakovinu močového měchýře byly zaznamenány v severní Africe a západní Asii, následované jižní Evropou.[3]
Příznaky a symptomy
Rakovina močového měchýře je příčinou krev v moči, které mohou být viditelné nebo zjistitelné pouze mikroskopem. Krev v moči je nejčastějším příznakem rakoviny močového měchýře a je bezbolestná. Viditelná krev v moči může trvat jen krátce a může být vyžadován test moči k potvrzení neviditelné krve. Mezi 80 a 90% lidí s rakovinou močového měchýře se původně objevila viditelná krev.[9] Krev v moči může být také způsobena jinými stavy, jako jsou močový měchýř nebo močové kameny, infekce, onemocnění ledvin, rakovina ledvin nebo vaskulární malformace, i když tyto stavy (s výjimkou rakoviny ledvin ) by obvykle bylo bolestivé.
Mezi další možné příznaky patří bolest během močení, časté močení nebo cítit potřebu močit, aniž by to bylo možné. Tyto příznaky a příznaky nejsou specifické pro rakovinu močového měchýře a mohou být také způsobeny nerakovinovými stavy, včetně prostata infekce, hyperaktivní močový měchýř nebo cystitida. Některé vzácné formy rakoviny močového měchýře urachální adenokarcinom vyrobit mucin, který se poté vylučuje močí a způsobuje jeho ztluštění.[10]
Lidé s pokročilým onemocněním mohou mít bolesti pánve nebo kostí, dolních končetin otok nebo bolest v boku.[11] Zřídka lze hmatatelnou hmotu detekovat při fyzikálním vyšetření.[12]
Příčiny
Tabák kouření je hlavním známým přispěvatelem k rakovině močového měchýře; ve většině populací je kouření spojeno s více než polovinou případů rakoviny močového měchýře u mužů a třetinou případů u žen,[13] tyto podíly se však v posledních letech snížily, protože v Evropě a Severní Americe je méně kuřáků.[14] Existuje téměř lineární vztah mezi délkou kouření (v letech), zabalit roky a riziko rakoviny močového měchýře. Lze pozorovat rizikovou náhorní plošinu při kouření asi 15 cigaret denně (to znamená, že ti, kteří kouří 15 cigaret denně, mají přibližně stejné riziko jako ti, kteří kouří 30 cigaret denně). Kouření (doutník, dýmka, egyptská vodní dýmka a bezdýmný tabák) v jakékoli formě zvyšuje riziko rakoviny močového měchýře.[15] Ukončení kouření snižuje riziko. Riziko rakoviny močového měchýře klesá o 30% během 1–4 let a nadále klesá o 60% po 25 letech po ukončení kouření.[16] Bývalí kuřáci však budou s největší pravděpodobností vždy mít vyšší riziko rakoviny močového měchýře ve srovnání s lidmi, kteří nikdy nekouřili.[14] Riziko se také jeví jako pasivní kouření.[17][18]
Opium spotřeba zvyšuje riziko rakoviny močového měchýře trojnásobně a současné užívání opia a kouření zvyšuje riziko rakoviny močového měchýře pětkrát ve srovnání s běžnou populací.[19]
Třicet procent nádorů močového měchýře pravděpodobně vyplývá z pracovní expozice karcinogenům na pracovišti. Pracovní nebo nepřímé vystavení následujícím látkám bylo implikováno jako příčina rakoviny močového měchýře; benzidin (výroba barviv), 4-aminobifenyl (gumárenský průmysl), 2-naftylamin (výroba azobarviv, slévárenské výpary, gumárenský průmysl, cigaretový kouř a výzkum rakoviny), fenacetin (analgetikum), arsen a chlorované alifatické uhlovodíky v pitné vodě, auramin (výroba barviv), purpurová (výroba barviv), orto-toluidin (výroba barviv), epoxid a polyuretan pryskyřičná tužidla (plastikářský průmysl), chlornafazin, černouhelný dehet.[20][21][22][23][24] Ohroženými povoláními jsou řidiči autobusů, gumáři, malíři, automechanici, pracovníci v kůži (včetně obuvi), kováři, stavitelé strojů a mechanici.[25][26] Kadeřníci jsou považováni za ohrožené také kvůli jejich častému vystavení trvalým barvám na vlasy.[27]
Infekce Schistosoma haematobium (bilharzia nebo schistosomiáza ) může způsobit rakovinu močového měchýře, zejména typu dlaždicových buněk.[28] Schistosoma vejce vyvolává a chronické zánětlivé stavu ve stěně močového měchýře vedoucí k fibróze tkáně.[29] Vyšší úrovně N-nitroso sloučeniny byly detekovány ve vzorcích moči lidí se schistosomiázou.[30] Sloučeniny N-Nitroso byly zahrnuty do patogeneze rakoviny močového měchýře související se schistosomiázou. Zvláště způsobují poškození alkylační DNA Guanine na Adenin přechodové mutace v HRAS a p53 gen potlačující nádor.[31] Mutace p53 jsou detekovány u 73% nádorů, BCL-2 mutace s podílem 32% a kombinace těchto dvou s podílem 13%.[32] Jiné příčiny spinocelulární karcinom močového měchýře zahrnují chronické katetrizace u lidí s a poranění míchy a historie léčby cyklofosfamidem.[33][34]
Požití kyselina aristolochová přítomný v mnoha čínštině bylinné léky bylo prokázáno, že způsobuje uroteliální karcinom a selhání ledvin.[35] Kyselina aristolochová se aktivuje peroxidáza v urotel a příčiny transverze mutace v TP53 supresor nádoru gen.
Lidé, kteří podstoupí radioterapie vnějším paprskem (EBRT) pro rakovinu prostaty mají vyšší riziko vzniku invazivního karcinomu močového měchýře.[36]
Kromě těchto hlavních rizikových faktorů existuje také řada dalších modifikovatelných faktorů, které jsou méně silné (tj. 10–20% zvýšení rizika) spojené s rakovinou močového měchýře, například obezita.[37] I když je lze považovat za menší účinky, snížení rizika v obecné populaci lze stále dosáhnout společným snížením prevalence řady menších rizikových faktorů.[38]
Genetika
Mutace v FGFR3, TP53, PIK3CA, KDM6A, ARID1A, KMT2D, HRAS, TERT, KRAS, CREBBP, RB1 a TSC1 geny mohou být spojeny s některými případy rakoviny močového měchýře.[39][40][41] Vymazání částí nebo celého chromozom 9 je běžné u rakoviny močového měchýře.[42] Je známo, že rakovina nízkého stupně obsahuje mutace Dráha RAS a gen receptoru 3 fibroblastového růstového faktoru (FGFR3), oba hrají roli v Cesta MAPK / ERK. p53 a RB genové mutace se podílejí na vysoce kvalitních svalových invazivních nádorech.[43] Osmdesát devět procent svalových invazivních rakovin má mutace remodelace chromatinu a geny modifikující histon.[44]Vymazání obou kopií GSTM1 Gen má mírné zvýšení rizika rakoviny močového měchýře. GSTM1 genový produkt glutathion S-transferáza M1 (GSTM1) se účastní procesu detoxikace karcinogenů, jako jsou polycyklické aromatické uhlovodíky nalezený v cigaretovém kouři.[45] Podobně mutace v NAT2 (N-acetyltransferáza ) je spojena se zvýšeným rizikem rakoviny močového měchýře. N-acetyltransferáza pomáhá při detoxikaci karcinogeny jako aromatické aminy (přítomný také v cigaretovém kouři).[46] Různé jedno-nukleotidové polymorfismy v Gen PSCA přítomný dne chromozom 8 prokázaly, že zvyšují riziko rakoviny močového měchýře. Gen PSCA promotor region má androgen oblast odezvy. Ztráta reaktivity této oblasti na androgeny se předpokládá jako příčina většího počtu agresivních nádorů u žen (na rozdíl od mužů, kteří mají vyšší množství androgenu).[47]
Svalová invazivní rakovina močového měchýře má heterogenní povahu. Obecně je lze geneticky rozdělit na bazální a luminální podtypy. Bazální podtyp vykazuje změny týkající se RB a NFE2L2 a luminální typ vykazují změny v genech FGFR3 a KDM6A.[48] Bazální podtyp se dělí na bazální a claudin skupina nízkého typu a jsou agresivní a při prezentaci vykazují metastázy, reagují však na chemoterapii na bázi platiny. Luminální podtyp lze rozdělit na p53 a luminální. p53 podobné tumory luminálního podtypu, i když nejsou tak agresivní jako bazální typ, vykazují rezistenci chemoterapie[49]
Diagnóza
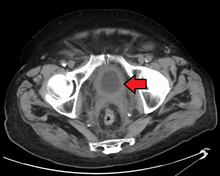
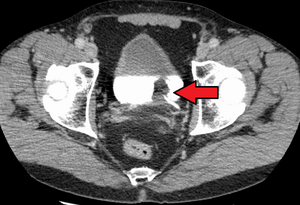
V současné době je nejlepší diagnóza stavu močového měchýře pomocí cystoskopie, což je postup, při kterém se používá flexibilní nebo tuhá trubice (nazývaná a cystoskop) nesoucí kameru a různé nástroje se zavádí do močového měchýře skrz močová trubice. Flexibilní postup umožňuje vizuální prohlídku močového měchýře, provedení drobných nápravných prací a odebrání vzorků podezřelých lézí biopsie. Tuhý cystoskop se používá v celkové anestezii na operačním sále a může podporovat sanační práce a biopsie i rozsáhlejší odstranění nádoru. Na rozdíl od papilární léze, která roste do dutiny močového měchýře a je snadno viditelná, karcinom in situ léze jsou ploché a nejasné. Detekce karcinomů in situ vyžaduje více biopsií z různých oblastí vnitřní stěny močového měchýře.[50] Fotodynamická detekce (cystoskopie modrého světla) může pomoci při detekci karcinomu in situ. Při fotodynamické detekci se do močového měchýře vpravuje barvivo pomocí katétru. Rakovinné buňky absorbují toto barvivo a jsou viditelné pod modrým světlem, což poskytuje vizuální stopy v oblastech k biopsii nebo resekci.[51]
Vizuální detekce v jakékoli formě uvedené výše však není dostatečná pro stanovení patologické klasifikace, buněčného typu nebo stadia současného nádoru. Takzvaný studený pohár biopsie během běžné cystoskopie (rigidní nebo flexibilní) nebude stačit ani pro patologické staging. Po vizuální detekci tedy musí následovat transuretrální chirurgie. Procedura se nazývá transuretrální resekce nádoru močového měchýře (TURBT). Dále by před a po TURBT mělo být provedeno rektální a vaginální bimanuální vyšetření, aby se posoudilo, zda existuje hmatatelná hmota nebo zda je nádor fixován („upoután“) na pánevní stěnu. Informace o patologické klasifikaci a stagingu získané postupem TURBT mají zásadní význam pro správnou volbu následné léčby a / nebo následných postupů.[52]
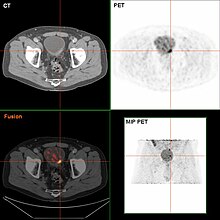
Pokud jsou invazivní nebo vysoce kvalitní (zahrnuje karcinom in situ ) rakovina je detekována na TURBT, an MRI a / nebo CT břicha a pánve nebo urogram a CT hrudník nebo rentgen hrudník by měl být proveden pro stanovení nemoci a pro zjištění šíření rakoviny (metastáza ). Navýšit v alkalická fosfatáza hladiny bez známek onemocnění jater by měly být hodnoceny kostní metastázy podle a kostní sken.[53] Ačkoli 18F-fluorodeoxyglukóza (FDG) - pozitronová emisní tomografie (PET) / CT byla prozkoumána jako životaschopná metoda stagingu, neexistuje shoda ohledně podpory její role v rutinních klinických hodnoceních.[51]
Cytologie moči lze získat v moči nebo v době cystoskopie („mytí močového měchýře“). Cytologie není příliš citlivá na nádory nízkého nebo prvního stupně (negativní výsledek nemůže spolehlivě vyloučit rakovinu močového měchýře), ale má vysokou specificitu (pozitivní výsledek spolehlivě detekuje rakovinu močového měchýře).[54] K dispozici jsou novější neinvazivní markery vázané na moč jako pomůcka při diagnostice rakoviny močového měchýře, včetně lidských faktor komplementu H související protein, vysokomolekulární karcinoembryonální antigen a protein nukleární matrice 22 (NMP22).[55] Ve Spojených státech FDA schválil testy NMP22, NMP22 BladderChek a UroVysion pro detekci a sledování rakoviny močového měchýře a testy ImmunoCyt, BTA-TRAK a BTA-STAT byly schváleny pouze pro sledování. BTA-STAT a BladderChek lze provádět na klinice a další se provádějí v laboratoři.[56][57] Mezi další neinvazivní testy založené na moči patří test CertNDx Bladder Cancer Assay, který detekuje FGFR3 mutace a test rakoviny močového měchýře (UBC), což je sendvič ELISA pro Cytokeratin 8 / 18 fragment. Podobně je NMP22 sendvič ELISA a NMP22 BladderChek je měrka imunotest, oba detekují protein jaderného mitotického aparátu (NuMA) nádorový marker (typ proteinu jaderné matrice).[58] UroVysion je fluorescence in situ hybridizace který detekuje aneuploidii v chromozomech 3, 7, 17 a ztrátu lokusu 9p21.[59][60] ImmunoCyt je Imunofluorescence test, který detekuje glykosylovaný CEA a MUCIN podobné antigeny (M344, LDQ10, 19A11).[58][59] BTA-STAT je měrka imunotest pro detekci člověka faktor komplementu H související protein. BTA-TRAK je sendvič ELISA který také detekuje protein související s lidským komplementovým faktorem H.[58] Citlivost mezi biomarkery se pohybovala od 0,57 do 0,82 a specifičnosti od 0,74 do 0,88. Biomarkery dopadly lépe, pokud byly použity v kombinaci s cytologií moči, než když byly použity samostatně. Přesnost detekce je však u rakovin nízkého stupně špatná a stále chybí 10% rakovin.[56] Současné pokyny nedoporučují používat močové biomarkery pro detekci a sledování.[61]
Klasifikace

| Typ | Relativní výskyt | Podtypy |
|---|---|---|
| Karcinom přechodných buněk | 95%[62][63] | Papilární (70%[62]) |
| Nepapilární (30%[62]) | ||
| Nepřechodný buněčný karcinom | 5% [62][63] | Spinocelulární karcinomy, adenokarcinomy, sarkomy, malobuněčné karcinomy a sekundární usazeniny způsobené rakovinou jinde v těle.[63] |
Nepapilární karcinom zahrnuje karcinom in situ (CIS), mikroinvazivní karcinom a upřímně řečeno invazivní karcinom.[64] Karcinom in situ (CIS) vždy sestává z cytologicky vysoce kvalitních nádorových buněk.[65]
Karcinom přechodných buněk může podstoupit diferenciaci (25%) na své varianty.[64][66][67] Při pohledu pod mikroskopem se papilární karcinom přechodných buněk může projevovat ve své typické formě nebo jako jedna z jeho variací (dlaždicová, žlázová diferenciace nebo mikropapilární varianta). Níže jsou uvedeny různé varianty nepapilárního karcinomu z přechodných buněk.
| Varianta | Histologie | Procento nepapilárních případů | Dopady[68] |
|---|---|---|---|
| Dlaždicová diferenciace | Přítomnost mezibuněčných můstků nebo keratinizace | 60% | Výsledky podobné konvenčnímu karcinomu z přechodných buněk |
| Glandulární diferenciace | Přítomnost skutečných žlázových prostorů | 10% | |
| Sarkomatoidní ložiska | Přítomnost epiteliální a mezenchymální diferenciace | 7% | Klinicky agresivní[69] |
| Mikropapilární varianta | Připomíná papilární serózní karcinom vaječníku nebo připomínající mikropapilární karcinom prsu nebo plic[70] | 3.7% | Klinicky agresivní, doporučuje se časná cystektomie |
| Uroteliální karcinom s malými tubuly a mikrocystickou formou | Přítomnost cyst s rozsahem velikostí mikroskopických až 1–2 mm | Vzácný | |
| Karcinom podobný lymfoepiteliomu | Připomíná lymfoepiteliom nosohltanu | ||
| Lymfomy podobné a plasmacytoidní varianty | Maligní buňky se podobají maligním buňkám lymfom nebo plasmacytom | ||
| Vnořená varianta | Histologicky vypadají podobně jako hnízda von Brunna | Může být chybně diagnostikováno jako benigní hnízda von Brunna nebo neinvazivní papilární uroteliální karcinom nízkého stupně | |
| Uroteliální karcinom s obrovskými buňkami | Přítomnost obrovských buněk epiteliálního nádoru a vypadá podobně jako obří buněčný karcinom plic | ||
| Trofoblastická diferenciace | Může se projevit přítomnost syncytiotrofoblastických obřích buněk nebo choriokarcinomatózní diferenciace HCG | ||
| Vymazat variantu buňky | Čistý buněčný vzor s cytoplazmou bohatou na glykogen | ||
| Plasmacytoid | Buňky s bohatým obsahem lipidů, napodobující adenokarcinom prstencových buněk prstence žaludku / lobulární rakovina prsu | Klinicky agresivní, sklon k peritoneálnímu šíření | |
| Neobvyklé stromální reakce | Přítomnost následujících; pseudosarkomatózní stroma, stromální kostní nebo chrupavčitá metaplazie, obří buňky typu osteoklastů, lymfoidní infiltrát |
Inscenace
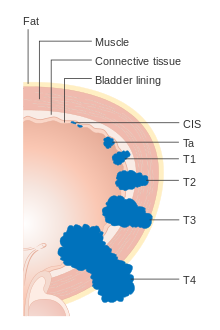


Rakovina močového měchýře je stanovena (klasifikována podle rozsahu šíření rakoviny) a odstupňována (jak abnormální a agresivní se buňky objevují pod mikroskopem), aby bylo možné určit léčbu a odhadnout výsledky. Staging obvykle následuje po první transuretrální resekci tumoru močového měchýře (TURBT). Papilární nádory omezené na sliznici nebo napadající lamina propria jsou klasifikovány jako Ta nebo T1. Plochá léze je klasifikována jako Tis. Oba jsou pro terapeutické účely seskupeny jako mimosvalové invazivní onemocnění.
V TNM pracovní systém (8. vydání, 2017) pro rakovinu močového měchýře:[71][72]
T (primární nádor)
- TX Primární nádor nelze posoudit
- T0 Žádný důkaz primárního nádoru
- Ta Neinvazivní papilární karcinom
- Tis Karcinom in situ („plochý nádor“)
- T1 Nádor napadá subepiteliální pojivovou tkáň
- T2a Nádor napadá povrchový sval (vnitřní polovina těla) sval detruzoru )[73]
- T2b Nádor napadá hluboké svaly (vnější polovina svalu detruzoru)[73]
- T3 Nádor napadá perivezikální tkáň:
- T3a Mikroskopicky
- T3b Makroskopicky (extravezikální hmota)
- T4a Nádor napadá prostata, děloha nebo pochva
- T4b Nádor napadá pánevní stěna nebo břišní stěna
N (lymfatické uzliny)
- NX Regionální lymfatické uzliny nelze posoudit
- N0 Žádné regionální metastázy v lymfatických uzlinách
- N1 Metastáza v jedné lymfatické uzlině v pravé pánvi (hypogastrická, obturátor, vnější iliak nebo presakrální uzliny)
- N2 Metastáza ve více lymfatických uzlinách v pravé pánvi (hypogastrická, obturátorová, vnější iliakální nebo presakrální uzliny)
- N3 Metastáza v běžné iliakální lymfatické uzliny
M (Vzdálená metastáza)
- MX Vzdálené metastázy nelze hodnotit
- M0 Žádné vzdálené metastázy
- M1 Vzdálené metastázy.
- M1a: Rakovina se rozšířila pouze do lymfatických uzlin mimo pánev.
- M1b: Rakovina rozšířila další části těla.
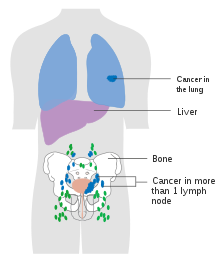
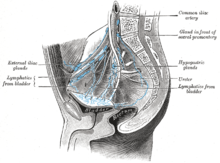
Nejběžnějšími místy pro metastázy rakoviny močového měchýře jsou lymfatické uzliny, kosti, plíce, játra a pobřišnice.[74] Nejčastější sentinelové lymfatické uzliny vypouštění rakoviny močového měchýře jsou obturator a vnitřní iliakální lymfatické uzliny. Umístění lymfatického šíření závisí na umístění nádorů. Nádory na superolaterální stěně močového měchýře se rozšířily do vnější iliakální lymfatické uzliny. Nádory na krku, přední stěně a fundusu se běžně šíří do vnitřních iliakálních lymfatických uzlin.[75] Z regionálních lymfatických uzlin (tj. Obturátoru, vnitřních a vnějších lymfatických uzlin) se rakovina šíří do vzdálených míst, jako je běžné iliakální lymfatické uzliny a paraaortální lymfatické uzliny.[76] Přeskočeno lymfatická uzlina léze nejsou vidět u rakoviny močového měchýře.[75]
Numerické
Výše uvedené fáze mohou být integrovány do číselné fáze (s římské číslice ) jak následuje:[77]
| Etapa | Nádor | Uzly | Metastáza | Pětileté přežití v USA[78] |
|---|---|---|---|---|
| Fáze 0a | Ta | N0 | M0 | 98% |
| Fáze 0 je | Tis | N0 | M0 | 95% |
| Fáze I | T1 | N0 | M0 | 63% |
| Fáze II | T2a | N0 | M0 | |
| T2b | ||||
| Fáze IIIA | T3a | N0 | M0 | 35% |
| T3b | ||||
| T4a | ||||
| T1-4a | N1 | |||
| Fáze IIIB | T1-4a | N2 | M0 | |
| N3 | ||||
| Fáze IVA | T4b | Jakékoli N | M0 | |
| Libovolný T | M1a | |||
| Fáze IVB | Libovolný T | ny N | M1b | 5% |
Hodnocení
Podle klasifikace WHO (1973) jsou rakoviny močového měchýře histologicky odstupňovány do:[79]
- G1 - dobře diferencované,
- G2 - Středně diferencované
- G3 - Špatně diferencované
Klasifikace WHO (2004/2016)[80][81]
- Papilární léze
- Uroteliální papilom
- Papilární uroteliální novotvar s nízkým maligním potenciálem (PUNLMP)
- Nízká známka
- Vysoký stupeň
- Ploché léze
- Proliferace urotelu nejistého maligního potenciálu
- Reaktivní atypie
- Atypie neznámého významu
- Uroteliální dysplázie
- Uroteliální CIS (vždy vysoce kvalitní)
- Hlavní
- Sekundární
- Souběžně
Stratifikace rizika
Lidé s mimosvalovým invazivním karcinomem močového měchýře (NMIBC) jsou rozvrstveni podle rizika na základě klinických a patologických faktorů, aby byli vhodně léčeni v závislosti na jejich pravděpodobnosti progrese a / nebo recidivy.[82] Lidé s mimosvalovými invazivními nádory jsou rozděleni do kategorií s nízkým rizikem, středním rizikem a vysokým rizikem nebo jim je poskytnuto numerické skóre rizika. Rámec stratifikace rizika poskytuje Americká urologická asociace / Společnost urologické onkologie (stratifikace AUA / SUO), pokyny Evropské urologické asociace (EAU), tabulky rizik Evropské organizace pro výzkum a léčbu rakoviny (EORTC) a Klub Urológico Español de Tratamiento Bodovací model onkologie (CUETO).[83][84][85]
| Nízké riziko | Střední riziko | Vysoké riziko |
|---|---|---|
| Osamělý nádor Ta nízkého stupně, menší než 3 cm | Opakování do 1 roku, nádor Ta nízkého stupně | Vysoce kvalitní T1 |
| Papilární uroteliální novotvar s nízkým maligním potenciálem | Osamělý nádor Ta nízkého stupně, větší než 3 cm | Jakýkoli recidivující nádor nebo jakýkoli vysoce kvalitní Ta |
| Nízký stupeň Ta, multifokální nádory | Vysoce kvalitní Ta, větší než 3 cm (nebo multifokální) | |
| Vysoce kvalitní Ta, menší než 3 cm | Jakýkoli karcinom in situ | |
| Nízký stupeň T1 | Jakékoli selhání BCG u vysoce kvalitních nádorů | |
| Libovolná varianta histologie | ||
| Jakákoli lymfovaskulární invaze | ||
| Jakékoli postižení prostatické uretry vysoké kvality |
Model EORTC a CUETO používá kumulativní skóre získané z jednotlivých prognostických faktorů, které jsou poté převedeny na riziko progrese a recidivy. Šest prognostických faktorů zahrnutých do modelu EORTC je počet nádorů, míra recidivy, T-fáze, přítomnost karcinomu in-situ a stupeň nádoru. Skóre pro opakování v modelu CUETO obsahuje 6 proměnných; věk, pohlaví, stupeň, stav nádoru, počet nádorů a přítomnost tis. Pro hodnocení postupu se používá předchozích 6 proměnných plus fáze T.[86][87]
| Modelka | Kumulativní skóre pro opakování | Opakování po 1 roce (%) | Opakování po 5 letech (%) |
|---|---|---|---|
| EORTC | 0 | 15 | 31 |
| 1-4 | 24 | 46 | |
| 5-9 | 38 | 62 | |
| 10-17 | 61 | 78 | |
| CUETO | 0-4 | 8.2 | 21 |
| 5-6 | 12 | 36 | |
| 7-9 | 25 | 48 | |
| 10-16 | 42 | 68 |
| Modelka | Kumulativní skóre pro postup | Progrese po 1 roce (%) | Pokrok po 5 letech (%) |
|---|---|---|---|
| EORTC | 0 | 0.2 | 0.8 |
| 2-6 | 1 | 6 | |
| 7-13 | 5 | 17 | |
| 12-23 | 17 | 45 | |
| CUETO | 0-4 | 1.2 | 3.7 |
| 5-6 | 3 | 12 | |
| 7-9 | 5.5 | 21 | |
| 10-16 | 14 | 34 |
Prevence
Od roku 2019 existují jen omezené důkazy na vysoké úrovni, které naznačují, že konzumace zeleniny a ovoce snižuje riziko rakoviny močového měchýře.[46] Studie z roku 2008 dospěla k závěru, že „konkrétní ovoce a zelenina může působit ke snížení rizika rakoviny močového měchýře. “[90] Ovoce a žlutooranžová zelenina, zejména mrkve a ty, které obsahují selen,[91] jsou pravděpodobně spojeny se středně sníženým rizikem rakoviny močového měchýře. Citrus ovoce a křupavá zelenina byly také identifikovány jako látky s možným ochranným účinkem. Analýza 47 909 mužů v následné studii zdravotnických odborníků však ukázala malý vztah mezi redukcí rakoviny a celkovou konzumací ovoce a zeleniny, konkrétně žluté nebo zelené listové zeleniny, ve srovnání se snížením pozorovaným u mužů, kteří konzumovali velké množství křupavá zelenina. Inverzní vztah mezi příjmy z flavonoly a lignany (difenolický sloučeniny nalezené v celá zrna, luštěniny, ovoce a zelenina) a byla také popsána agresivní rakovina močového měchýře.[92]
I když se navrhuje, aby polyfenolové sloučeniny v čaj může mít inhibiční účinek na tvorbu a růst nádoru močového měchýře, existují jen omezené důkazy o tom, že pití čaje snižuje riziko rakoviny močového měchýře.[46]
V desetileté studii zahrnující téměř 49 000 mužů vědci zjistili, že muži, kteří vypili alespoň 1,44 l vody (přibližně 6 šálků) denně, měli ve srovnání s muži, kteří pili méně, snížené riziko rakoviny močového měchýře. Bylo také zjištěno, že: „riziko rakoviny močového měchýře pokleslo o 7% na každých 240 ml přidané tekutiny“.[93] Autoři navrhli, že rakovina močového měchýře může být částečně způsobena přímým kontaktem močového měchýře karcinogeny které se vylučují močí, i když to dosud nebylo potvrzeno v jiných studiích.[90]
Promítání
Od roku 2019 neexistují dostatečné důkazy k určení, zda promítání pro rakovinu močového měchýře u lidí bez příznaků je účinná nebo ne.[94]
Léčba
Léčba rakoviny močového měchýře závisí na tom, jak hluboko nádor napadne do stěny močového měchýře.
Strategie léčby rakoviny močového měchýře zahrnují:[95][96]
- Nesvalová invaze: transuretrální resekce nádoru močového měchýře (TURBT) s nebo bez intavezikální chemoterapie nebo imunoterapie
- Svaly invazivní
- Fáze II / Fáze IIIA: radikální cystektomie Plus neoadjuvantní chemoterapie (preferována multimodální terapie) nebo transuretrální resekce chemoradiací (trimodální terapie, vysoce vybraní lidé) nebo částečná cystektomie Plus neoadjuvantní chemoterapie (u vysoce vybraných lidí)
- Fáze IIIB / IVA: chemoterapie založená na cisplatině následovaná radikální cystektomie nebo chemoradiace nebo pozorování v závislosti na reakci léčby
- Stupeň IVB (lokálně pokročilý; neresekovatelné nádory): paliativní radioterapie
- Metastatické onemocnění: cisplatina - chemoterapie
- Metastatické onemocnění, ale nevhodné pro chemoterapii založenou na cisplatině: karboplatina - chemoterapie
- Metastatické onemocnění s kontraindikací pro chemoterapii: inhibitory kontrolního bodu, pokud programovaný ligand smrti 1 (PD L1 ) pozitivní
- Spinocelulární karcinom nebo adenokarcinom močového měchýře: radikální cystektomie
Nesvalová invaze
Transuretrální resekce
Nesvalovou invazivní rakovinu močového měchýře (ty, které nevstupují do svalové vrstvy močového měchýře) lze „oholit“ pomocí elektrokauterizace zařízení připojené k a cystoskop, kterému se v tomto případě říká resektoskop. Procedura se nazývá transuretrální resekce tumoru močového měchýře (TURBT) a slouží především k patologickému stagingu. V případě nesvalového invazivního karcinomu močového měchýře je léčba sama o sobě TURBT, ale v případě invazivního karcinomu močového měchýře je postup pro finální léčbu nedostatečný.[52] Navíc modré světlo cystoskopie s optickým zobrazovacím činidlem Hexaminolevulinát (HAL) se doporučuje při počátečním TURBT ke zvýšení detekce lézí (zejména karcinomu in situ) a zlepšení kvality resekce, čímž se sníží recidiva.[97][98] Je důležité posoudit kvalitu resekce, pokud existují důkazy o neúplné resekci nebo pokud ve vzorku není žádný sval (bez kterého nelze určit invazivitu svalu), důrazně se doporučuje druhý TURBT. Navíc téměř polovina lidí s neinvazivním onemocněním vysokého stupně má zbytkový nádor po primárním TURBT, v takových případech je druhý TURBT důležitý pro zabránění nedostatečnému stagingu.[99][100] V tomto okamžiku se doporučuje zařazení lidí do rizikových skupin. Léčba a sledování různých rizikových skupin je uvedena v tabulce níže.
Chemoterapie
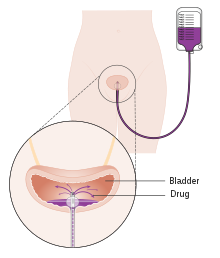
Jednorázová instilace chemoterapie do močového měchýře po primární TURBT prokázala přínos při snižování recidivy o 35% u mimosvalového onemocnění.[101] Léky, které lze k tomuto účelu použít, jsou mitomycin C. (MMC), epirubicin, pirarubicin a gemcitabin. Instituce pooperační chemoterapie by měla být provedena během několika prvních hodin po TURBT. Postupem času je známo, že zbytkové nádorové buňky pevně přilnou a jsou pokryty extracelulární matricí, která snižuje účinnost instilace.[100] Nejběžnějším vedlejším účinkem je chemická cystitida a podráždění kůže.[101] Pokud existuje podezření na perforaci močového měchýře během TURBT, neměla by se do močového měchýře instilovat chemoterapie, protože je známo, že v důsledku extravazace lékem dochází k závažným nežádoucím účinkům. Studie prokázaly, že účinnost chemoterapie je zvýšena použitím chemoterapie pomocí zařízení.[102] Tyto technologie používají různé mechanismy k usnadnění absorpce a působení chemoterapeutického léku vštípeného přímo do močového měchýře. Další technologie - elektromotorické podávání léků (EMDA) - používá elektrický proud ke zvýšení absorpce léčiva po chirurgickém odstranění nádoru.[103][104] Další technologie, termoterapie, využívá vysokofrekvenční energii k přímému ohřevu stěny močového měchýře, což spolu s chemoterapií (chemohypertermií) vykazuje synergický účinek, který zvyšuje vzájemnou schopnost zabíjet nádorové buňky.[105]
Imunoterapie

Imunoterapie podle Bacillus Calmette – Guérin (BCG ) dodávka do močového měchýře se také používá k léčbě a prevenci opakování NMIBC.[106] BCG je vakcína proti tuberkulóza který je připraven z oslabeného (oslabeného) živého bacilního tuberkulózy skotu, Mycobacterium bovis, který ztratil své virulence u lidí. BCG imunoterapie je v této fázi účinný až ve 2/3 případů a v randomizované studie bylo prokázáno, že je lepší než standardní chemoterapie.[107] Přesný mechanismus, kterým BCG zabraňuje opakování, není znám. Ukázalo se však, že bakterie jsou přijímány rakovinnými buňkami.[108] Infekce těchto buněk v močovém měchýři může vyvolat lokalizovanou imunitní reakci, která vyčistí zbytkové rakovinné buňky.[109][110]
BCG je dodáván jako indukční a údržbový kurz. Indukční kurz se skládá z 6týdenního cyklu intravezikálního a perkutánního BCG.[111] Poté následuje kurz údržby. Neexistuje žádná shoda ohledně harmonogramu údržby, nejčastěji se však používá plán Southwestern Oncology Group (SWOG).[112] Plán údržby SWOG se skládá z intravezikální a perkutánní BCG každý týden po dobu 3 týdnů podávaných ve 3, 6, 12, 18, 24, 30 a 36 měsících.[111] Třítýdenní udržovací režim s indukcí prokázal míru úplné odpovědi 84% ve srovnání s 69% u lidí, kteří dostávali 6týdenní indukci BCG pouze za 6 měsíců. Mnoho studií zkoumalo alternativní plány léčby a režimy léčby BCG ale neprokázala žádný klinický význam.[111] Účinnost různých kmenů BCG (Connaught, TICE, Pasteur, Tokio-172) se ukázalo, že se neliší, nicméně neexistují žádné důkazy na vysoké úrovni.[113]
Mezi vedlejší účinky terapie BCG patří cystitida, prostatitida, epididymo-orchitida, balanitida, obstrukce močovodu, kontrakce močového měchýře, mykobakteriální osteomyelitida, reaktivní artritida mykobakteriální pneumonie, granulomatózní hepatitida, granulomatózní nefritida, intersticiální nefritida, infekční vaskulitida a rozšířená infekce.[114][115]
Lokální infekce (tj. prostatitida, epididymo-orchitida, balanitida ) z důvodu BCG by měla být léčena trojitou tuberkulární terapií, přičemž jedním z těchto léků je fluorochinolon po dobu 3 až 6 měsíců. U lidí se systémovými infekcemi by měla být léčba BCG ukončena a měla by být zahájena antituberkulární multidrogová léčba po dobu nejméně 6 měsíců. Léky, které lze k této léčbě použít, jsou INH, rifampicin, ethambutol, fluorochinolony, klarithromycin, aminoglykosidy, a doxycyklin. Kmeny BCG nejsou citlivé na pyrazinamid proto by neměl být součástí antituberkulózní léčby.[116]
Selhání léčby BCG
Selhání léčby BCG lze rozdělit do 3 skupin; Relaps BCG, BCG-refrakterní a BCG-netolerantní. Při relapsu BCG se nádor znovu objeví po období bez onemocnění. BCG refrakterní tumory jsou ty, které nereagují na indukční a udržovací dávky BCG nebo které postupují během léčby. U pacientů s intolerancí BCG se nádor opakuje v důsledku neúplné léčby, protože osoba, která jej přijímá, není schopna tolerovat indukční průběh BCG. Přibližně 50% lidí selže při léčbě BCG a bude vyžadovat další léčbu.[111]
Léčba lidí, jejichž tumory se po léčbě BCG opakovaly nebo kteří na léčbu nereagovali, je obtížnější.[117] U takových lidí a radikální cystektomie je doporučení[118][119] U lidí, kteří nevykazují reakci na terapii BCG a nejsou způsobilí nebo nechtějí podstoupit radikální cystektomie lze uvažovat o záchranných terapiích. Záchranná terapie zahrnuje intravezikální chemoterapii látkami, jako je valrubicin, gemcitabin nebo docetaxel, chemoradiace nebo chemohypertermie.[120]
| Riziko | Další úvahy | Chemoterapie | Imunoterapie (BCG) | Cystoskopie (dohled) | Zobrazování (dohled) |
|---|---|---|---|---|---|
| Nízký | ve 3 měsících následovaná cystoskopií ve 12 měsících, poté ročně po dobu 5 let | CT / MR urografie a CT / MRI břicha a pánve na počátku | |||
| středně pokročilí | Primární nádor s anamnézou chemoterapie | Intravezikální chemoterapie po dobu 1 roku NEBO intravezikální BCG po dobu 1 roku (preferováno) | po 3 měsících s cytologií, poté jednou za 3–6 měsíců po dobu 5 let a poté ročně | CT / MR urografie a CT / MRI břicha a pánve na počátku | |
| Rekurentní nádory s anamnézou předchozí chemoterapie | Intravezikální BCG po dobu 1 roku | ||||
| Vysoký | Intravezikální BCG po dobu 3 let (podle tolerance) | po 3 měsících s cytologií následované jednou za 3 měsíce po dobu 2 let poté, 6 měsíců po dobu 5 let poté ročně | CT / MR urografie a CT / MRI břicha a pánve na začátku, CT / MR urografie 1-2 ročně po dobu 10 let | ||
| T1G3 / Vysoký stupeň, Lymfovaskulární invaze, Přítomnost variantní histologie | Zvažte radikální cystektomii | ||||
Svaly invazivní

Multimodální terapie (standardní léčba)
Neléčené, nesvalové invazivní nádory mohou postupně začít pronikat do svalové stěny močového měchýře (svalová invazivní rakovina močového měchýře). Nádory, které infiltrují stěnu močového měchýře, vyžadují radikálnější operaci, kde část (částečná cystektomie ) nebo vše (radikální cystektomie ) močového měchýře je odstraněn (cystektomie) a močový proud je odkloněn do izolované střevní smyčky (nazývané ileální potrubí nebo urostomie ). V některých případech mohou zkušení chirurgové vytvořit náhradní močový měchýř (a neobladder ) ze segmentu střevní tkáně, ale to do značné míry závisí na preferencích osoby, věku osoby, funkce ledvin a místo onemocnění. Radikální cystektomii by měla doprovázet bilaterální pánevní lymfadenektomie. Minimálně standardní šablona lymfadenektomie by mělo následovat odstranění externí a vnitřní iliak a obturátorová lymfatická uzlina.[121] Radikální cystektomie je spojena s významnou morbiditou. About 50-65% of the people experience complication within 90 days of surgery.[122][123] Mortality rates was 7% within 90 days of surgery. High volume centers have better outcomes than low volume centers.[124] Some centers are implementing Enhanced Recovery After Surgery (ERAS) society recommendations to decrease morbidity after radical cystectomy. However, due to lack of specific evidence in urologic surgery, ERAS protocol has not been widely incorporated in urologic clinical care.[125]
Even after surgical removal of bladder, 50% of the people with muscle invasive disease (T2-T4) develop metastatic disease within two years due to micrometastasis,.[126] In such, neoadjuvant chemotherapy (chemotherapy before main treatment, i.e. surgery) has shown to increase overall survival at 5 years from 45% to 50% with an absolute survival benefit of 5%.[127][128][129] Currently the two most used chemotherapy regimens for neoadjuvant chemotherapy are platinum based; methotrexát, vinblastin, doxorubicin, cisplatina (MVAC) and gemcitabin s cisplatina (GC).[130] Other regimens include dose dense MVAC (DDMVC) and cisplatin, methotrexate and vinblastine (CMV).Although, the optimal regimen has not been established, the preferred regimen for neoadjuvant therapy is MVAC.[130]
Role of adjuvant chemotherapy (chemotherapy after main treatment) is limited to people with high grade tumours (pT3/T4and/or N+) and who have not been treated with neoadjuvant therapy.[121] Adjuvant radiation therapy has not shown any advantage in bladder cancer treatment.[131]
| MVAC | DDMVAC | Gemcitabine + cisplatin |
|---|---|---|
| Methotrexate (30 mg/m2 IV) - day 1,15,22 Vinblastine (3 mg/m2 IV) - day 2, 15, 22 Doxorubicin (30 mg/m2 IV) - day 2 Cisplatin (70 mg/m2 IV) - day 2 Repeat every 4 weeks for 3 cycles | Methotrexate (30 mg/m2 IV) - day 1 Vinblastine (3 mg/m2 IV) - day 2 Doxorubicin (30 mg/m2 IV) - day 2 Cisplatin (70 mg/m2 IV) - day 2 Granulocyte colony-stimulating factor (G-CSF) (240μg/m2 SC) - day 4-10 Repeat every 2 weeks for 3–4 cycles | Gemcitabine (1,000 mg/m2 IV) - day 1,8,15 Cisplatin (70 mg/m2) - day 2 Repeat every 4 weeks for 4 cycles |
Trimodal therapy (alternative treatment)
Kombinace záření a chemoterapie (chemoradiation) in conjunction with transurethral (endoscopic) bladder tumor resection can be used as an alternative in certain people.[134] Review of available large data series on this so-called trimodality therapy has indicated similar long-term cancer specific survival rates, with improved overall quality of life as for people undergoing radical cystectomy with urinary reconstruction. However, currently no randomized control trials are available which has compared trimodal therapy with radical cystectomy. People who undergo trimodal therapy are usually highly selected and generally have T2 disease without hydronephrosis and/or carcinoma in-situ.[135] Five year cancer specific survival and overall survival after trimodal therapy is between 50% to 82% and 36% to 74%.[134]
In trimodal therapy, a maximal TURBT is conducted followed by chemoradiation therapy. Radiation sensitizing chemotherapy regimens consisting of cisplatin or 5-flurouracil and mitomycin C are used. Radiační terapie is via external bean radiotherapy (EBRT ) with a target curative dose of 64-66 Gy.[136] Surveillance for progression or recurrence should conducted with the aid of CT, cystoscopies and urine cytology.[121] Side effects of chemoradiation include nevolnost, zvracení, ztráta chuti k jídlu, ztráta vlasů, vředy v ústech, průjem, zácpa, increased risk of infections and krvácející and fatigue.[137]
In people who fail trimodal therapy, radical cystectomy is considered if there is muscle invasive or recurrent tumors. Around 25-30% fail treatment and undergo salvage radical cystectomy.[134] TURBT with intravesical therapy is indicated after treatment failure for non-muscle invasive disease.[121]
Partial cystectomy
In people with solitary tumor without concurrent carcinoma in situ in an area where a clean surgical margins can be achieved, a partial cystectomy with lymphadenectomy can be considered. Management plan including partial cystectomy should be accompanied with neoadjuvant chemoterapie.[96] In people with urachal adenocarcinoma of the bladder, a partial cystectomy with en-bloc resection of urachal ligament and umbilicus can be considered.[10]
Metastatic disease
First line treatment
Cisplatina -containing combination chemotherapy is the standard of care for metastatic bladder care.[138] Fitness for receiving cisplatin based chemotherapy is assessed before treatment. A person is deemed unfit if anyone of the following is true.[139]
- Eastern Cooperative Oncology Group performance status of 2
- Creatinine clearance < 60 mL/min
- Grade ≥ 2 hearing loss
- Grade ≥ 2 neuropatie
- New York Heart Association Class III heart failure
People who are deemed fit receive platinum based regimens; methotrexát, vinblastin, doxorubicin, with cisplatin (MVAC) or gemcitabin with cisplatin (GC). Alternative regimens include paclitaxel with gemcitabine and cisplatin (PCG, triple therapy) and cisplatin, methotrexate and vinblastine (CMV). Response rate for cisplatin-based combination ranges from 39 to 65% and complete response is seen in 12-35 of the people.[140] MVAC is better tolerated if it is combined with faktor stimulující kolonie granulocytů and the regimen is known as dose dense MVAC regimen (DDMVAC). This combination has shown to decease all cause mortality.[141] MVAC regimen is aggressive. Febrile neutropenia (fever due to decrease in white blood cells) occurs in 10 to 14% and death due to toxicity in about 3-4%. Common side effects of MVAC include suppression of kostní dřeň, fever due to decrease in white blood cells, sepse, mukozitida, a nevolnost a zvracení.[140] In contrast, the GC regimen has shown lower rates of neutropenic sepsis and grade 3/4 mukozitida compared to MVAC.[142] Efforts have been made to increase tolerance of cisplatin-based regimen by replacing it with karboplatina -based chemotherapy. However, cisplatin-based therapy is superior to karboplatina -based chemotherapy in achieving overall and complete response.[143] Nevertheless, nearly half of the people with metastatic disease are "unfit" for cisplatin-based therapy. In such persons a combination of karboplatina a gemcitabin (GemCarbo) can be used as first line chemoterapie.[144] In people who are not eligible for any platinum based chemoterapie a mít PD-L1 výraz, Atezolizumab a Pembrolizumab může být použito.
People with bone metastasis should receive bisfosfonáty nebo denosumab to prevent skeletal related events (e.g. zlomeniny, spinal cord compression, bone pain).[145]
| DDMVAC | Gemcitabine + Cisplatin |
|---|---|
| Methotrexate (30 mg/m2 IV) - day 1 Vinblastine (3 mg/m2 IV) - day 2 Doxorubicin (30 mg/m2 IV) - day 2 Cisplatin (70 mg/m2 IV) - day 2 Granulocyte colony-stimulating factor (G-CSF) (240μg/m2 SC) - day 4-10 Repeat every 2 weeks for 3–4 cycles | Gemcitabine (1,000 mg/m2 IV) - day 1,8,15 Cisplatin (70 mg/m2) - day 2 Repeat every 4 weeks for 4 cycles |
| Atezolizumab (in PD-L1+) | Gemcitabine + Carboplatin | Pembrolizumab (in PD-L1+) |
|---|---|---|
| Atezolizumab (Atezolizumab 1200 mg IV) every 3 weeks | Gemcitabine (1,000 mg/m2 IV) - day 1,8 Carboplatin (4.5 × [glomerular filtration rate + 25]) - day 1 and every 3 weeks | Pembrolizumab 200 mg every 3 weeks |
Second line treatment
Bladder cancer that is refractory or shows progression after platinum based chemotherapy can be treated with second-line chemotherapy or immunotherapy.
The most commonly used second-line chemotherapy is single-agent regimes of Taxany (Paclitaxel, nab-paclitaxel a Docetaxel ). Other single-agent regimes include Vinflunin, a third generation vinca alkaloid (approved in Europe), Gemcitabin, Pemetrexed, Oxaliplatina, a Ifosfamid.[146][147][148] Side effects of Vinflunin zahrnout neutropenie, zácpa, fatigue and anémie and has limited its use as a second line agent. Response to second-line chemotherapy occurs in 5%–20% people. Median progression free survival with second-line chemotherapy is 3–4 months.[149]
U lidí s fibroblast growth factor receptors (FGFR ) mutations and fail standard platinum based chemotherapy erdafitinib může být použito. Erdafitinib has shown a response rate of 40% in these patients.[150] Five immunotherapy agents has been approved in the US for use in metastatic bladder cancer. They act by inhibiting programmed cell-death protein 1 (PD-1) nebo programmed cell-death ligand 1 (PD-L1). Pembrolizumab a nivolumab, and are inhibitors of programmed cell-death ligand 1 (PD-1). Avelumab, atezolizumab a durvalumab are inhibitors of PD-L1.[151][152]
| Atezolizumab | Nivolumab | Pembrolizumab | Durvalumab | Avelumab |
|---|---|---|---|---|
| Atezolizumab 1200 mg IV every 3 weeks | Nivolumab 3 mg/kg IV every 2 weeks | Pembrolizumab 200 mg every 3 weeks | Durvalumab 10 mg/kg every 2 weeks for 12 months | Avelumab 10 mg/kg IV every 2 weeks |
Surveillance and response
Contrast enhanced CT is used to monitor lung, liver, and lymph node metastasis. A kostní sken is used to detect and monitor bone metastasis.[153] Treatment response is measured using the Response evaluation criteria in solid tumors (ZÁZNAM ) into one of the following groups; response (complete or partial), stable disease and progressive disease.[154]
Prognóza
People with non-muscle invasive tumors, have a favorable outcome (5-year survival is 95% vs. 69% of muscle invasive bladder cancer).[155][156] However, 70% of them will have a recurrence after initial treatment with 30% of them presenting with muscle invasive disease.[157] Recurrence and progression to a higher disease stage have a less favorable outcome.[158]
Survival after radical cystectomy and pelvic lymfatická uzlina dissection is dependent on the pathological stage. If the disease has not spread to the lymfatická uzlina and is limited to the měchýř (T1 or T2, N0) the 5-year survival is 78%. If it has spread locally around the region of the bladder with no lymfatická uzlina involved (T3, N0) then the 5-year survival drops to 47%. In disease with lymph node spread (N+, irrespective of T stage) the 5-year survival is 31%. Locally advanced and metastatic disease drastically decreases survival, with a median survival of 3–6 months without chemotherapy. Cisplatina -based chemotherapy has increased the median survival to 15-months. However, the 5-year survival is still 15%.[159]
There are several prognostic factors which determine cancer specific survival after radical cystectomy. Factor with detrimental effect of cancer specific survival are old age, higher tumor grade and pathological stage, lymfatická uzlina metastáza, presence of lymphovascular invasion and positive soft tissue margin.[160] Lymph node density (positive lymph nodes/total lymfatické uzliny observed in the specimen from surgery) is a predictor of survival in lymph node positive disease. Higher the density lower is the survival.[161]
Kvalita života
After radical cystectomy, urinary and sexual function remain inferior to the general population. People who have a neobladder have better emotional function and body image compared with ones with cutaneous diversion (who need to wear a bag to collect urine over their abdomen).[162] Social factors such family, relationships, health and finances contribute significantly for determining good quality of life in people who have been diagnosed with bladder cancer.[163]
A high percentage of people with bladder cancer have úzkost a Deprese.[164] People who are young, single and have advanced clinical disease have a high risk for getting diagnosed with a psychiatric illness post-treatment. People who suffer from psychiatric illness post treatment seem to have worse cancer specific and overall survival.[165][166]
Epidemiologie
| Hodnost | Země | Celkově | Muži | Ženy |
|---|---|---|---|---|
| 1 | Libanon | 25 | 40 | 9 |
| 2 | Řecko | 21 | 40 | 4 |
| 3 | Dánsko | 18 | 29 | 8 |
| 4 | Maďarsko | 17 | 27 | 9 |
| 5 | Albánie | 16 | 27 | 6 |
| 5 | Holandsko | 16 | 26 | 8 |
| 7 | Belgie | 16 | 27 | 6 |
| 8 | Itálie | 15 | 27 | 6 |
| 9 | Německo | 15 | 26 | 6 |
| 10 | Španělsko | 15 | 27 | 6 |
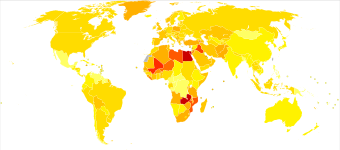
Globally, in 2017, bladder cancer resulted in 196,000 deaths, a 5.4% (age adjusted ) decrease from 2007.[170] In 2018, the age adjusted rates of new cases of bladder cancer was 6 cases per 100,000 people and age adjusted death rate was 2 deaths per 100,000 people. Libanon a Řecko have the highest rate of new cases. v Libanon, this high risk is attributed to high number of smokers and petrochemický air pollution.[171]
The risk of bladder cancer occurrence is four times higher in men than in women.[3] Kouření can only partially explain this higher rates in men in western hemisphere.[172] One other reason is that the androgenní receptor, which is much more active in men than in women, may play a part in the development of the cancer.[173] This hypothesis is also supported by the fact that men undergoing androgen suppression therapy for unrelated reason seem to have a lower risk of developing bladder cancer.[174] v Afrika, men are more prone to do field work and are exposed to infection with Schistosoma, this may explain to a certain extent the gap in incidence of squamous cell cancers in areas where bladder cancer is endemic.[172] However, women present with more aggressive disease and have worse outcomes than men. This difference in outcomes is attributed to numerous factors such as, difference in carcinogen exposure, genetika, social and quality of care.[47] One of the common signs of bladder cancer is hematuria and is quite often misdiagnosed as urinary tract infection in women, leading to a delay in diagnosis.[47] Moreover, as mentioned earlier PSCA gene may play a role in aggressive tumors in women.
Kanada
Bladder cancer is the sixth most common cancer accounting for 3.7% of the new cancer cases. in 2018, 30,700 Canadians were living with bladder cancer, 9160 new cases were diagnosed and 2467 died from it.[175] In 2019, it is estimated that 11,800 new cases will be diagnosed and 2500 will die from it.[176] Among the 11,800 new cases, 9100 will be in men and 2700 in women. Of the 2500 who would die from it, 1800 will men and 700 will be women.[176]
Čína
Bladder cancer is the 14th most common cancer and 16th most common cause of cancer death. In, 2018 it accounted for 82,300 new cases and 38,200 deaths.[177] The number of new cases is comparatively lower compared to its western counterparts. Majority of the people are diagnosed with non-muscle invasive disease (75%) and the rest have muscle invasive disease (25%). Carcinoma in situ was present in only 2.4% of the cases.[178]
Evropa
In 2015, 131,000 news cases were diagnosed in the European Union with 40,000 deaths. It is the 5th most common cancer and 9th most common cause of cancer deaths.. The 5-year relative survival for bladder cancers diagnosed between 2000 and 2007 is 69%. Geographic variation is seen in survival rates with 5-year survival rates of 75% in Northern to 65% in Eastern Europe.[179]
Spojené království
Bladder cancer is the ninth most common cancer in the Spojené království accounting for 2.7% of all the new cancers cases. In 2018, there was 12,200 new cases and 6100 people died from it.[180]
NÁS
V Spojené státy in 2019 80,470 cases and 17,670 deaths are expected making it the sixth most common type of cancer in the region.[2] Bladder cancer is the fourth most common type of cancer in men and the 12th most common cancer in women.[181] Around 62,000 men and 19,000 women are diagnosed with bladder cancer in 2019.[182] Between 2012 and 2016 annual rate of new bladder cancer cases decreased by one percent per year.[183]
Viz také
Reference
- ^ A b C d E F G h i j k l m n "Bladder Cancer Treatment (PDQ®)–Patient Version - National Cancer Institute". www.cancer.gov. 11. května 2020. Citováno 4. června 2020.
- ^ A b C d E F "Cancer of the Urinary Bladder - Cancer Stat Facts". SEER. Citováno 30. října 2019.
- ^ A b C d E F "Bladder Cancer Factsheet" (PDF). Global Cancer Observatory. Citováno 8. listopadu 2019.
- ^ "Bladder Cancer Treatment". Národní onkologický institut. 5. června 2017. Archivováno z původního dne 14. července 2017. Citováno 18. července 2017.
- ^ "EAU Guidelines: Non-muscle-invasive Bladder Cancer". Uroweb.
- ^ "Bladder Cancer - Stages and Grades". Cancer.Net. 25. června 2012.
- ^ "Bladder cancer". World Cancer Research Fund. 24. dubna 2018.
- ^ "Survival statistics for bladder cancer - Canadian Cancer Society". www.cancer.ca.
- ^ Avellino GJ, Bose S, Wang DS (June 2016). "Diagnosis and Management of Hematuria". Chirurgické kliniky Severní Ameriky. 96 (3): 503–15. doi:10.1016/j.suc.2016.02.007. PMID 27261791.
- ^ A b Klaile Y, Schlack K, Boegemann M, Steinestel J, Schrader AJ, Krabbe LM (October 2016). "Variant histology in bladder cancer: how it should change the management in non-muscle invasive and muscle invasive disease?". Překladová andrologie a urologie. 5 (5): 692–701. doi:10.21037/tau.2016.06.13. PMC 5071184. PMID 27785426.
- ^ Abeloff's clinical oncology. Niederhuber, John E.,, Armitage, James O., 1946-, Doroshow, James H.,, Kastan, M. B. (Michael B.),, Tepper, Joel E.,, Preceded by: Abeloff, Martin D. (6th ed.). Philadelphia, PA. 8 January 2019. p. 1388. ISBN 978-0-323-56815-9. OCLC 1089396489.CS1 maint: ostatní (odkaz)
- ^ Hodges, Stephanie C.; Holt, Harry R.; Degeorge, Katharine C. (15 October 2017). "Bladder Cancer: Diagnosis and Treatment". Americký rodinný lékař. 96 (8): 507–514. PMID 29094888.
- ^ Zeegers MP, Tan FE, Dorant E, van Den Brandt PA (August 2000). "The impact of characteristics of cigarette smoking on urinary tract cancer risk: a meta-analysis of epidemiologic studies". Rakovina. 89 (3): 630–9. doi:10.1002/1097-0142(20000801)89:3<630::AID-CNCR19>3.0.CO;2-Q. PMID 10931463.
- ^ A b van Osch FH, Jochems SH, van Schooten FJ, Bryan RT, Zeegers MP (June 2016). "Quantified relations between exposure to tobacco smoking and bladder cancer risk: a meta-analysis of 89 observational studies". International Journal of Epidemiology. 45 (3): 857–70. doi:10.1093/ije/dyw044. PMID 27097748.
- ^ Letašiová S, Medve'ová A, Šovčíková A, Dušinská M, Volkovová K, Mosoiu C, Bartonová A (June 2012). "Bladder cancer, a review of the environmental risk factors". Environmentální zdraví. 11 Suppl 1: S11. doi:10.1186/1476-069X-11-S1-S11. PMC 3388449. PMID 22759493.
- ^ Brennan P, Bogillot O, Cordier S, Greiser E, Schill W, Vineis P, et al. (Duben 2000). "Cigarette smoking and bladder cancer in men: a pooled analysis of 11 case-control studies". International Journal of Cancer. 86 (2): 289–94. doi:10.1002/(sici)1097-0215(20000415)86:2<289::aid-ijc21>3.0.co;2-m. PMID 10738259.
- ^ Yan H, Ying Y, Xie H, Li J, Wang X, He L, et al. (2018). "Secondhand smoking increases bladder cancer risk in nonsmoking population: a meta-analysis". Cancer Management and Research. 10: 3781–3791. doi:10.2147/CMAR.S175062. PMC 6159806. PMID 30288109.
- ^ "Health Risks of Secondhand Smoke". www.cancer.org. Citováno 21. listopadu 2019.
- ^ Afshari M, Janbabaei G, Bahrami MA, Moosazadeh M (2017). "Opium and bladder cancer: A systematic review and meta-analysis of the odds ratios for opium use and the risk of bladder cancer". PLOS ONE. 12 (6): e0178527. Bibcode:2017PLoSO..1278527A. doi:10.1371/journal.pone.0178527. PMC 5460843. PMID 28586371.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risk to Humans (2012). 4-AMINOBIPHENYL. International Agency for Research on Cancer.
- ^ Saint-Jacques N, Parker L, Brown P, Dummer TJ (June 2014). "Arsenic in drinking water and urinary tract cancers: a systematic review of 30 years of epidemiological evidence". Environmentální zdraví. 13: 44. doi:10.1186/1476-069X-13-44. PMC 4088919. PMID 24889821.
- ^ Clin B, Pairon JC (November 2014). "Medical follow-up for workers exposed to bladder carcinogens: the French evidence-based and pragmatic statement". Veřejné zdraví BMC. 14: 1155. doi:10.1186/1471-2458-14-1155. PMC 4230399. PMID 25377503.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risk to Humans (2012). CHLORNAPHAZINE. International Agency for Research on Cancer.
- ^ Humans, IARC Working Group on the Evaluation of Carcinogenic Risk to (2012). 2-NAPHTHYLAMINE. International Agency for Research on Cancer.
- ^ Reulen RC, Kellen E, Buntinx F, Brinkman M, Zeegers MP (September 2008). "A meta-analysis on the association between bladder cancer and occupation". Scandinavian Journal of Urology and Nephrology. Supplementum. 42 (218): 64–78. doi:10.1080/03008880802325192. PMID 18815919. S2CID 30510231.
- ^ Guha N, Steenland NK, Merletti F, Altieri A, Cogliano V, Straif K (August 2010). "Bladder cancer risk in painters: a meta-analysis". Pracovní a environmentální medicína. 67 (8): 568–73. doi:10.1136/oem.2009.051565. PMID 20647380.
- ^ Harling M, Schablon A, Schedlbauer G, Dulon M, Nienhaus A (May 2010). "Bladder cancer among hairdressers: a meta-analysis". Pracovní a environmentální medicína. 67 (5): 351–8. doi:10.1136/oem.2009.050195. PMC 2981018. PMID 20447989.
- ^ Mostafa MH, Sheweita SA, O'Connor PJ (January 1999). "Relationship between schistosomiasis and bladder cancer". Recenze klinické mikrobiologie. 12 (1): 97–111. doi:10.1128/CMR.12.1.97. PMC 88908. PMID 9880476.
- ^ Zaghloul MS (December 2012). "Bladder cancer and schistosomiasis". Journal of the Egyptian National Cancer Institute. 24 (4): 151–9. doi:10.1016/j.jnci.2012.08.002. PMID 23159285.
- ^ Mostafa MH, Helmi S, Badawi AF, Tricker AR, Spiegelhalder B, Preussmann R (April 1994). "Nitrate, nitrite and volatile N-nitroso compounds in the urine of Schistosoma haematobium and Schistosoma mansoni infected patients". Karcinogeneze. 15 (4): 619–25. doi:10.1093/carcin/15.4.619. PMID 8149471.
- ^ Badawi AF (August 1996). "Molecular and genetic events in schistosomiasis-associated human bladder cancer: role of oncogenes and tumor suppressor genes". Dopisy o rakovině. 105 (2): 123–38. doi:10.1016/0304-3835(96)04284-x. PMID 8697435.
- ^ Chaudhary KS, Lu QL, Abel PD, Khandan-Nia N, Shoma AM, el Baz M, et al. (Leden 1997). "Expression of bcl-2 and p53 oncoproteins in schistosomiasis-associated transitional and squamous cell carcinoma of urinary bladder". British Journal of Urology. 79 (1): 78–84. doi:10.1046/j.1464-410x.1997.30717.x. PMID 9043502.
- ^ Shokeir AA (January 2004). "Squamous cell carcinoma of the bladder: pathology, diagnosis and treatment". BJU International. 93 (2): 216–20. doi:10.1111/j.1464-410x.2004.04588.x. PMID 14690486. S2CID 10487371.
- ^ Monach PA, Arnold LM, Merkel PA (January 2010). "Incidence and prevention of bladder toxicity from cyclophosphamide in the treatment of rheumatic diseases: a data-driven review". Artritida a revmatismus. 62 (1): 9–21. doi:10.1002/art.25061. PMID 20039416.
- ^ Yang HY, Chen PC, Wang JD (2014). "Chinese herbs containing aristolochic acid associated with renal failure and urothelial carcinoma: a review from epidemiologic observations to causal inference". BioMed Research International. 2014: 569325. doi:10.1155/2014/569325. PMC 4241283. PMID 25431765.
- ^ Suriano F, Altobelli E, Sergi F, Buscarini M (2013). "Bladder cancer after radiotherapy for prostate cancer". Recenze v urologii. 15 (3): 108–12. PMC 3821989. PMID 24223022.
- ^ Sun JW, Zhao LG, Yang Y, Ma X, Wang YY, Xiang YB (24 March 2015). "Obesity and risk of bladder cancer: a dose-response meta-analysis of 15 cohort studies". PLOS ONE. 10 (3): e0119313. Bibcode:2015PLoSO..1019313S. doi:10.1371/journal.pone.0119313. PMC 4372289. PMID 25803438.
- ^ Al-Zalabani AH, Stewart KF, Wesselius A, Schols AM, Zeegers MP (September 2016). "Modifiable risk factors for the prevention of bladder cancer: a systematic review of meta-analyses". European Journal of Epidemiology. 31 (9): 811–51. doi:10.1007/s10654-016-0138-6. PMC 5010611. PMID 27000312.
- ^ "Cancer Genetics Browser". cancer.sanger.ac.uk. Citováno 21. listopadu 2019.
- ^ Online Mendelian Inheritance in Man (OMIM): 109800
- ^ Zhang X, Zhang Y (September 2015). "Bladder Cancer and Genetic Mutations". Buněčná biochemie a biofyzika. 73 (1): 65–9. doi:10.1007/s12013-015-0574-z. PMID 27352265. S2CID 14316154.
- ^ "Bladder cancer". Genetická domácí reference.
- ^ Ahmad I, Sansom OJ, Leung HY (May 2012). "Exploring molecular genetics of bladder cancer: lessons learned from mouse models". Modely a mechanismy nemocí. 5 (3): 323–32. doi:10.1242/dmm.008888. PMC 3339826. PMID 22422829.
- ^ Humphrey PA, Moch H, Cubilla AL, Ulbright TM, Reuter VE (July 2016). "The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours" (PDF). Evropská urologie. 70 (1): 106–119. doi:10.1016/j.eururo.2016.02.028. PMID 26996659.
- ^ Engel LS, Taioli E, Pfeiffer R, Garcia-Closas M, Marcus PM, Lan Q, et al. (July 2002). "Pooled analysis and meta-analysis of glutathione S-transferase M1 and bladder cancer: a HuGE review". American Journal of Epidemiology. 156 (2): 95–109. doi:10.1093/aje/kwf018. PMID 12117698.
- ^ A b C "Bladder Cancer Report" (PDF). World Cancer Research Fund : International. Citováno 9. listopadu 2019.
- ^ A b C Marks P, Soave A, Shariat SF, Fajkovic H, Fisch M, Rink M (October 2016). "Female with bladder cancer: what and why is there a difference?". Překladová andrologie a urologie. 5 (5): 668–682. doi:10.21037/tau.2016.03.22. PMC 5071204. PMID 27785424.
- ^ Choi W, Ochoa A, McConkey DJ, Aine M, Höglund M, Kim WY, et al. (Září 2017). "Genetic Alterations in the Molecular Subtypes of Bladder Cancer: Illustration in the Cancer Genome Atlas Dataset". Evropská urologie. 72 (3): 354–365. doi:10.1016/j.eururo.2017.03.010. PMC 5764190. PMID 28365159.
- ^ Choi W, Czerniak B, Ochoa A, Su X, Siefker-Radtke A, Dinney C, McConkey DJ (July 2014). "Intrinsic basal and luminal subtypes of muscle-invasive bladder cancer". Recenze přírody. Urologie. 11 (7): 400–10. doi:10.1038/nrurol.2014.129. PMID 24960601. S2CID 24723395.
- ^ "EAU Guidelines: Non-muscle-invasive Bladder Cancer Diagnosis". Uroweb. Citováno 12. listopadu 2019.
- ^ A b "EAU Guidelines: Muscle-invasive and Metastatic Bladder Cancer diagnosis". Uroweb. Citováno 12. listopadu 2019.
- ^ A b C "Uroweb - European Association of Urology (EAU)". Uroweb. Citováno 7. listopadu 2019.
- ^ "Bladder Cancer Treatment". Národní onkologický institut. 8. května 2020. Citováno 4. června 2020.
- ^ Lotan Y, Roehrborn CG (January 2003). "Sensitivity and specificity of commonly available bladder tumor markers versus cytology: results of a comprehensive literature review and meta-analyses". Urologie. 61 (1): 109–18, discussion 118. doi:10.1016/S0090-4295(02)02136-2. PMID 12559279.
- ^ Shariat SF, Karam JA, Lotan Y, Karakiewizc PI (2008). "Critical evaluation of urinary markers for bladder cancer detection and monitoring". Recenze v urologii. 10 (2): 120–35. PMC 2483317. PMID 18660854.
- ^ A b Chou R, Gore JL, Buckley D, Fu R, Gustafson K, Griffin JC, et al. (Prosinec 2015). "Urinary Biomarkers for Diagnosis of Bladder Cancer: A Systematic Review and Meta-analysis". Annals of Internal Medicine. 163 (12): 922–31. doi:10.7326/M15-0997. PMID 26501851.
- ^ Santoni G, Morelli MB, Amantini C, Battelli N (2018). "Urinary Markers in Bladder Cancer: An Update". Hranice v onkologii. 8: 362. doi:10.3389/fonc.2018.00362. PMC 6137202. PMID 30245975.
- ^ A b C Miyake M, Owari T, Hori S, Nakai Y, Fujimoto K (2018). "Emerging biomarkers for the diagnosis and monitoring of urothelial carcinoma". Research and Reports in Urology. 10: 251–261. doi:10.2147/RRU.S173027. PMC 6299471. PMID 30588457.
- ^ A b Goodison S, Rosser CJ, Urquidi V (April 2013). "Bladder cancer detection and monitoring: assessment of urine- and blood-based marker tests". Molekulární diagnostika a terapie. 17 (2): 71–84. doi:10.1007/s40291-013-0023-x. PMC 3627848. PMID 23479428.
- ^ Health, Center for Devices and Radiological (7 October 2019). "Nucleic Acid Based Tests". FDA.
- ^ Soria F, Droller MJ, Lotan Y, Gontero P, D'Andrea D, Gust KM, et al. (Prosinec 2018). "An up-to-date catalog of available urinary biomarkers for the surveillance of non-muscle invasive bladder cancer". World Journal of Urology. 36 (12): 1981–1995. doi:10.1007/s00345-018-2380-x. PMC 6280823. PMID 29931526.
- ^ A b C d Andreassen, B. K.; Aagnes, B.; Gislefoss, R.; Andreassen, M.; Wahlqvist, R. (2016). "Incidence and Survival of urothelial carcinoma of the urinary bladder in Norway 1981-2014". Rakovina BMC. 16 (1): 799. doi:10.1186/s12885-016-2832-x. ISSN 1471-2407. PMC 5064906. PMID 27737647.
- ^ A b C "Types of Bladder Cancer: TCC & Other Variants". CancerCenter.com. Citováno 10. srpna 2018.
- ^ A b Amin MB (June 2009). "Histological variants of urothelial carcinoma: diagnostic, therapeutic and prognostic implications". Moderní patologie. 22 Suppl 2 (S2): S96–S118. doi:10.1038/modpathol.2009.26. PMID 19494856.
- ^ Tang DH, Chang SS (December 2015). "Management of carcinoma in situ of the bladder: best practice and recent developments". Terapeutické pokroky v urologii. 7 (6): 351–64. doi:10.1177/1756287215599694. PMC 4647140. PMID 26622320.
- ^ Chalasani V, Chin JL, Izawa JI (December 2009). "Histologic variants of urothelial bladder cancer and nonurothelial histology in bladder cancer". Kanadský deník urologické asociace. 3 (6 Suppl 4): S193-8. doi:10.5489/cuaj.1195. PMC 2792446. PMID 20019984.
- ^ Moschini M, D'Andrea D, Korn S, Irmak Y, Soria F, Compérat E, Shariat SF (November 2017). "Characteristics and clinical significance of histological variants of bladder cancer". Recenze přírody. Urologie. 14 (11): 651–668. doi:10.1038/nrurol.2017.125. PMID 28895563. S2CID 6351401.
- ^ Warrick JI (October 2017). "Clinical Significance of Histologic Variants of Bladder Cancer". Journal of the National Comprehensive Cancer Network. 15 (10): 1268–1274. doi:10.6004/jnccn.2017.7027. PMID 28982751.
- ^ Venyo AK, Titi S (2014). "Sarcomatoid variant of urothelial carcinoma (carcinosarcoma, spindle cell carcinoma): a review of the literature". ISRN Urology. 2014: 794563. doi:10.1155/2014/794563. PMC 3920806. PMID 24587922.
- ^ "Urothelial Carcinoma Variants - American Urological Association". www.auanet.org.
- ^ "EAU Guidelines - STAGING AND CLASSIFICATION SYSTEMS". Uroweb.
- ^ Magers MJ, Lopez-Beltran A, Montironi R, Williamson SR, Kaimakliotis HZ, Cheng L (January 2019). "Staging of bladder cancer". Histopatologie. 74 (1): 112–134. doi:10.1111/his.13734. PMID 30565300.
- ^ A b "Bladder Cancer: Stages and Grades". Cancer.net. Approved by the Cancer.Net Editorial Board 05/2019
- ^ Shinagare AB, Ramaiya NH, Jagannathan JP, Fennessy FM, Taplin ME, Van den Abbeele AD (January 2011). "Metastatic pattern of bladder cancer: correlation with the characteristics of the primary tumor". AJR. American Journal of Roentgenology. 196 (1): 117–22. doi:10.2214/AJR.10.5036. PMID 21178055.
- ^ A b Mao Y, Hedgire S, Prapruttam D, Harisinghani M (16 September 2014). "Imaging of Pelvic Lymph Nodes". Current Radiology Reports. 2 (11). doi:10.1007/s40134-014-0070-z.
- ^ Shankar PR, Barkmeier D, Hadjiiski L, Cohan RH (October 2018). "A pictorial review of bladder cancer nodal metastases". Překladová andrologie a urologie. 7 (5): 804–813. doi:10.21037/tau.2018.08.25. PMC 6212631. PMID 30456183.
- ^ "How is bladder cancer staged?". Americká rakovinová společnost. Archivováno from the original on 3 November 2019. Last Medical Review: 11/02/2019
- ^ "Survival rates for bladder cancer by stage". Americká rakovinová společnost. Archivováno from the original on 13 October 2015. Last Medical Review: 02/26/2014
- ^ Seth P. Lerner. "Overview of Diagnosis and Management of Non-Muscle Invasive Bladder Cancer" (PDF). Úřad pro kontrolu potravin a léčiv. ODAC 14 September 2016
- ^ Epstein JI, Amin MB, Reuter VR, Mostofi FK (December 1998). "The World Health Organization/International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Bladder Consensus Conference Committee". American Journal of Surgical Pathology. 22 (12): 1435–48. doi:10.1097/00000478-199812000-00001. PMID 9850170.
- ^ Compérat EM, Burger M, Gontero P, Mostafid AH, Palou J, Rouprêt M, et al. (Květen 2019). "Grading of Urothelial Carcinoma and The New "World Health Organisation Classification of Tumours of the Urinary System and Male Genital Organs 2016"". European Urology Focus. 5 (3): 457–466. doi:10.1016/j.euf.2018.01.003. PMID 29366854.
- ^ A b Chang SS, Boorjian SA, Chou R, Clark PE, Daneshmand S, Konety BR, et al. (Říjen 2016). "Diagnosis and Treatment of Non-Muscle Invasive Bladder Cancer: AUA/SUO Guideline". The Journal of Urology. 196 (4): 1021–9. doi:10.1016/j.juro.2016.06.049. PMID 27317986.
- ^ A b "Bladder Cancer: Non-Muscle Invasive Guideline - American Urological Association". www.auanet.org.
- ^ Soukup V, Čapoun O, Cohen D, Hernández V, Burger M, Compérat E, et al. (Listopad 2018). "Risk Stratification Tools and Prognostic Models in Non-muscle-invasive Bladder Cancer: A Critical Assessment from the European Association of Urology Non-muscle-invasive Bladder Cancer Guidelines Panel". European Urology Focus. 6 (3): 479–489. doi:10.1016/j.euf.2018.11.005. PMID 30470647.
- ^ Sylvester RJ, van der Meijden AP, Oosterlinck W, Witjes JA, Bouffioux C, Denis L, et al. (Březen 2006). "Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials". Evropská urologie. 49 (3): 466–5, discussion 475–7. doi:10.1016/j.eururo.2005.12.031. PMID 16442208.
- ^ Sylvester RJ, van der Meijden AP, Oosterlinck W, Witjes JA, Bouffioux C, Denis L, et al. (Březen 2006). "Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials". Evropská urologie. 49 (3): 466–5, discussion 475–7. doi:10.1016/j.eururo.2005.12.031. PMID 16442208.
- ^ Fernandez-Gomez J, Madero R, Solsona E, Unda M, Martinez-Piñeiro L, Gonzalez M, et al. (Listopad 2009). "Predicting nonmuscle invasive bladder cancer recurrence and progression in patients treated with bacillus Calmette-Guerin: the CUETO scoring model". The Journal of Urology. 182 (5): 2195–203. doi:10.1016/j.juro.2009.07.016. PMID 19758621.
- ^ "EAU Guidelines: Non-muscle-invasive Bladder Cancer". Uroweb.
- ^ Choi SY, Ryu JH, Chang IH, Kim TH, Myung SC, Moon YT, et al. (Říjen 2014). "Predicting recurrence and progression of non-muscle-invasive bladder cancer in Korean patients: a comparison of the EORTC and CUETO models". Korean Journal of Urology. 55 (10): 643–9. doi:10.4111/kju.2014.55.10.643. PMC 4198762. PMID 25324946.
- ^ A b Brinkman M, Zeegers MP (September 2008). "Nutrition, total fluid and bladder cancer". Scandinavian Journal of Urology and Nephrology. Supplementum. 42 (218): 25–36. doi:10.1080/03008880802285073. PMID 18815914. S2CID 21780999.
- ^ Brinkman M, Buntinx F, Muls E, Zeegers MP (September 2006). "Use of selenium in chemoprevention of bladder cancer". Lancet. Onkologie. 7 (9): 766–74. doi:10.1016/S1470-2045(06)70862-2. PMID 16945772.
- ^ Zamora-Ros R, Sacerdote C, Ricceri F, Weiderpass E, Roswall N, Buckland G, et al. (Říjen 2014). "Flavonoid and lignan intake in relation to bladder cancer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC) study". British Journal of Cancer. 111 (9): 1870–80. doi:10.1038/bjc.2014.459. PMC 4453722. PMID 25121955.
- ^ Valtin H (November 2002). ""Drink at least eight glasses of water a day." Really? Is there scientific evidence for "8 x 8"?". American Journal of Physiology. Regulační, integrační a srovnávací fyziologie. 283 (5): R993-1004. doi:10.1152/ajpregu.00365.2002. PMID 12376390. S2CID 2256436.
- ^ "Final Update Summary: Bladder Cancer in Adults: Screening - US Preventive Services Task Force". www.uspreventiveservicestaskforce.org. Citováno 13. listopadu 2019.
- ^ Kamat AM, Hahn NM, Efstathiou JA, Lerner SP, Malmström PU, Choi W, et al. (Prosinec 2016). "Bladder cancer". Lanceta. 388 (10061): 2796–2810. doi:10.1016/S0140-6736(16)30512-8. PMID 27345655. S2CID 29104789.
- ^ A b C "NCCN Bladder cancer guidelines 2018" (PDF). Citováno 25. listopadu 2019.
- ^ Witjes JA, Babjuk M, Gontero P, Jacqmin D, Karl A, Kruck S, et al. (Listopad 2014). "Clinical and cost effectiveness of hexaminolevulinate-guided blue-light cystoscopy: evidence review and updated expert recommendations". Evropská urologie. 66 (5): 863–71. doi:10.1016/j.eururo.2014.06.037. PMID 25001887.
- ^ Daneshmand S, Schuckman AK, Bochner BH, Cookson MS, Downs TM, Gomella LG, et al. (Říjen 2014). "Hexaminolevulinate blue-light cystoscopy in non-muscle-invasive bladder cancer: review of the clinical evidence and consensus statement on appropriate use in the USA". Recenze přírody. Urologie. 11 (10): 589–96. doi:10.1038/nrurol.2014.245. PMID 25245244.
- ^ Miladi M, Peyromaure M, Zerbib M, Saïghi D, Debré B (March 2003). "The value of a second transurethral resection in evaluating patients with bladder tumours". Evropská urologie. 43 (3): 241–5. doi:10.1016/s0302-2838(03)00040-x. PMID 12600426.
- ^ A b "EAU Guidelines: Non-muscle-invasive Bladder Cancer". Uroweb.
- ^ A b Zamboni S, Baumeister P, Mattei A, Mordasini L, Antonelli A, Simeone C, Moschini M (February 2019). "Single postoperative instillation for non-muscle invasive bladder cancer: are there still any indication?". Překladová andrologie a urologie. 8 (1): 76–84. doi:10.21037/tau.2018.08.20. PMC 6414349. PMID 30976571.
- ^ Witjes JA, Hendricksen K (January 2008). "Intravesical pharmacotherapy for non-muscle-invasive bladder cancer: a critical analysis of currently available drugs, treatment schedules, and long-term results". Evropská urologie. 53 (1): 45–52. doi:10.1016/j.eururo.2007.08.015. PMID 17719169.
- ^ Di Stasi SM, Riedl C (June 2009). „Aktualizace intravezikálního elektromotorického podávání mitomycinu-C pro mimosvalovou invazivní rakovinu močového měchýře“ (PDF). World Journal of Urology. 27 (3): 325–30. doi:10.1007 / s00345-009-0389-x. hdl:2108/6440. PMID 19234707. S2CID 24496739.
- ^ Kos B, Vásquez JL, Miklavčič D, Hermann GG, Gehl J (2016). „Vyšetřování mechanismů působení, které stojí za správou elektromotorických léčiv (EMDA)“. PeerJ. 4 (e2309): e2309. doi:10,7717 / peerj.2309. PMC 5012313. PMID 27635313.
- ^ Bahouth Z, Halachmi S, Moskovitz B, Nativ O (2016). „Úloha hypertermie jako léčby mimosvalového invazivního karcinomu močového měchýře“. Odborná recenze protinádorové terapie. 16 (2): 189–98. doi:10.1586/14737140.2016.1126515. PMID 26618756. S2CID 681090.
- ^ Alexandroff AB, Jackson AM, O'Donnell MA, James K (květen 1999). „BCG imunoterapie rakoviny močového měchýře: po 20 letech“. Lanceta. 353 (9165): 1689–94. doi:10.1016 / S0140-6736 (98) 07422-4. PMID 10335805. S2CID 19355109.
- ^ Lamm DL, Blumenstein BA, Crawford ED, Montie JE, Scardino P, Grossman HB a kol. (Říjen 1991). „Randomizovaná studie intravezikálního doxorubicinu a imunoterapie bacilem Calmette-Guérin pro karcinom močového měchýře z přechodných buněk“. The New England Journal of Medicine. 325 (17): 1205–9. doi:10.1056 / NEJM199110243251703. PMID 1922207.
- ^ Kuroda K, Brown EJ, Telle WB, Russell DG, Ratliff TL (leden 1993). "Charakterizace internalizace bacilu Calmette-Guerin lidskými nádorovými buňkami močového měchýře". The Journal of Clinical Investigation. 91 (1): 69–76. doi:10.1172 / JCI116202. PMC 329996. PMID 8423234.
- ^ Ratliff TL, Ritchey JK, Yuan JJ, Andriole GL, Catalona WJ (září 1993). "Podskupiny T-buněk vyžadované pro intravezikální BCG imunoterapii pro rakovinu močového měchýře". The Journal of Urology. 150 (3): 1018–23. doi:10.1016 / s0022-5347 (17) 35678-1. PMID 8102183.
- ^ Fuge O, Vasdev N, Allchorne P, Green JS (2015). "Imunoterapie pro rakovinu močového měchýře". Výzkum a zprávy v urologii. 7: 65–79. doi:10.2147 / RRU.S63447. PMC 4427258. PMID 26000263.
- ^ A b C d Kamat AM, Flaig TW, Grossman HB, Konety B, Lamm D, O'Donnell MA a kol. (Duben 2015). „Dokument konsensu odborníků: Prohlášení o konsensu o řízení osvědčených postupů ohledně použití intravezikální imunoterapie s BCG pro rakovinu močového měchýře“. Recenze přírody. Urologie. 12 (4): 225–35. doi:10.1038 / nrurol.2015.58. PMID 25800393.
- ^ Alhunaidi O, Zlotta AR (2019). „Použití intravezikálního BCG u uroteliálního karcinomu močového měchýře“. ecancermedicalscience. 13: 905. doi:10,3332 / ecancer.2019,905. PMC 6411413. PMID 30915163.
- ^ D'Andrea D, Gontero P, Shariat SF, Soria F (únor 2019). „Intravezikální bacil Calmette-Guérin pro rakovinu močového měchýře: jsou všechny kmeny stejné?“. Překladová andrologie a urologie. 8 (1): 85–93. doi:10.21037 / tau.2018.08.19. PMC 6414340. PMID 30976572.
- ^ Macleod LC, Ngo TC, Gonzalgo ML (červenec 2014). "Komplikace intravezikálního bacilu calmette-guérin". Kanadský deník urologické asociace. 8 (7–8): E540-4. doi:10,5489 / cuaj.1411. PMC 4137021. PMID 25210559.
- ^ Shah S, Carter-Monroe N, Atta MG (říjen 2015). „Granulomatózní intersticiální nefritida“. Klinický ledvinový deník. 8 (5): 516–23. doi:10.1093 / ckj / sfv053. PMC 4581373. PMID 26413275.
- ^ Decaestecker K, Oosterlinck W (2015). „Zvládání nežádoucích účinků intravezikální léčby bacilem Calmette-Guérin“. Výzkum a zprávy v urologii. 7: 157–63. doi:10.2147 / RRU.S63448. PMC 4630183. PMID 26605208.
- ^ Witjes JA (květen 2006). „Řízení selhání BCG u povrchové rakoviny močového měchýře: přehled“. Evropská urologie. 49 (5): 790–7. doi:10.1016 / j.eururo.2006.01.017. PMID 16464532.
- ^ Babjuk W, Oosterlinck W, Sylvester R a kol. (2010). „Pokyny k TaT1 (nesvalové invazivní) rakovině močového měchýře“. Evropská urologická asociace. Archivováno z původního dne 24. dubna 2010.
- ^ Panel aktualizace klinických pokynů pro léčbu rakoviny močového měchýře (2007). Rakovina močového měchýře: Směrnice pro zvládání nonmuskulárního invazivního rakoviny močového měchýře: (Fáze Ta, T1 a Tis): Aktualizace z roku 2007. Americká urologická asociace.[stránka potřebná ]
- ^ Hassler MR, Shariat SF, Soria F (květen 2019). "Zachránit terapeutické strategie pro selhání bacilu Calmette-Guerin". Současný názor v urologii. 29 (3): 239–246. doi:10.1097 / MOU.0000000000000593. PMID 30762670. S2CID 73439134.
- ^ A b C d „Léčba nemetastatického svalu invazivního karcinomu močového měchýře: směrnice AUA / ASCO / ASTRO / SUO (2017) - Americká urologická asociace“. www.auanet.org. Citováno 20. listopadu 2019.
- ^ Johar RS, Hayn MH, Stegemann AP, Ahmed K, Agarwal P, Balbay MD a kol. (Červenec 2013). „Komplikace po robotické radikální cystektomii: výsledky Mezinárodního konsorcia robotické cystektomie“. Evropská urologie. 64 (1): 52–7. doi:10.1016 / j.eururo.2013.01.010. PMID 23380164.
- ^ Shabsigh A, Korets R, Vora KC, Brooks CM, Cronin AM, Savage C a kol. (Leden 2009). „Definování časné morbidity radikální cystektomie u pacientů s rakovinou močového měchýře pomocí standardizované metodiky hlášení“. Evropská urologie. 55 (1): 164–74. doi:10.1016 / j.eururo.2008.07.031. PMID 18675501.
- ^ Moschini M, Simone G, Stenzl A, Gill IS, Catto J (duben 2016). „Kritický přehled výsledků radikální cystektomie: Lze komplikace z radikální cystektomie snížit chirurgickým objemem a robotickou chirurgií?“. Evropské urologické zaměření. 2 (1): 19–29. doi:10.1016 / j.euf.2016.03.001. PMID 28723446.
- ^ Cerantola Y, Valerio M, Persson B, Jichlinski P, Ljungqvist O, Hubner M a kol. (Prosinec 2013). „Pokyny pro perioperační péči po radikální cystektomii pro rakovinu močového měchýře: doporučení společnosti pro zotavení po chirurgickém zákroku (ERAS (®))“. Klinická výživa. 32 (6): 879–87. doi:10.1016 / j.clnu.2013.09.014. PMID 24189391.
- ^ „UpToDate: Neoadjuvantní chemoterapie“. www.uptodate.com.
- ^ Vale, C. (červen 2003). „Neoadjuvantní chemoterapie u invazivního karcinomu močového měchýře: systematický přehled a metaanalýza“. Lanceta. 361 (9373): 1927–34. doi:10.1016 / s0140-6736 (03) 13580-5. PMID 12801735. S2CID 29233494.
- ^ Pokročilá spolupráce v oblasti metaanalýzy u rakoviny močového měchýře (ABC) (srpen 2005). „Neoadjuvantní chemoterapie u invazivního karcinomu močového měchýře: aktualizace systematického přehledu a metaanalýza údajů o individuálních pacientech s metaanalýzou pokročilého karcinomu močového měchýře (ABC)“. Evropská urologie. 48 (2): 202–5, diskuse 205–6. doi:10.1016 / j.eururo.2005.04.006. PMID 15939524.
- ^ Grossman HB, Natale RB, Tangen CM, Speights VO, Vogelzang NJ, Trump DL a kol. (Srpen 2003). „Neoadjuvantní chemoterapie plus cystektomie ve srovnání se samotnou cystektomií pro lokálně pokročilý karcinom močového měchýře“. The New England Journal of Medicine. 349 (9): 859–66. doi:10.1056 / NEJMoa022148. PMID 12944571.
- ^ A b Yin M, Joshi M, Meijer RP, Glantz M, Holder S, Harvey HA a kol. (Červen 2016). „Neoadjuvantní chemoterapie pro svalovou invazivní rakovinu močového měchýře: systematický přehled a dvoustupňová metaanalýza“. Onkolog. 21 (6): 708–15. doi:10.1634 / theoncologist.2015-0440. PMC 4912364. PMID 27053504.
- ^ Iwata T, Kimura S, Abufaraj M, Janisch F, Karakiewicz PI, Seebacher V a kol. (Říjen 2019). „Role adjuvantní radioterapie po operaci uroteliálního karcinomu horních a dolních močových cest: Systematický přehled“. Urologická onkologie. 37 (10): 659–671. doi:10.1016 / j.urolonc.2019.05.021. PMID 31255542.
- ^ A b C d „Režimy léčby rakoviny močového měchýře“. Poradce pro léčbu rakoviny. 1. ledna 2019. Citováno 26. listopadu 2019.
- ^ „UpToDate“. www.uptodate.com. Citováno 26. listopadu 2019.
- ^ A b C Ploussard G, Daneshmand S, Efstathiou JA, Herr HW, James ND, Rödel CM a kol. (Červenec 2014). „Kritická analýza šetřící močový měchýř s trimodální terapií u svalové invazivní rakoviny močového měchýře: systematický přehled“. Evropská urologie. 66 (1): 120–37. doi:10.1016 / j.eururo.2014.02.038. PMID 24613684.
- ^ Smelser WW, Austenfeld MA, Holzbeierlein JM, Lee EK. Kde jsme v roce 2017 se zachováním močového měchýře pro invazivní rakovinu močového měchýře ?. Indian J Urol 2017; 33: 111–7 http://www.indianjurol.com/text.asp?2017/33/2/111/203415 Archivováno 10. září 2017 v Wayback Machine
- ^ Mirza A, Choudhury A (duben 2016). "Zachování močového měchýře pro invazivní rakovinu močového měchýře". Rakovina močového měchýře. 2 (2): 151–163. doi:10,3233 / BLC-150025. PMC 4927909. PMID 27376137.
- ^ "Chemoterapie pro rakovinu močového měchýře". www.cancer.org. Citováno 27. listopadu 2019.
- ^ „Pokyny EAU: Svalově invazivní a metastazující rakovina močového měchýře“. Uroweb.
- ^ Galsky MD, Hahn NM, Rosenberg J, Sonpavde G, Hutson T, Oh WK a kol. (Červen 2011). "Léčba pacientů s metastatickým uroteliálním karcinomem" nevhodným "pro chemoterapii založenou na cisplatině". Journal of Clinical Oncology. 29 (17): 2432–8. doi:10.1200 / JCO.2011.34.8433. PMID 21555688. S2CID 33263969.
- ^ A b Keam B (2018). "Oddíl VI. Chemoterapie pro rakovinu močového měchýře". Rakovina močového měchýře. Akademický tisk. p. 527. ISBN 978-0-12-809939-1. Citováno 27. listopadu 2019.
- ^ Lyman GH, Dale DC, Culakova E, Poniewierski MS, Wolff DA, Kuderer NM, et al. (Říjen 2013). „Dopad faktoru stimulujícího kolonie granulocytů na intenzitu dávky chemoterapie a přežití rakoviny: systematický přehled a metaanalýza randomizovaných kontrolovaných studií“. Annals of Oncology. 24 (10): 2475–84. doi:10.1093 / annonc / mdt226. PMC 3841419. PMID 23788754.
- ^ Gilligan TD, Steele GS, Zietman AL, Kantoff PW (2003). Chemoterapie pro metastatické onemocnění.
- ^ Galsky MD, Chen GJ, Oh WK, Bellmunt J, Roth BJ, Petrioli R a kol. (Únor 2012). „Srovnávací účinnost chemoterapie na bázi cisplatiny a karboplatiny pro léčbu pokročilého uroteliálního karcinomu“. Annals of Oncology. 23 (2): 406–10. doi:10.1093 / annonc / mdr156. PMID 21543626.
- ^ Shelley MD, Cleves A, Wilt TJ, Mason MD (červenec 2011). „Chemoterapie gemcitabinem k léčbě metastatického karcinomu močového měchýře“. BJU International. 108 (2): 168–79. doi:10.1111 / j.1464-410X.2011.10341.x. PMID 21718430. S2CID 26003400.
- ^ Aapro M, Abrahamsson PA, Body JJ, Coleman RE, Colomer R, Costa L a kol. (Březen 2008). „Pokyny k používání bisfosfonátů u solidních nádorů: doporučení mezinárodní skupiny odborníků“. Annals of Oncology. 19 (3): 420–32. doi:10.1093 / annonc / mdm442. PMID 17906299.
- ^ Sridhar SS (květen 2017). "Vyvíjející se léčba pokročilého uroteliálního karcinomu". Journal of Oncology Practice. 13 (5): 309–315. doi:10.1200 / JOP.2017.022137. PMID 28489981.
- ^ Gerullis H, Wawroschek F, Köhne CH, Ecke TH (leden 2017). „Vinflunin v léčbě pokročilého uroteliálního karcinomu: klinické důkazy a zkušenosti“. Terapeutické pokroky v urologii. 9 (1): 28–35. doi:10.1177/1756287216677903. PMC 5167074. PMID 28042310.
- ^ Oing C, Rink M, Oechsle K, Seidel C, von Amsberg G, Bokemeyer C (únor 2016). „Chemoterapie druhé linie pro pokročilý a metastatický uroteliální karcinom: Vinflunin a další - komplexní přehled současné literatury“. The Journal of Urology. 195 (2): 254–63. doi:10.1016 / j.juro.2015.06.115. PMID 26410730.
- ^ Keam B (2018). "Oddíl VI. Chemoterapie pro rakovinu močového měchýře". Rakovina močového měchýře. Akademický tisk. p. 530. ISBN 978-0-12-809939-1. Citováno 27. listopadu 2019.
- ^ "Erdafitinib účinný proti pokročilé rakovině močového měchýře". Národní onkologický institut. 9. srpna 2019.
- ^ Konala VM, Adapa S, Aronow WS (únor 2019). „Imunoterapie u rakoviny močového měchýře“. American Journal of Therapeutics: 1. doi:10.1097 / MJT.0000000000000934. PMID 30839322.
- ^ Katz H, Wassie E, Alsharedi M (září 2017). „Inhibitory kontrolního bodu: nové paradigma léčby uroteliálního karcinomu močového měchýře“. Lékařská onkologie. 34 (10): 170. doi:10.1007 / s12032-017-1029-8. PMID 28864844. S2CID 22280860.
- ^ Heidenreich A, Albers P, Classen J, Graefen M, Gschwend J, Kotzerke J a kol. (2010). „Zobrazovací studie u pacientů s metastatickým urogenitálním karcinomem podstupujících systémovou terapii: doporučení multidisciplinárního konsensuálního setkání Asociace urologické onkologie Německé onkologické společnosti“. Urologia Internationalis. 85 (1): 1–10. doi:10.1159/000318985. PMID 20693823.
- ^ Llewelyn R. "Kritéria hodnocení odpovědi u solidních nádorů | Radiologický referenční článek | Radiopaedia.org". Radiopaedia.
- ^ Siddiqui MR, Grant C, Sanford T, Agarwal PK (srpen 2017). „Současné klinické studie s mimosvalovou invazivní rakovinou močového měchýře“. Urologická onkologie. 35 (8): 516–527. doi:10.1016 / j.urolonc.2017.06.043. PMC 5556973. PMID 28778250.
- ^ „Rakovina močového měchýře - statistika“. Cancer.Net. 25. června 2012.
- ^ Kaufman DS, Shipley WU, Feldman AS (červenec 2009). "Rakovina močového měchýře". Lanceta. 374 (9685): 239–49. doi:10.1016 / S0140-6736 (09) 60491-8. PMID 19520422. S2CID 40417997.
- ^ van der Heijden AG, Witjes JA (září 2009). „Recidiva, progrese a sledování u mimosvalově invazivního karcinomu močového měchýře“. Evropské urologické doplňky. 8 (7): 556–562. doi:10.1016 / j.eursup.2009.06.010.
- ^ Tyson MD, Chang SS, Keegan KA (2016). „Role konsolidační chirurgické léčby u pacientů s lokálně pokročilým nebo regionálně metastatickým karcinomem močového měchýře“. Měchýř. 3 (2). doi:10.14440 / močový měchýř.2016.89 (neaktivní 9. listopadu 2020). PMC 5336315. PMID 28261632.CS1 maint: DOI neaktivní od listopadu 2020 (odkaz)
- ^ Zhang L, Wu B, Zha Z, Qu W, Zhao H, Yuan J (červenec 2019). „Klinickopatologické faktory rakoviny močového měchýře pro výsledky přežití specifické pro rakovinu po radikální cystektomii: systematický přehled a metaanalýza“. Rakovina BMC. 19 (1): 716. doi:10.1186 / s12885-019-5924-6. PMC 6642549. PMID 31324162.
- ^ Ku JH, Kang M, Kim HS, Jeong CW, Kwak C, Kim HH (červen 2015). „Hustota lymfatických uzlin jako prognostická proměnná u karcinomu močového měchýře pozitivního na uzliny: metaanalýza“. Rakovina BMC. 15: 447. doi:10.1186 / s12885-015-1448-x. PMC 4450458. PMID 26027955.
- ^ Yang LS, Shan BL, Shan LL, Chin P, Murray S, Ahmadi N, Saxena A (září 2016). „Systematický přehled a metaanalýza výsledků kvality života po radikální cystektomii pro rakovinu močového měchýře“. Chirurgická onkologie. 25 (3): 281–97. doi:10.1016 / j.suronc.2016.05.027. PMID 27566035.
- ^ Somani BK, Gimlin D, Fayers P, N'dow J (listopad 2009). „Kvalita života a obraz těla u pacientů s rakovinou močového měchýře podstupujících radikální cystektomii a odklon moči - prospektivní kohortní studie se systematickým přehledem literatury“. Urologie. 74 (5): 1138–43. doi:10.1016 / j.urology.2009.05.087. PMID 19773042.
- ^ Vartolomei L, Ferro M, Mirone V, Shariat SF, Vartolomei MD (červenec 2018). "Systematický přehled: Deprese a prevalence úzkosti u pacientů s rakovinou močového měchýře". Rakovina močového měchýře. 4 (3): 319–326. doi:10,3233 / BLC-180181. PMC 6087432. PMID 30112443.
- ^ David E (únor 2017). „Psychiatrické poruchy zhoršují přežití rakoviny močového měchýře“. www.healio.com. Citováno 27. listopadu 2019.
- ^ Correa AF, Smaldone MC (srpen 2018). „Melancholie a rakovina: příběh o rakovině močového měchýře“. Rakovina. 124 (15): 3080–3083. doi:10.1002 / cncr.31402. PMID 29660788.
- ^ "Statistika rakoviny močového měchýře". Světový fond pro výzkum rakoviny. 22. srpna 2018. Citováno 9. listopadu 2019.
- ^ „Informační přehled Řecka“ (PDF). Globální observatoř proti rakovině. Citováno 9. listopadu 2019.
- ^ „Odhady WHO pro nemoci a zranění“. Světová zdravotnická organizace. 2009. Archivováno z původního dne 11. listopadu 2009. Citováno 11. listopadu 2009.
- ^ Roth, Gregory A .; Abate, Degu; Abate, Kalkidan Hassen; Abay, Solomon M .; Abbafati, Cristiana; Abbasi, Nooshin; Abbastabar, Hedayat; Abd-Allah, Foad; Abdela, Jemal; Abdelalim, Ahmed; Abdollahpour, Ibrahim; Abdulkader, Rizwan Suliankatchi; Abebe, Haftom Temesgen; Abebe, Molla; Abebe, Zegeye; Abejie, Ayenew Negesse; Abera, Semaw F .; Abil, Olifan Zewdie; Abraha, Haftom Niguse; Abrham, Aklilu Roba; Abu-Raddad, Laith Jamal; Accrombessi, Manfred Mario Kokou; Acharya, Dilaram; Adamu, Abdu A .; Adebayo, Oladimeji M .; Adedoyin, Rufus Adesoji; Adekanmbi, Victor; Adetokunboh, Olatunji O .; Adhena, Beyene Meressa; et al. (Listopad 2018). „Globální, regionální a národní úmrtnost podle věku a pohlaví na 282 příčin úmrtí ve 195 zemích a teritoriích, 1980–2017: systematická analýza studie Global Burden of Disease Study 2017“. Lanceta. 392 (10159): 1736–1788. doi:10.1016 / S0140-6736 (18) 32203-7. PMC 6227606. PMID 30496103.
- ^ Lakkis NA, Adib SM, Hamadeh GN, El-Jarrah RT, Osman MH (2018). „Rakovina močového měchýře v Libanonu: Incidence a srovnání s regionálními a západními zeměmi“. Kontrola rakoviny. 25 (1): 1073274818789359. doi:10.1177/1073274818789359. PMC 6055109. PMID 30027755.
- ^ A b Hemelt M, Yamamoto H, Cheng KK, poslanec Zeegers (leden 2009). „Vliv kouření na mužský přebytek rakoviny močového měchýře: metaanalýza a geografické analýzy“. International Journal of Cancer. 124 (2): 412–9. doi:10.1002 / ijc.23856. PMID 18792102. S2CID 28518800.
- ^ „Vědci najdou jeden důvod, proč rakovina močového měchýře zasahuje více mužů“. Lékařské centrum University of Rochester. 20. dubna 2007. Archivovány od originál dne 11. ledna 2009. Citováno 20. dubna 2007.
- ^ Kim A, Kim MS, Ahn JH, Choi WS, Park HK, Kim HG, Paick SH (listopad 2019). „Klinický význam léčby inhibitorem 5-α reduktázy a androgenní deprivací při incidenci, recidivě a přežití rakoviny močového měchýře: metaanalýza a systémový přehled“. Stárnoucí muž: 1–8. doi:10.1080/13685538.2019.1646238. PMID 31724468.
- ^ „Informační list o Kanadě“ (PDF). Globální observatoř proti rakovině. Citováno 9. listopadu 2019.
- ^ A b „Statistiky rakoviny močového měchýře - Kanadská rakovinová společnost“. www.cancer.ca. Citováno 2. prosince 2019.
- ^ „Informační list o Číně“ (PDF). Globální observatoř proti rakovině. Citováno 9. listopadu 2019.
- ^ Pang C, Guan Y, Li H, Chen W, Zhu G (červen 2016). „Urologická rakovina v Číně“. Japonský žurnál klinické onkologie. 46 (6): 497–501. doi:10.1093 / jjco / hyw034. PMID 27049022.
- ^ tým, FPFIS (8. března 2017). „Epidemiologie rakoviny močového měchýře v Evropě“. Centrum vědy EU - Evropská komise. Citováno 2. prosince 2019.
- ^ „Britský informační list“ (PDF). Globální observatoř proti rakovině. Citováno 9. listopadu 2019.
- ^ Ward EM, Sherman RL, Henley SJ, Jemal A, Siegel DA, Feuer EJ a kol. (Prosinec 2019). „Výroční zpráva národu o stavu rakoviny s rakovinou u mužů a žen ve věku 20–49 let“. Journal of the National Cancer Institute. 111 (12): 1279–1297. doi:10.1093 / jnci / djz106. PMC 6910179. PMID 31145458.
- ^ „Klíčové statistiky pro rakovinu močového měchýře“. www.cancer.org. Citováno 28. listopadu 2019.
- ^ „Běžné stránky o rakovině - fakta o rakovině“. SEER. Citováno 28. listopadu 2019.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
- Rakovina močového měchýře na Curlie
- Klinicky přezkoumáno informace o rakovině močového měchýře pro pacienty od Cancer Research UK
- Cancer.Net: Rakovina močového měchýře
- EORTC kalkulačka pro stratifikaci rizika rakoviny močového měchýře mimo sval
