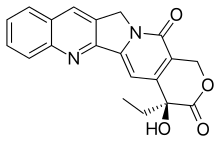
Kamptotecin - Camptothecin
 | |
| Klinické údaje | |
|---|---|
| ATC kód |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.113.172 |
| Chemické a fyzikální údaje | |
| Vzorec | C20H16N2Ó4 |
| Molární hmotnost | 348.358 g · mol−1 |
| 3D model (JSmol ) | |
| Bod tání | 275 až 277 ° C (527 až 531 ° F) |
| |
| |
| (ověřit) | |
Kamptothecin (CPT) je jed topoizomerázy. To bylo objeveno v roce 1966 M. E. Wall a M. C. Wani při systematickém screeningu přírodní produkty pro rakovinu léky. Byl izolován od kůra a zastavit z Camptotheca acuminata (Camptotheca, šťastný strom), a strom původem z Čína používá se jako léčba rakoviny v tradiční čínská medicína.[1][2] V poslední době se v Číně klinicky používá k léčbě gastrointestinálních nádorů.[3]CPT předběžně vykazoval pozoruhodnou protirakovinnou aktivitu klinické testy zejména proti rakovině prsu, vaječníků, tlustého střeva, plic a žaludku[4] Má však nízkou hodnotu rozpustnost a při terapeutickém použití byly hlášeny nežádoucí účinky,[5] takže syntetičtí a léčiví chemici vyvinuli řadu syntéz kamptotecinu[6][7][8] a různé deriváty ke zvýšení výhod systému chemikálie, s dobrými výsledky. Čtyři CPT analogy byly schváleny a jsou používány v rakovina chemoterapie[9] dnes, topotekan, irinotekan, belotecan, a trastuzumab deruxtecan.[10][11] Kamptothecin byl také nalezen v jiných rostlinách včetně Chonemorpha fragrans.[12] Kromě toho, že je protinádorovým činidlem, prokázal kamptothecin také aktivitu proti HIV, protože přerušuje samo-asociaci faktoru virové infekčnosti nalezeného v mnoha retrovirech včetně HIV[13]
Struktury
CPT má rovinný pentacyklický kruh struktura, který zahrnuje a pyrrolo [3,4-p] -chinolinová skupina (kruhy A, B a C), konjugované pyridon skupina (kruh D) a jedna chirální střed v poloze 20 uvnitř alfa-hydroxy lakton zazvonit s (S) konfigurace (E-kroužek). Jeho planární struktura je považována za jeden z nejdůležitějších faktorů inhibice topoizomerázy.[14][15]

Vazba
CPT se váže na topoizomerázu I a komplex DNA (kovalentní komplex), což vede k ternárnímu komplexu a tím jej stabilizuje. Tím se zabrání opětovnému ligaci DNA, a proto se způsobí poškození DNA apoptóza.[16]CPT se váže jak na enzym, tak na DNA s Vodíkové vazby. Nejdůležitější částí struktury je E-kruh, který interaguje s enzymem ze tří různých pozic. Hydroxylová skupina v poloze 20 tvoří vodíkovou vazbu na postranním řetězci kyselina asparagová číslo 533 (Asp533) v enzymu. Je velmi důležité, aby konfigurace chirál uhlík je (S), protože (R) je neaktivní. Lakton je vázán dvěma vodíkovými vazbami k amino skupiny na arginin 364 (Arg364). D-kroužek interaguje s +1 cytosin na neštěpeném řetězci a stabilizuje kovalentní komplex topoizomerázy I-DNA tvorbou vodíkové vazby. Tato vodíková vazba je mezi karbonyl skupina v poloze 17 na D-kruhu a aminoskupina na pyrimidin kruh +1 cytosinu.[17][18] CPT je selektivně cytotoxický vůči buňkám replikujícím DNA během S fáze [19] a jeho toxicita je primárně výsledkem přeměny jednořetězcových zlomů na dvouřetězcové zlomení, když replikační vidlice narazí na štěpné komplexy tvořené DNA a CPT.[20]
Chemie
Laktonový kruh v CPT je vysoce citlivý na hydrolýza. Forma otevřeného kruhu je neaktivní, a proto musí být uzavřena, aby inhibovala topoizomerázu I. Uzavřená forma je upřednostňována v kyselém stavu, jako je tomu u mnoha rakoviny buňky mikroprostředí. CPT je transportován do buňky pomocí pasivní difúze. Příjem buněk zvýhodňuje lipofilita, což zvyšuje intracelulární akumulace. lipofilita dělá sloučeniny stabilnější kvůli lepšímu rozdělení laktonu na červené krvinky a v důsledku toho menší hydrolýza laktonu. CPT má afinitu k lidskému sérovému albuminu (HSA), zejména ke karboxylátové formě CPT. Z tohoto důvodu rovnováha mezi laktonovým kruhem a karboxylátovou formou je řízen směrem ke karboxylátu. Snížený lék-HSA interakce může vést ke zlepšení aktivity.[17][21]
Vztah struktura-aktivita

Studie to ukázaly substituce v pozicích 7, 9, 10 a 11 mohou mít pozitivní vliv na aktivitu CPT a fyzikální vlastnosti, např. účinnost a metabolická stabilita. Zvětšení laktonového kruhu o jednu CH
2 jednotka také zvyšuje jeho schopnosti, jako v homocamptothecinu. Střídání na pozicích 12 a 14 vede k neaktivnímu derivátu.[21]
Modifikace A- a B-kroužku
Alkylová substituce
Alkyl substituce v poloze 7 prokázala zvýšenou cytotoxicitu, jako např ethyl (C2H5) nebo chlormethyl (CH2Cl). Tyto skupiny jsou schopné reagovat s DNA v přítomnosti topoizomerázy I, což vede k dalším nádor aktivita. Rovněž bylo prokázáno, že prodloužení délky uhlíkového řetězce (v poloze 7) vede ke zvýšené lipofilitě a v důsledku toho k vyšší účinnosti a stabilitě u lidí plazma.[17][21]Dalšími 7-modifikovanými analogy CPT jsou silatekany a kareniteciny. Jsou silnými inhibitory topoizomerázy I a oba mají v poloze 7 alkylsilylové skupiny, díky nimž jsou lipofilní a stabilnější. Silatecany nebo 7-silylcampthotheciny prokázaly snížené interakce lék-HSA, což přispívá k jeho stabilitě v krvi a mohou také procházet hematoencefalická bariéra. DB-67 je 10-hydroxyderivát a patří mezi nejaktivnější silatany. BNP1350, který patří do řady karenitecinů, vykazuje cytotoxickou aktivitu a schopnost překonávat odolnost vůči lékům. Ještě dalším způsobem, jak učinit CPT lipofilní, je zavedení lipofilních substituentů, jako jsou iminomethylové nebo oxyiminomethylové skupiny. Jednou z nejúčinnějších sloučenin je oxyiminomethylderivát ST1481, který má tu výhodu, že překonává rezistenci na léky způsobenou transportními systémy.[21]Základní dusík v uhlíkovém řetězci v poloze 7 činí sloučeninu více hydrofilní a tudíž rozpustnější ve vodě. Například je to derivát s názvem CKD-602, který je silným inhibitorem topoizomerázy I a úspěšně překonává špatnou rozpustnost ve vodě a toxicitu pozorovanou u CPT.[21][22]
Podstatně větší aktivity lze dosáhnout tím, že se vytvoří skupiny přitahující elektrony, jako je amino, nitro, brom nebo chlor v poloze 9 a 10 a hydroxylová skupina v poloze 10 nebo 11. Ale tyto sloučeniny jsou relativně nerozpustné ve vodných roztocích, což způsobuje potíže při podávání. Methoxy skupina na obou pozicích 10 a 11 současně vede k nečinnosti.[14][21]
Hexacyklické analogy CPT
Hexacyklické analogy CPT prokázaly velkou účinnost. Například, methylenedioxy nebo ethylendioxyskupina připojená mezi 10 a 11 tvoří 5 nebo 6 členný kruh, což vede k více ve vodě rozpustným derivátům a zvýšené účinnosti. Výzkumy ukázaly, že ethylendioxy analogy jsou méně účinné než methylendioxy. Důvodem jsou nepříznivé stérické interakce ethylendioxy analogů s enzymem.[14][21]
Přidání aminoskupiny nebo chloroskupiny v 9. poloze nebo chlormethylové skupiny v 7. poloze k těmto 10, 11-methylendioxy nebo ethylendioxy analogům vede ke sloučeninám s ještě větší cytotoxicitou, ale slabší rozpustností ve vodě. Pro získání 10, 11-methylendioxy nebo ethylendioxy analogů s dobrou rozpustností ve vodě je dobrým způsobem zavedení substituentu solubilizujícího vodu v poloze 7. Lurtotecan splňuje tyto požadavky; je to analog 10, 11-ethylendioxy s 4-methylpiperazino-methylenem v poloze 7 a prokázal velkou účinnost v klinických výzkumech.[14]
Lze také vytvořit prstenec mezi pozicí 7 a 9, jako pozice 10 a 11. To dává nové příležitosti k výrobě derivátů rozpustných ve vodě [5]. Tyto hexacyklické CPT se stávají aktivnějšími, když jsou skupiny přitahující elektrony umístěny do polohy 11 a methylové nebo aminoskupiny na 10. Exatecan je příkladem hexacyklického CPT, který má šestičlenný kruh nad pozicemi 7 a 9 a je 10-methyl, 11 -fluor substituovaný [4]. Je rozpustný ve vodě a účinnější než topotekan.[14][21][23]
Modifikace C- a D-kroužku
C- a D-kroužky mají zásadní roli v protinádorové aktivitě. Nahrazení v jakékoli poloze má za následek mnohem méně účinnou sloučeninu než mateřská sloučenina v jiném testu cytotoxicity.[14]

Úpravy E-kroužku
E-kroužek neumožňuje mnoho strukturálních změn bez ztráty aktivity CPT, protože je nezbytný pro navázání na aktivní místo TOP I.[24] Jednou z možných náhrad je změna hydroxylové skupiny na Cl, F nebo Br, protože jejich polarizovatelnost je dostatečný ke stabilizaci enzymového komplexu.[21]
Další možnou modifikací je vložení methylenu mezi hydroxyl a lakton na E-kruh, čímž se získá sedmičlenná β-hydroxylaktonová skupina, takzvaný homocamptothecin (hCPT). Hydroxylová skupina hCPT má méně indukční účinek na karboxylové skupině, díky níž je lakton velmi reaktivní. To optimálně zvyšuje interakci volné hydroxylové skupiny s topoizomerázou I a kovalentní komplex, který se tvoří v její přítomnosti, je stabilnější. E-kroužek hCPT se otevírá pomaleji a otevírání je nevratný. hCPT vykazují zvýšenou stabilitu lidské plazmy kvůli snížení protein vazba a větší afinita k červeným krvinkám než CPT.[14][21]
CPT analogy
Od objevu CPT bylo syntetizováno mnoho analogů. Níže je uveden schematický pohled na analogy CPT, které byly zmíněny ve výše uvedeném textu.
 | ||||
| Analog | R1 | R2 | R3 | R4 |
| Topotekan | —H |  | -ACH | —H |
| Irinotekan (CPT-11) | —H | 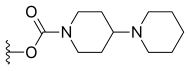 | —H | |
| Silatecan (DB-67, AR-67) | 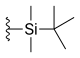 | —H | -ACH | —H |
| Cositecan (BNP-1350) |  | —H | —H | —H |
| Exatecan |  | —CH3 | -F | |
| Lurtotekan |  | —H |  | |
| Gimatecan (ST1481) |  | —H | —H | —H |
| Belotecan (CKD-602) |  | —H | —H | —H |
| Rubitecan | —H | 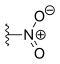 | —H | —H |
CPT je spojen s a cyklodextrin polymer na bázi pro přípravu zkoumaného protinádorového léčiva CRLX101.[25]
Biosyntéza



Stejně jako všechny ostatní monoterpenoidové indol-alkaloidy vyžaduje biosyntéza kamptothecinu produkci strictosidinu. Strictosidin je syntetizován kondenzační reakcí mezi trypaminem ze shikimátové dráhy a secologaninem buď z mevalonátové (MVA) dráhy nebo z nemevalonátové dráhy (MEP).[26] Strictosidin poté prochází intermolekulární cyklizací za vzniku strictosamidu, který je konvertován na kamptothecin řadou oxidačních reakcí pomocí enzymů, které je ještě třeba vyřešit.[27]
Cesta shikimate vedoucí k biosyntéze tryptaminu je většinou pochopena. Nejprve je chorismát přeměněn na antranilát alfa-podjednotkou antranilátové syntázy (ASA). Anthranilát reaguje s 5-fosforibospyrofosfátem za vzniku 5-fosforibosylanthranilátu. Poté se tento meziprodukt převede na indolglycerolfosfát, který interaguje s alfa podjednotkou tryptofanové (TSA) syntázy za vzniku indolu. Beta-podjednotka tryptofan syntázy (TSB) katalyzuje kondenzaci indolu se serinem, což vede k tryptofanu. V dalším kroku se tryptoamin vyrábí jako výsledek dekarboxylace tryptofan dekarboxylázou (TDC).[28]
Syntéza secologaninu začíná kondenzační reakcí mezi pyruvátem a D-glyceraldehyd-3-fosfátem katalyzovanou 1-deoxy-D-xylulóza-5-fosfát syntázou (DXS) za vzniku 1-deoxy-D-xyulóza-5-fosfátu (DXP). Konverze DXP na isopentenyldifosfát (IPP), který je běžným prekurzorem biosyntézy terpenoidů, zahrnuje 1-deoxy-D-xylulóza-5-fosfátreduktoizomerázu (DXR) a 1-hydroxy-2-methyl-2 (E) -butenyl- 4-difosfátreduktáza (HDR). Tvorby IPP lze dosáhnout jak cestou MVA, tak cestou MEP.[29] Kondenzací IPP a dimethylallyldifosfátu (DMAPP) se získá geranyldifosfát (GPP). Geraniol syntáza (GS) poté převádí GPP na geraniol.[26] K přeměně geraniolu na sekologanin dochází různými enzymatickými reakcemi. Na základě studií s radioaktivním značením a inhibitory specifickými pro dráhu je dráha MEP primárním zdrojem secologaninu.[30]
Tryptamin ze shikimátové dráhy a secologanin z MVA nebo MEP dráhy se převádějí na striktosidin kondenzační reakcí katalyzovanou striktosidinsyntázou. Ačkoli to není zcela vyřešeno, předpokládá se, že kamptothecin se vyrábí z strictosidinu přes strictosamid, 3 (S) -pumilosid a 3 (S) -deoxypumilosid.[27]
Reference
- ^ Govindachari TR, Viswnathan N (1972). "kmenová kůra Mappia foetida, strom původem z Indie, se ukázal být dalším zdrojem významným pro izolaci kamptothecinu “. Fytochemie. 11 (12): 3529–31. doi:10.1016 / s0031-9422 (00) 89852-0.
- ^ Efferth T, Fu YJ, Zu YG, Schwarz G, Konkimalla VS, Wink M (2007). „Molekulární terčem řízená léčba nádorů přírodními produkty pocházejícími z tradiční čínské medicíny“. Současná léčivá chemie. 14 (19): 2024–32. doi:10.2174/092986707781368441. PMID 17691944.
- ^ "Chemnetbase - Dictionary of Drug - Camptothecin".
- ^ Wang, Xian H. „Návrh, syntéza a hodnocení biologické aktivity konjugátů kampthothecin-HAA-norcantharidin jako protinádorových látek in vitro“. Chemická biologie a design léčiv.
- ^ "Chemnetbase - Dictionary of Drug - Camptothecin".
- ^ "Curranova syntéza kamptothecinu". Archivovány od originál dne 2009-09-05.
- ^ "Comins Syntéza kamptothecinu". Archivovány od originál dne 2009-09-05.
- ^ "Rapaportova syntéza kamptothecinu".[trvalý mrtvý odkaz ]
- ^ Takimoto CH, Calvo E. "Principy onkologické farmakoterapie" v Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (eds.) Management rakoviny: Multidisciplinární přístup. 11 vyd. 2008.
- ^ ME zeď; M.C. Wani; C.E. Cook; K.H. Palmer; A.I.McPhail; GA Sim (1966). „Rostlinná protinádorová činidla. I. Izolace a struktura kamptotecinu, nové alkaloidní leukémie a inhibitoru tumoru z kamptoteka acuminátu“. Journal of the American Chemical Society. 88 (16): 3888–3890. doi:10.1021 / ja00968a057.
- ^ G. Samuelsson (2004). Drogy přírodního původu: učebnice farmakognosie (5 ed.). Stokkholm: švédský farmaceutický tisk. ISBN 91-974318-4-2.
- ^ Isah, Tasiu; Umar, Shahid (září 2018). „Ovlivňování in vitro klonální propagace Chonemorpha fragrans (měsíc) Alston silou kultivačního média, regulátory růstu rostlin, zdrojem uhlíku a periodickou inkubací fotografií“. Journal of Forestry Research. doi:10.1007 / s11676-018-0794-3.
- ^ Bennett, Ryan P. „Deriváty kamptothecinu jako látky proti HIV a metody identifikace látek, které narušují vlastní asociaci Vif“.
- ^ A b C d E F G H. Ulukan; P.W. Swaan (2002). „Camptotheciny, přehled jejich chemoterapeutického potenciálu“. Drogy (27 ed.). 62 (2): 2039–2057. doi:10.2165/00003495-200262140-00004. PMID 12269849.
- ^ A. J. Lu; Z. S. Zhang; M. Y. Zheng; H. J. Zou; X. M. Luo; H. L. Jiang (2007). „3D-QSAR studie 20 (S) -kamptotecinových analogů“. Acta Pharmacologica Sinica. 28 (2): 307–314. doi:10.1111 / j.1745-7254.2007.00477.x. PMID 17241535.
- ^ "Kamptotecin". DrugBank. Citováno 9. října 2016.
- ^ A b C D. J. Adams; M. L. Wahl; J. L. Květiny; B. Sen; M. Colvin; M. W. Dewhirst; G. Manikumar; M. C. Wani (2005). „Analogy kamptothecinu se zvýšenou aktivitou proti buňkám lidské rakoviny prsu. II. Dopad gradientu pH nádoru“. Chemoterapie rakoviny a farmakologie. 57 (2): 145–154. doi:10.1007 / s00280-005-0008-5. PMID 16001167.
- ^ M. R. Redinbo; L. Stewart; P. Kuhn; J. J. Champoux; W. G. J. Hol (1998). "Krystalová struktura lidské topoizomerázy I v kovalentních a nekovalentních komplexech s DNA". Věda. 279 (5356): 1504–1513. Bibcode:1998Sci ... 279.1504R. doi:10.1126 / science.279.5356.1504. PMID 9488644.
- ^ Del Bino G, Lassota P, Darzynkiewicz Z (1991). "S-fázová cytotoxicita kamptothecinu". Experimentální výzkum buněk. 193 (1): 27–35. doi:10.1016/0014-4827(91)90534-2. PMID 1995300.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Y. Pommier; C. Redon; V.A. Rao; J.A. Seiler; O. Sordet; H. Takemura; S. Antony; L. Meng; Z.Liao; G. Kohlhagen (2003). „Oprava a reakce kontrolního bodu na poškození DNA zprostředkované topoizomerázou I“. Mutační výzkum. 532 (1–2): 173–203. doi:10.1016 / j.mrfmmm.2003.08.016. PMID 14643436.
- ^ A b C d E F G h i j F. Zunino; S. Dallavalle; D. Laccabue; G. Beretta; L. Merlini; G. Pratesi (2002). "Současný stav a perspektivy vývoje kamptothecinů". Současný farmaceutický design (27 ed.). 8 (27): 2505–2520. doi:10.2174/1381612023392801. PMID 12369944.
- ^ M. K. Chung; S. S. Han; J. C. Kim (2006). "Hodnocení toxických potenciálů nového kamptotecinového protirakovinného činidla CKD-602 na plodnost a časný embryonální vývoj u potkanů". Regulační toxikologie a farmakologie. 45 (3): 273–281. doi:10.1016 / j.yrtph.2006.05.004. PMID 16814440.
- ^ M. Palumbo; C. Sissi; B. Gatto; S. Moro; G. Zagotto (2001). "Kvantifikace kamptothecinu a příbuzných sloučenin". Journal of Chromatography B. 764 (1–2): 121–40. doi:10.1016 / S0378-4347 (01) 00345-0. PMID 11817024.
- ^ Venditto, Vincent J .; Simanek, Eric E. (03.03.2010). „Terapie rakoviny využívající kamptoteciny: přehled literatury o Vivo“. Molekulární farmaceutika. 7 (2): 307–349. doi:10,1021 / mp900243b. ISSN 1543-8384. PMC 3733266. PMID 20108971.
- ^ „Cerulean získává 24 mil. USD na pokrok v klinickém vývoji nanofarmaceutik“. 15. listopadu 2010.
- ^ A b Yamazaki, Yasuyo; Kitajima, Mariko; Arita, Masanori; Takayama, Hiromitsu; Sudo, Hiroši; Yamazaki, Mami; Aimi, Norio; Saito, Kazuki (2004). "Biosyntéza kamptothecinu. In Silico a in Vivo Tracer Study z [1-13C] glukózy". Fyziologie rostlin. 134 (1): 161–170. doi:10.1104 / pp.103.029389. ISSN 0032-0889.
- ^ A b Lorence, Argelia; Nessler, Craig L. (2004). „Kamptotecin, více než čtyři desetiletí překvapivých zjištění“. Fytochemie. 65 (20): 2735–2749. doi:10.1016 / j.phytochem.2004.09.001. ISSN 0031-9422.
- ^ Nové světlo na biosyntézu alkaloidů a budoucí vyhlídky. Akademický tisk. 27. července 2013. str. 143–149. ISBN 978-0-08-099411-6.
- ^ Nové světlo na biosyntézu alkaloidů a budoucí vyhlídky. Akademický tisk. 27. července 2013. str. 143–149. ISBN 978-0-08-099411-6.
- ^ Nové světlo na biosyntézu alkaloidů a budoucí vyhlídky. Akademický tisk. 27. července 2013. str. 143–149. ISBN 978-0-08-099411-6.
