Gemcitabin - Gemcitabine
 | |
 | |
| Klinické údaje | |
|---|---|
| Výslovnost | /dʒɛmˈsaɪtəbiːn/ |
| Obchodní názvy | Gemzar, další[1] |
| Ostatní jména | 2 ', 2'-difluor-2'-deoxycytidin, dFdC |
| AHFS /Drugs.com | Monografie |
| Těhotenství kategorie |
|
| Trasy z správa | Intravenózní |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Vazba na bílkoviny | <10% |
| Odstranění poločas rozpadu | Krátké infuze: 32–94 minut Dlouhé infuze: 245–638 minut |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.124.343 |
| Chemické a fyzikální údaje | |
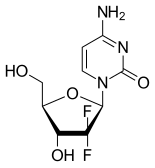
| Vzorec | C9H11F2N3Ó4 |
| Molární hmotnost | 263.201 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| (ověřit) | |
Gemcitabin, prodávané pod značkou Gemzar, mezi ostatními,[1] je chemoterapie léky používá se k léčbě řady typů rakovina.[2] Mezi tyto druhy rakoviny patří rakovina prsu, rakovina vaječníků, nemalobuněčný karcinom plic, rakovina slinivky, a rakovina močového měchýře.[2][3] Je to dáno pomalá injekce do žíly.[2]
Mezi časté nežádoucí účinky patří potlačení kostní dřeně, problémy s játry a ledvinami, nevolnost, horečka, vyrážka, dušnost, boláky v ústech, průjem, neuropatie a ztráta vlasů.[2] Používejte během těhotenství pravděpodobně povede k poškození dítěte.[2] Gemcitabin je v nukleosidový analog rodina léků.[2] Funguje tak, že blokuje vytváření nových DNA, což vede k buněčné smrti.[2]
Gemcitabin byl patentován v roce 1983 a pro lékařské použití byl schválen v roce 1995.[4] Generické verze byly představeny v Evropě v roce 2009 a v USA v roce 2010.[5][6] Je na Seznam základních léčivých přípravků Světové zdravotnické organizace.[7]
Lékařské použití
Gemcitabin se používá v různých karcinomy. Používá se jako léčba první linie samostatně pro rakovina slinivky, a v kombinaci s cisplatina pro pokročilé nebo metastatické rakovina močového měchýře a pokročilé nebo metastatické nemalobuněčný karcinom plic. Používá se jako léčba druhé linie v kombinaci s karboplatina pro rakovina vaječníků a v kombinaci s paclitaxel pro rakovina prsu který je metastatický nebo jej nelze chirurgicky odstranit.[8][9][10]
Běžně se používá off-label k léčbě cholangiokarcinom[11] a další Žlučových cest rakoviny.[12]
Podává se injekcí do žíly při a chemoterapie klinika.[2]
Kontraindikace a lékové interakce
Užívání gemcitabinu může také ovlivnit plodnost u mužů a žen, sexuální život a menstruaci. Ženy užívající gemcitabin by neměly otěhotnět a těhotné a kojící ženy by ho neměly užívat.[13]
Od roku 2014 nebyly lékové interakce studovány.[9][8]
Nepříznivé účinky
Gemcitabin je a chemoterapie droga, která funguje tak, že zabíjí všechny buňky, které se dělí.[8] Rakovinné buňky se dělí rychle, a proto jsou cíleny vyšší rychlostí gemcitabinem, ale mnoho základních buněk se dělí také rychle, včetně buněk v kůži, pokožce hlavy, výstelce žaludku a kostní dřeni, což vede k nežádoucím účinkům.[14]:265
Štítek gemcitabin nese varování, že může potlačit funkci kostní dřeně a způsobit ji ztráta bílých krvinek, ztráta krevních destiček, a ztráta červených krvinek, a že by měl být používán opatrně u lidí s jaterními, ledvinovými nebo kardiovaskulárními poruchami. Lidé, kteří ji užívají, by neměli brát živé vakcíny. Varovný štítek také uvádí, že to může způsobit syndrom zadní reverzibilní encefalopatie, že to může způsobit syndrom kapilárního úniku, že může způsobit závažné plicní stavy jako plicní otok, zápal plic, a syndrom respirační tísně dospělých a že může poškodit spermie.[8][15]
Mezi velmi časté nežádoucí účinky (u více než 10% lidí) patří potíže s dýcháním, nízký počet bílých a červených krvinek a nízký počet krevních destiček, zvracení a nevolnost, zvýšené transaminázy vyrážky a svědění kůže, vypadávání vlasů, krev a bílkoviny v moči, příznaky podobné chřipce a otok.[8][13]
Mezi běžné nežádoucí účinky (vyskytující se u 1–10% lidí) patří horečka, ztráta chuti k jídlu, bolesti hlavy, potíže se spánkem, únava, kašel, rýma, průjem, boláky v ústech a rtech, pocení, bolesti zad a bolesti svalů.[8]
Trombotická trombocytopenická purpura (TTP) je vzácný, ale závažný nežádoucí účinek, který je spojován s gemcitabinem i jinými chemoterapeutickými léky. TTP je porucha krve a může vést k mikroangipatická hemolytická anémie (MAHA), neurologické abnormality, horečka a onemocnění ledvin.[16]
Farmakologie
Gemcitabin je hydrofilní a musí být transportovány do buněk molekulárními transportéry pro nukleosidy (nejběžnější transportéry pro gemcitabin jsou SLC29A1 SLC28A1 a SLC28A3).[17][18] Po vstupu do buňky je gemcitabin nejprve upraven připojením a fosfát a tím se z něj stává gemcitabin monofosfát (dFdCMP).[17][18] To je krok určující rychlost který je katalyzován enzym deoxycytidinkináza (DCK).[17][18] Další dva fosfáty jsou přidány jinými enzymy. Po připojení tří fosfátů je gemcitabin konečně farmakologicky aktivní jako gemcitabin trifosfát (dFdCTP).[17]
Poté, co byl třikrát fosforylovaný, gemcitabin se může maskovat jako deoxycytidin trifosfát a je začleněn do nových řetězců DNA syntetizovaných jako buňka replikuje.[2][17][18]
Když je gemcitabin inkorporován do DNA, umožňuje vedle něj přidat nativní nebo normální nukleosidovou bázi. To vede k „maskovanému zakončení řetězce“, protože gemcitabin je „vadný“ základ, ale díky svému sousednímu nativnímu nukleosidu uniká normálnímu opravnému systému buňky (oprava základní excize ). Inkorporace gemcitabinu do DNA buňky tedy vytváří nenapravitelnou chybu, která vede k inhibici další syntézy DNA, a tím vede k buněčné smrti.[2][17][18]
Aktivita má také forma gemcitabinu se dvěma připojenými fosfáty (dFdCDP); inhibuje enzym ribonukleotid reduktáza (RNR), který je potřebný k vytvoření nových nukleotidů DNA. Nedostatek nukleotidů vede buňku k absorpci více složek, které potřebuje k výrobě nukleotidů zvenčí buňky, což také zvyšuje absorpci gemcitabinu.[2][17][18][19]
Chemie
Gemcitabin je syntetický pyrimidin nukleosid proléčivo -A nukleosidový analog ve kterém vodík atomy na 2 'uhlíku deoxycytidin jsou nahrazeny fluor atomy.[2][20][21]
Syntéza popsaná a zobrazená níže je původní syntézou provedenou v laboratořích společnosti Eli Lilly Company. Syntéza začíná enantiočistým D-glyceraldehydem (R) -2 jako výchozím materiálem, který lze připravit z D-mannitolu ve 2–7 krocích. Poté je fluor zaveden přístupem „stavebního bloku“ s použitím ethylbromdifluroacetátu. Poté Reformatskyho reakce za standardních podmínek poskytne 3: 1 anti / syn diastereomerní směs s jedním hlavním produktem. Separace diastereomerů se provádí pomocí HPLC, čímž se získá anti-3 gemcitabin v 65% výtěžku.[20][21] Alespoň dvě další metody úplné syntézy byly také vyvinuty různými skupinami.[21]

Dějiny
Gemcitabin byl poprvé syntetizován v Larry Hertel laboratoř v Eli Lilly and Company na začátku 80. let. Bylo zamýšleno jako antivirotikum, ale předklinické testování ukázalo, že zabíjelo leukemické buňky in vitro.[22]
Na počátku 90. let byl gemcitabin studován v klinických studiích. Studie rakoviny pankreatu zjistily, že gemcitabin významně prodloužil dobu přežití jednoho roku a ve Velké Británii byl schválen v roce 1995[8] a schváleno FDA v roce 1996 pro rakoviny pankreatu.[3] V roce 1998 byl gemcitabin schválen FDA pro léčbu nemalobuněčného karcinomu plic a v roce 2004 byl schválen pro metastatický karcinom prsu.[3]
Evropská značka byla harmonizována agenturou EMA v roce 2008.[23]
Do roku 2008 činil celosvětový prodej gemcitabinu Lilly přibližně 1,7 miliardy USD; v té době měly americké patenty vypršet v roce 2013 a evropské patenty v roce 2009.[24] První generikum uvedené na trh v Evropě v roce 2009,[5] a patentové výzvy byly postaveny v USA, což vedlo ke zneplatnění klíčového Lilly patentu na jeho metodu výroby drogy.[25][26] Generické společnosti začaly drogu prodávat v USA v roce 2010, kdy vypršela platnost patentu na samotnou chemikálii.[26][6] Patentové spory v Číně se tam dostaly na titulky a byly vyřešeny v roce 2010.[27]
Společnost a kultura
Od roku 2017 byl gemcitabin prodáván pod mnoha světovými značkami: Abine, Accogem, Acytabin, Antoril, axigem, Bendacitabin, Biogem, Boligem, Celzar, Citegin, Cytigem, Cytogem, Daplax, DBL, Demozar, Dercin, Emcitab, Enekamub, Eriogem , Fotinex, Gebina, Gemalata, Gembin, Gembine, Gembio, Gemcel, Gemcetin, Gemcibine, Gemcikal, Gemcipen, Gemcired, Gemcirena, Gemcit, Gemcitabin, Gemcitabina, Gemcitabine, Gemcitabinum, Gemcitan, Gemedac, Gemflor, Gemful, Gemita, Gemita, Gemita, Gemita, Gemita Gemmis, Gemnil, Gempower, Gemsol, Gemstad, Gemstada, Gemtabine, Gemtavis, Gemtaz, Gemtero, Gemtra, Gemtro, Gemvic, Gemxit, Gemzar, Gentabim, Genuten, Genvir, Geroam, Gestredos, Getanosan, Getmisi, Gezt, Gitrabin „Haxanit, Jemta, Kalbezar, Medigem, Meditabine, Nabigem, Nallian, Oncogem, Oncoril, Pamigeno, Ribozar, Santabin, Sitagem, Symtabin, Yu Jie, Ze Fei a Zefei.[1]
Výzkum
Vzhledem k tomu, že je klinicky cenný a je užitečný pouze při intravenózním podání, byly předmětem výzkumu metody jeho formulace tak, aby mohl být podáván ústy.[28][29][30]
Výzkum farmakogenomika a farmakogenetika probíhá. Od roku 2014 nebylo jasné, zda mohou být genetické testy užitečné při určování dávkování a kteří lidé nejlépe reagují na gemcitabin.[17] Ukazuje se však, že rozdíly v expresi proteinů (SLC29A1, SLC29A2, SLC28A1, a SLC28A3 ) používané k transportu gemcitabinu do buňky vedlo ke změnám jeho účinnosti. Podobně geny, které exprimují proteiny, které vedou k jeho inaktivaci (deoxycytidindeamináza, cytidindeamináza, a NT5C ) a které exprimují své další intracelulární cíle (RRM1, RRM2, a RRM2B ) vedou ke změnám v reakci na drogu.[17] Probíhá také výzkum s cílem pochopit, jak samotné mutace v rakovině pankreatu určují odpověď na gemcitabin.[31]
Byl zkoumán jako léčba Kaposiho sarkom, běžná rakovina u lidí s AIDS což je v rozvinutém světě neobvyklé, ale v rozvojovém světě neobvyklé.[32]
Viz také
Reference
- ^ A b C „Gemcitabine International Brands“. Drugs.com. Archivováno z původního dne 25. května 2014. Citováno 6. května 2017.
- ^ A b C d E F G h i j k l "Gemcitabin hydrochlorid". Americká společnost farmaceutů zdravotnického systému. Archivováno z původního dne 2. února 2017. Citováno 8. prosince 2016.
- ^ A b C National Cancer Institute (10.10.2006). „Schválení FDA pro gemcitabin hydrochlorid“. Národní onkologický institut. Archivováno z původního dne 5. dubna 2017. Citováno 22. dubna 2017.
- ^ Fischer J, Ganellin CR (2006). Analogový objev drog. John Wiley & Sons. str. 511. ISBN 9783527607495.
- ^ A b Myers, Calisha (13. března 2009). „Gemcitabin od společnosti Actavis byl uveden na trh po vypršení platnosti patentu na trzích EU“. FierceBiotech. Archivováno z původního dne 11. září 2017.
- ^ A b „Tisková zpráva: Hospira uvádí na trh dvougramovou injekční lahvičku gemcitabin-hydrochloridu pro injekce“. Hospira přes News-Medical.Net. 16. listopadu 2010. Archivováno z původního dne 2. října 2015.
- ^ Světová zdravotnická organizace (2019). Seznam základních léků Světové zdravotnické organizace: 21. seznam 2019. Ženeva: Světová zdravotnická organizace. hdl:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Licence: CC BY-NC-SA 3.0 IGO.
- ^ A b C d E F G „UK label“. UK Electronic Medicines Compendium. 5. června 2014. Archivovány od originál dne 10. července 2017. Citováno 6. května 2017.
- ^ A b „US Label“ (PDF). FDA. Červen 2014. Archivováno (PDF) z původního dne 16. února 2017. Citováno 6. května 2017. Aktualizace štítků viz Indexová stránka FDA pro NDA 020509 Archivováno 2017-04-29 na Wayback Machine
- ^ Zhang XW, Ma YX, Sun Y, Cao YB, Li Q, Xu CA (červen 2017). „Gemcitabin v kombinaci s druhým cytotoxickým činidlem při první linii léčby lokálně pokročilého nebo metastatického karcinomu pankreatu: systematický přehled a metaanalýza“. Cílená onkologie. 12 (3): 309–321. doi:10.1007 / s11523-017-0486-5. PMID 28353074. S2CID 3833614.
- ^ Plentz RR, Malek NP (prosinec 2016). "Systémová léčba cholangiokarcinomu". Viscerální medicína. 32 (6): 427–430. doi:10.1159/000453084. PMC 5290432. PMID 28229078.
- ^ Jain A, Kwong LN, Javle M (listopad 2016). „Genomické profilování rakoviny žlučových cest a důsledky pro klinickou praxi“. Aktuální možnosti léčby v onkologii. 17 (11): 58. doi:10.1007 / s11864-016-0432-2. PMID 27658789. S2CID 25477593.
- ^ A b Podpora rakoviny Macmillan. "Gemcitabin". Podpora rakoviny Macmillan. Archivováno z původního dne 25. března 2017. Citováno 6. května 2017.
- ^ Rachel Airley (2009). Chemoterapie rakoviny. Wiley-Blackwell. ISBN 978-0-470-09254-5.
- ^ Siddall E, Khatri M, Radhakrishnan J (červenec 2017). „Syndrom kapilárního úniku: etiologie, patofyziologie a léčba“. Ledviny International. 92 (1): 37–46. doi:10.1016 / j.kint.2016.11.029. PMID 28318633.
- ^ Kasi PM (leden 2011). „Trombotická trombocytopenická purpura a gemcitabin“. Kazuistiky v onkologii. 4 (1): 143–8. doi:10.1159/000326801. PMC 3114619. PMID 21691573.
- ^ A b C d E F G h i Alvarellos ML, Lamba J, Sangkuhl K, Thorn CF, Wang L, Klein DJ, Altman RB, Klein TE (listopad 2014). "PharmGKB shrnutí: cesta gemcitabinu". Farmakogenetika a genomika. 24 (11): 564–74. doi:10.1097 / fpc.0000000000000086. PMC 4189987. PMID 25162786.
- ^ A b C d E F Mini E, Nobili S, Caciagli B, Landini I, Mazzei T (květen 2006). "Buněčná farmakologie gemcitabinu". Annals of Oncology. 17 Suppl 5: v7-12. doi:10.1093 / annonc / mdj941. PMID 16807468.
- ^ Cerqueira NM, Fernandes PA, Ramos MJ (2007). "Pochopení inaktivace ribonukleotid reduktázy gemcitabinem". Chemie. 13 (30): 8507–15. doi:10.1002 / chem.200700260. PMID 17636467.
- ^ A b Brown K, Weymouth-Wilson A, Linclau B (duben 2015). „Lineární syntéza gemcitabinu“. Výzkum sacharidů. 406: 71–5. doi:10.1016 / j.carres.2015.01.001. PMID 25681996.
- ^ A b C Brown K, Dixey M, Weymouth-Wilson A, Linclau B (březen 2014). „Syntéza gemcitabinu“. Výzkum sacharidů. 387: 59–73. doi:10.1016 / j.carres.2014.01.024. PMID 24636495.
- ^ Sneader, Walter (2005). Objev drog: historie. New York: Wiley. str. 259. ISBN 978-0-471-89979-2.
- ^ "Gemzar". Evropská agentura pro léčivé přípravky. 24. září 2008. Archivováno z původního dne 11. září 2017.
- ^ Myers, Calisha (18. srpna 2009). „Patent na Lillyin lék na rakovinu Gemzar zrušen“. FiercePharma. Archivováno z původního dne 11. září 2017.
- ^ Holman, Christopher M. (léto 2011). „Nepředvídatelnost patentového práva a jeho dopad na farmaceutické inovace“ (PDF). Missouri Law Review. 76 (3): 645–693. Archivovány od originál (PDF) dne 2017-09-11. Citováno 2017-05-06.
- ^ A b Ravicher, Daniel B. (28. července 2010). „O obecném boji o patent Gemzar“. Hledám Alfu. Archivováno z původního dne 9. prosince 2012.
- ^ Wang M, Alexandre D (2015). „Analýza případů porušení farmaceutických patentů ve Velké Číně“. V Rader RR a kol. (eds.). Právo, politika a těžba příjmů z duševního vlastnictví. Publikování Cambridge Scholars. str. 119. ISBN 9781443879262. Archivováno z původního dne 2017-09-11.
- ^ Dyawanapelly S, Kumar A, Chourasia MK (2017). „Poučení z gemcitabinu: Dopad terapeutických nosných systémů a konjugátů léčivých přípravků gemcitabinu na léčbu rakoviny“. Kritické recenze v systémech terapeutických nosičů drog. 34 (1): 63–96. doi:10.1615 / CritRevTherDrugCarrierSyst.2017017912. PMID 28322141.
- ^ Birhanu G, Javar HA, Seyedjafari E, Zandi-Karimi A (duben 2017). „Nanotechnologie pro dodávku gemcitabinu k léčbě rakoviny pankreatu“. Biomedicína a farmakoterapie. 88: 635–643. doi:10.1016 / j.biopha.2017.01.071. PMID 28142120.
- ^ Dubey RD, Saneja A, Gupta PK, Gupta PN (říjen 2016). „Nedávný pokrok ve strategiích podávání léků pro zlepšení terapeutické účinnosti gemcitabinu“. European Journal of Pharmaceutical Sciences. 93: 147–62. doi:10.1016 / j.ejps.2016.08.021. PMID 27531553.
- ^ Pishvaian MJ, Brody JR (březen 2017). „Terapeutické důsledky molekulárního podtypu pro rakovinu pankreatu“. Onkologie. 31 (3): 159–66, 168. PMID 28299752. Archivováno z původního dne 3. července 2017.
- ^ Krown SE (září 2011). „Strategie léčby Kaposiho sarkomu v subsaharské Africe: výzvy a příležitosti“. Aktuální názor na onkologii. 23 (5): 463–8. doi:10.1097 / cco.0b013e328349428d. PMC 3465839. PMID 21681092.
externí odkazy
- "Gemcitabin". Informační portál o drogách. Americká národní lékařská knihovna.
