Drosophila melanogaster - Drosophila melanogaster
| Drosophila melanogaster | |
|---|---|
 | |
| Vědecká klasifikace | |
| Království: | |
| Kmen: | |
| Třída: | |
| Objednat: | |
| Rodina: | |
| Rod: | |
| Podrod: | |
| Skupina druhů: | |
| Podskupina druhů: | |
| Druhový komplex: | Drosophila melanogaster komplex |
| Druh: | D. melanogaster |
| Binomické jméno | |
| Drosophila melanogaster | |
Drosophila melanogaster je druh létat (taxonomický řád Diptera) v rodině Drosophilidae. Tento druh je obecně známý jako obyčejná ovocná muška nebo octová muška. Začínání s Charles W. Woodworth Návrh na použití tohoto druhu jako a modelový organismus, D. melanogaster je nadále široce používán pro biologický výzkum v roce 2006 genetika, fyziologie mikrobiální patogeneze, a vývoj historie života. Od roku 2017 šest Nobelovy ceny byl oceněn za použití výzkumu Drosophila.[2][3]
D. melanogaster se obvykle používá ve výzkumu díky svému rychlému životnímu cyklu, relativně jednoduché genetice s pouhými čtyřmi páry chromozomy a velký počet potomků na generaci.[4] Byl to původně africký druh, přičemž všechny neafrické linie měly společný původ.[5] Jeho geografický rozsah zahrnuje všechny kontinenty, včetně ostrovů.[6] D. melanogaster je běžným škůdcem v domácnostech, restauracích a na dalších místech, kde se podává jídlo.[7]
Mouchy patřící do rodiny Tephritidae se také nazývají „ovocné mušky“. To může způsobit zmatek, zejména ve Středomoří, Austrálie, a Jižní Afrika, kde letí středomořské ovoce Ceratitis capitata je ekonomický škůdce.
Fyzický vzhled



Divoký typ ovocné mušky jsou žlutohnědé, s cihlově červenýma očima a příčnými černými kroužky přes břicho. Cihlově červená barva očí divokého typu mouchy je způsobena dvěma pigmenty.[8] Xanthommatin, který je hnědý a je odvozen od tryptofanu, a drosopteriny, které jsou červené a jsou odvozeny od guanosintrifosfátu.[8] Vystavují sexuální dimorfismus; samice jsou dlouhé asi 2,5 mm (0,10 palce); muži jsou o něco menší s tmavšími zády. Muži jsou snadno odlišitelní od žen na základě barevných rozdílů, se zřetelnou černou skvrnou na břiše, méně nápadnou u nedávno objevených mušek a sexcombs (řada tmavých štětin na tarsus první nohy). Kromě toho mají muži shluk špičatých chlupů (sponek) obklopujících reprodukční části, které se používají k připevnění k ženě během páření. Rozsáhlé obrázky najdete na FlyBase.[9]
Životní cyklus a reprodukce

Za optimálních podmínek růstu při 25 ° C (77 ° F), D. melanogaster životnost je přibližně 50 dní od vajíčka po smrt.[10] Vývojové období pro D. melanogaster se mění s teplotou, stejně jako u mnoha jiných ectothermic druh. Nejkratší doby vývoje (od vajíčka po dospělého), 7 dní, je dosaženo při 28 ° C (82 ° F).[11][12] Doby vývoje se zvyšují při vyšších teplotách (11 dní při 30 ° C nebo 86 ° F) v důsledku tepelného stresu. Za ideálních podmínek je doba vývoje při 25 ° C (8,5 ° F) 8,5 dne,[11][12][13] při 18 ° C (64 ° F) to trvá 19 dní[11][12] a při 12 ° C (54 ° F) to trvá více než 50 dní.[11][12] Za přeplněných podmínek se doba vývoje zvyšuje,[14] zatímco vznikající mouchy jsou menší.[14][15] Samice kladou asi 400 vajec (embryí), asi pět najednou, do hnijícího ovoce nebo jiného vhodného materiálu, jako je rozkládající se houby a mýdlové toky. Drosophila melanogaster je holometaboózní hmyz, takže prochází úplnou metamorfózou. Jejich životní cyklus je rozdělen na 4 etapy: embryo, larva, kukla, dospělý.[16] Vejce, která jsou asi 0,5 mm dlouhá, se líhnou po 12–15 hodinách (při 25 ° C nebo 77 ° F).[11][12] Výsledný larvy růst asi 4 dny (při 25 ° C) línání dvakrát (do larev druhého a třetího instaru), přibližně 24 a 48 hodin po vylíhnutí.[11][12] Během této doby se živí mikroorganismy které rozkládají ovoce i na samotném cukru ovoce. Matka vkládá výkaly do vaječných váčků, aby vytvořila stejné mikrobiální složení ve vnitřnostech larev, což pro ni fungovalo pozitivně.[17] Pak se larvy zapouzdřují v puparium a podstoupit 4denní pobyt metamorfóza (při 25 ° C), po které se dospělí uzavřou (vynoří).[11][12]
Muži provádějí sekvenci pěti vzorců chování, aby soudili ženy. Nejprve se muži orientují při hraní námluvy tak, že vodorovně natáhnou a vibrují křídly. Brzy poté se muž umístí do zadní části břicha ženy v nízké poloze, aby klepal a olizoval ženské genitálie. Nakonec si muž zkroutí břicho a pokusí se o páření. Ženy mohou samce odmítnout tím, že se vzdálí, kopnou a vytlačují svého ovipozitora.[18] Páření trvá přibližně 15–20 minut,[19] během nichž muži přenášejí několik stovek, velmi dlouhých (1,76 mm) spermie buňky v semenné tekutině k ženě.[20] Ženy uchovávejte spermie v trubkové nádobě a ve dvou houbovitých tvarech spermathecae; spermie z více páření soutěží o oplodnění. Předpokládá se, že existuje poslední mužská priorita; poslední muž, který se spojil se ženou, zplodí asi 80% jejích potomků. Bylo zjištěno, že tato priorita nastala jak přemístěním, tak ztrátou kapacity.[21] Posun je přičítán manipulaci se spermiemi u samičí mouchy při provádění více páření a je nejvýznamnější během prvních 1–2 dnů po kopulaci. Výtlak ze semenné nádoby je významnější než výtlak ze spermatek.[21] Zneschopnění prvního mužského spermatu druhým mužským spermatem se stává významným 2–7 dní po kopulaci. Předpokládá se, že semenná tekutina druhého muže je zodpovědná za tento mechanismus zneškodnění (bez odstranění prvních mužských spermií), který se projeví dříve oplodnění dojde.[21] Předpokládá se, že zpoždění v účinnosti mechanismu zneschopnění je ochranným mechanismem, který brání mužské mušce v paralyzování jeho vlastních spermií, pokud by se opakovaně pářil se stejnou samicí. Senzorické neurony v děloze ženy D. melanogaster reagovat na mužský protein, sexuální peptid, který se nachází ve spermatu.[22] Díky tomuto proteinu se žena zdráhá kopulovat asi 10 dní poté inseminace. Byla určena signální cesta vedoucí k této změně chování. Signál je odeslán do oblasti mozku, která je homologem hypotalamus a hypotalamus poté řídí sexuální chování a touhu.[22] Gonadotropní hormony v Drosophile udržují homeostázu a řídí reprodukční výkon prostřednictvím cyklického vzájemného vztahu, na rozdíl od savců estrální cyklus.[23] Sexuální peptid narušuje tuto homeostázu a podněcováním dramaticky posouvá endokrinní stav ženy juvenilní hormon syntéza v corpus allatum.[24]
D. melanogaster se často používá pro prodloužení životnosti studie, například za účelem identifikace geny údajně zvyšuje životnost, když zmutovaný.[25] D. melanogaster se také používá při studiích stárnutí. Wernerův syndrom je stav u lidí charakterizovaný zrychleným stárnutím. Je to způsobeno mutace v gen WRN který kóduje protein se zásadní rolí při opravě poškození DNA. Mutace v D. melanogaster homolog z WRN také způsobují zvýšené fyziologické příznaky stárnutí, jako je kratší životnost, vyšší výskyt nádorů, svalová degenerace, snížená schopnost stoupání, změněné chování a snížená pohybová aktivita.[26]
Ženy

Ženy se stanou vnímavými k namlouvání mužů asi 8–12 hodin po objevení.[27] Charakteristický neuron Bylo zjištěno, že skupiny žen ovlivňují chování páření a výběr partnera. Jedna taková skupina v břišní nervová šňůra umožňuje samičí mušce pozastavit pohyby těla, aby se kopulovala.[22] Aktivace těchto neuronů vede k tomu, že samice přestane pohybovat a orientovat se směrem k samci, aby se mohla upevnit. Pokud je skupina deaktivována, samice zůstává v pohybu a nekopuluje. Různé chemické signály, například mužské feromony často jsou schopni skupinu aktivovat.[22]
Vystavují také ženy kopírování volby partnera. Když jsou zobrazeny panenské ženy, jiné ženy kopulující s určitým typem muže, mají tendenci kopulovat více s tímto typem mužů později než naivní ženy (které nepozorovaly kopulaci ostatních). Toto chování je citlivé na podmínky prostředí a ženy se za špatných povětrnostních podmínek kopulují méně.[28]
Muži
Tato sekce potřebuje další citace pro ověření. (Říjen 2015) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
D. melanogaster muži vykazují silnou reprodukční křivku učení. To znamená, že se sexuálními zkušenostmi mají tyto mouchy tendenci modifikovat své budoucí chování při páření několika způsoby. Tyto změny zahrnují zvýšenou selektivitu pro dvoření pouze vnitrodruhově a také sníženou námluvy krát.
Sexuálně naivní D. melanogaster je známo, že muži tráví značný čas mezidruhovým dvorením, například s D. simulans letí. Naivní D. melanogaster se také pokusí soudit ženy, které ještě nejsou sexuálně zralé, a další muže. D. melanogaster muži nevykazují téměř žádnou preferenci D. melanogaster ženy nad ženami jiných druhů nebo dokonce jinými muškami. Avšak poté D. simulans nebo jiné mouchy neschopné páření odmítly postup mužů, D. melanogaster u mužů je mnohem méně pravděpodobné, že v budoucnu stráví čas nekonkrétně. Tato zjevná naučená úprava chování se jeví jako evolučně významná, protože umožňuje mužům vyhnout se investování energie do marných sexuálních setkání.[29]
Kromě toho muži s předchozí sexuální zkušeností upravují svůj námluvný tanec při pokusu o páření s novými ženami - zkušení muži tráví méně času dvořeními, takže mají nižší latenci páření, což znamená, že jsou schopni se rychleji množit. Tato snížená latence páření vede k vyšší účinnosti páření u zkušených mužů než u naivních mužů.[30] Zdá se, že tato modifikace má zjevné evoluční výhody, protože zvýšená efektivita páření je pro oči nesmírně důležitá přírodní výběr.
Mnohoženství
Oba muži a ženy D. melanogaster mouchy jednat polygamně (mít více sexuálních partnerů současně).[31] U mužů i žen vede polygamie ke snížení večerní aktivity ve srovnání s panenskými muškami, více u mužů než u žen.[31] Večerní aktivita se skládá z těch, kterých se mušky účastní, kromě páření a hledání partnerů, jako je hledání potravy.[32] Reprodukční úspěch mužů a žen se liší, protože samice se musí spojit pouze jednou, aby dosáhla maximální plodnosti.[32] Páření s více partnery neposkytuje žádnou výhodu oproti páření s jedním partnerem, takže ženy nevykazují žádný rozdíl ve večerní aktivitě mezi polygamními a monogamními jedinci.[32] U mužů však páření s více partnery zvyšuje jejich reprodukční úspěch zvýšením genetické rozmanitosti jejich potomků.[32] Tato výhoda genetické rozmanitosti je evoluční výhodou, protože zvyšuje pravděpodobnost, že někteří z potomků budou mít vlastnosti, které zvyšují jejich kondici ve svém prostředí.
Rozdíl ve večerní aktivitě mezi polygamními a monogamními muškami lze vysvětlit námluvou. U polygamních much se jejich reprodukční úspěch zvyšuje tím, že mají potomky s více partnery, a proto tráví více času a energie dvořením více žen.[32] Na druhou stranu monogamní mouchy dvoří pouze jedné ženě a vynakládají na to méně energie.[32] I když to vyžaduje více energie pro mužské mouchy k soudu více žen, celkové reprodukční výhody, které produkuje, udržovaly polygamii jako preferovanou sexuální volbu.[32]
Mechanismus, který ovlivňuje chování při námluvách v EU Drosophila je řízen neurony oscilátoru DN1 a LND.[33] Bylo zjištěno, že oscilace neuronů DN1 je ovlivněna sociosexuální interakce, a souvisí s poklesem večerní aktivity souvisejícím s pářením.[33]
Modelový organismus v genetice
D. melanogaster zůstává jedním z nejvíce studovaných organismy v biologickém výzkumu, zejména v genetice a vývojové biologii. D. melanogaster má také dopad na environmentální studie a mutagenezi.
Historie použití v genetické analýze

D. melanogaster byl mezi prvními organismy používá genetická analýza a dnes je jedním z nejpoužívanějších a geneticky nejznámějších ze všech eukaryotický organismy. Všechny organismy používají společné genetické systémy; proto pochopení procesů, jako je transkripce a replikace u ovocných mušek pomáhá porozumět těmto procesům u jiných eukaryot, včetně lidé.[34]
Thomas Hunt Morgan začal používat ovocné mušky v experimentálních studiích dědičnosti v Columbia University v roce 1910 v laboratoři známé jako Fly Room. Fly Room byl stísněný s osmi stoly, každý obsazený studenty a jejich experimenty. Začali experimenty s lahvemi na mléko, aby chovali ovocné mušky a ruční čočky pro sledování jejich vlastností. Čočky byly později nahrazeny mikroskopy, které vylepšily jejich pozorování. Morgan a jeho studenti nakonec objasnili mnoho základních principů dědičnosti, včetně dědičnosti vázané na pohlaví, epistáza, více alel a genové mapování.[34]
D. melanogaster byly historicky používány v laboratořích ke studiu genetiky a vzorů dědičnosti. Nicméně, D. melanogaster má také význam ve výzkumu životního prostředí a mutagenezi. Být tak skvělými modelovými organismy umožňuje vědcům zavádět mutageny a sledovat dopad.[35]
Důvody pro použití v laboratořích

Existuje mnoho důvodů, proč je ovocná muška oblíbenou volbou jako modelový organismus:
- Jeho péče a kultura vyžadují malé vybavení, prostor a náklady, i když používají velké kultury.
- Může být bezpečně a snadno anestetizován (obvykle s éter, oxid uhličitý plynem, chlazením nebo s produkty jako např FlyNap ).
- Jeho morfologii lze snadno identifikovat po anestézii.
- Má krátký generační čas (asi 10 dní při pokojové teplotě), takže několik generací lze studovat během několika týdnů.
- Má vysokou úrodnost (ženy snášejí až 100 vajec denně a možná 2000 za život).[4]
- Muži a ženy se snadno odlišují a panenské ženy se snadno izolují, což usnadňuje genetické křížení.
- Zralá larva má v slinných žlázách tzv. Obří chromozomy polytenové chromozomy „„ obláčky “, které označují oblasti transkripce, tedy genovou aktivitu. Dochází k nedostatečné replikaci rDNA, což má za následek pouze 20% DNA ve srovnání s mozkem. V porovnání se 47%, méně rDNA v Sarcophaga barbata vaječníky.
- Má jen čtyři páry chromozomy - tři autosomy a jeden pár pohlavní chromozomy.
- Muži se neukazují meiotická rekombinace usnadňující genetické studie.
- Recesivní smrtící “vyrovnávací chromozomy "nesoucí viditelné genetické markery lze použít k udržení zásob smrtící alely v heterozygotním stavu bez rekombinace kvůli více inverzím v balanceru.
- Vývoj tohoto organismu - od oplodněného vajíčka až po dospělého dospělého - je dobře znám.
- Techniky genetické transformace jsou k dispozici od roku 1987.
- Je to kompletní genom byl seřazeno a poprvé publikováno v roce 2000.[36]
- Sexuální mozaiky lze snadno vyrobit, což poskytuje další nástroj pro studium vývoje a chování těchto much.[37]
Genetické markery
Genetické markery se běžně používají v Drosophila výzkum, například v rámci balancerových chromozomů nebo inzertů P-prvků, a většina fenotypů je snadno identifikovatelná pouhým okem nebo pod mikroskopem. V seznamu několika běžných markerů níže následuje za symbolem alely název postiženého genu a popis jeho fenotypu. (Poznámka: Recesivní alely jsou psány malými písmeny, zatímco dominantní alely jsou psány velkými písmeny.)
- Cy1: Curly; křivka křídel od těla, let může být poněkud narušen
- E1: Ebony; černé tělo a křídla (heterozygoti jsou také viditelně tmavší než divoký typ)
- Sb1: Strniště; štětiny jsou kratší a silnější než u divokého typu
- w1: Bílý; oči chybí pigmentace a vypadají bíle
- bw: hnědá; barva očí určená různými pigmenty dohromady.
- y1: Žlutá; pigmentace těla a křídla vypadají žlutě, mouchový analog albinismus
Klasické genetické mutace
Drosophila geny jsou tradičně pojmenovány po fenotyp způsobují mutaci. Například absence konkrétního genu v Drosophila bude mít za následek mutantní embryo, u kterého se nevyvine srdce. Vědci tak nazvali tento gen cínový panáček, pojmenoval podle Oz znak stejného jména.[38] Stejně tak změny v Shavenbaby gen způsobí ztrátu hřbetních kutikulárních chloupků v Drosophila sechellia larvy.[39] Tento systém názvosloví vede k širší škále názvů genů než v jiných organismech.
- Adh: Alkohol dehydrogenáza Drosophila melanogaster může vyjádřit alkohol dehydrogenáza (ADH) mutace, čímž se zabrání rozpadu toxických hladin alkoholů na aldehydy a ketony.[40] Zatímco ethanol produkovaný rozkladem ovoce je přirozeným zdrojem potravy a místem pro vajíčko pro Drosophila při nízkých koncentracích (<4%) mohou vysoké koncentrace ethanolu vyvolat oxidační stres a intoxikace alkoholem.[41] Drosophila zdatnost se zvyšuje konzumací nízké koncentrace ethanolu. Počáteční expozice ethanolu způsobuje hyperaktivitu, následovanou nekoordinací a sedací.[42] Další výzkum ukázal, že antioxidant alfa-ketoglutarát může být prospěšný při snižování oxidačního stresu vyvolaného konzumací alkoholu. Studie z roku 2016 dospěla k závěru, že doplňky stravy s 10-mM alfa-ketoglutarátem poklesly Drosophila citlivost na alkohol v průběhu času.[43] Pro gen, který kóduje ADH, je známo 194 klasických a inzertních alel.[44] Dvě alely, které se běžně používají pro experimenty zahrnující toxicitu a reakci ethanolu, jsou ADHs (pomalu) a ADHF (rychle). Četné experimenty dospěly k závěru, že tyto dvě alely představují rozdíly v enzymatické aktivitě každé z nich. Při srovnání homozygotů Adh-F (divokého typu) a Adhulls (homozygotních null) výzkum ukázal, že Adhulls mají nižší úroveň tolerance k ethanolu, čímž zahájí proces intoxikace dříve než jeho protějšek.[42] Další experimenty také dospěly k závěru, že alela Adh je haplosuicient. Haplosuffiency uvádí, že mít jednu funkční alelu bude adekvátní při výrobě potřebných fenotypů pro přežití. To znamená, že mouchy, které byly heterozygotní pro alelu Adh (jedna kopie alely Adh null a jedna kopie alely Adh Wild typu), poskytovaly velmi podobnou fenotypickou toleranci alkoholu jako homozygotní dominantní mouchy (dvě kopie alely Adh divokého typu).[41] Bez ohledu na genotyp, Drosophila vykazují negativní reakci na expozici vzorkům s obsahem ethanolu nad 5%, což činí jakoukoli toleranci nedostatečnou, což má za následek smrtelnou dávku a úmrtnost kolem 70%.[45] Drosophila vykazuje mnoho stejných odpovědí na ethanol jako lidé. Nízké dávky ethanolu způsobují hyperaktivitu, mírné nekoordinované dávky a vysoké dávky uklidňují. “.[46]
- b: černá- Černá mutace byla objevena v roce 1910 Thomas Hunt Morgan.[47] Výsledkem černé mutace je tmavší zbarvení těla, křídel, žil a segmentů nohy ovocné mušky.[48] K tomu dochází kvůli neschopnosti mouchy vytvářet beta-alanin, beta aminokyselina.[47] Fenotypová exprese této mutace se liší podle genotypu jedince; například to, zda je vzorek homozygotní nebo heterozygotní, má za následek tmavší nebo méně tmavý vzhled.[48] Tato genetická mutace je x-vázaný recesivní.[49]
- bw: hnědá- Mutace hnědého oka je výsledkem neschopnosti produkovat nebo syntetizovat pigmenty pteridinu (červené) kvůli bodové mutaci na chromozomu II.[50] Když je mutace homozygotní, nelze syntetizovat pteridinové pigmenty, protože na začátku pteridinové dráhy je defektní enzym kódován homozygotními recesivními geny.[51] Mutace v pteridinové dráze obecně produkují tmavší barvu očí, takže výsledná barva biochemického defektu v pteridinové dráze je hnědá.
- m: miniaturní- Jeden z prvních záznamů o miniaturní mutaci křídel také provedl Thomas Hunt Morgan v roce 1911. Popsal, že křídla mají podobný tvar jako fenotyp divokého typu. Nicméně, jejich miniaturní Označení odkazuje na délky jejich křídel, které se nepřesahují přes jejich tělo, a jsou tedy výrazně kratší než délka divokého typu. Poznamenal také, že jeho dědictví je spojeno s pohlavím mouchy a mohlo by být spárováno s dědictvím jiných pohlavně určených rysů, jako je bílý oči.[52] Křídla mohou také vykazovat další charakteristiky odchylné od křídla divokého typu, například matnější a oblačnější barvu.[53] Miniaturní křídla jsou 1,5x kratší než divokého typu, ale předpokládá se, že mají stejný počet buněk. To je způsobeno nedostatkem úplného zploštění těmito buňkami, což ve srovnání s celkovou strukturou křídla vypadá kratší. Cesta expanze křídla je regulována cestou signálu a receptoru, kde neurohormon bursicon interaguje s jeho komplementárním receptorem spojeným s G proteinem; tento receptor pohání jednu z podjednotek G-proteinu k signalizaci další aktivity enzymu a vede k vývoji v křídle, jako je apoptóza a růst.[54]
- se: sépie- Sépiová barva očí je hnědá. Ommochromy [hnědé] a drosopteriny [červené] jsou zodpovědné za typickou barvu očí Drosophila melanogaster. Tyto mutace se vyskytují na třetím chromozomu.[55] Je to způsobeno neschopností sépie vyrábět pteridinový enzym, který je zodpovědný za červenou pigmentaci, že nejsou schopni zobrazit červené zbarvení očí a místo toho mají hnědé zbarvení, jak bylo uvedeno výše.[56] Když se spojí s divokým typem, budou mouchy s červenýma očima dominantní nad očima sépiové barvy. Poté jsou klasifikovány jako recesivní mutace a mohou být výsledkem pouze tehdy, když oba chromozomy obsahují gen pro sépiové oči. Sépiově zbarvené oči nejsou závislé na pohlaví mouchy. Barva očí Sepia snižuje sexuální aktivitu u mužů a ovlivňuje preference žen.[55]”[57]
- v: rumělka- Vermilionová barva očí ve srovnání s divokým typem D. melanogaster je zářivě červená. Vermilion color color mutant is sex-linked recesive gen due to its absence of brown eye pigment. Červený pigment se nachází na X chromozomu.[58] Syntéza hnědého pigmentu je způsobena procesem přeměny tryptofanu na kynurenin, vermilionovým muškám chybí schopnost převádět tyto aminokyseliny blokující produkci hnědého pigmentu.[58] Snížení množství tryptofanu přeměněného na kynurenin u vermilionových mutantů bylo spojeno s delší životností ve srovnání s muškami divokého typu.[59]

- vg: pozůstatek- Spontánní mutace, objevená v roce 1919 Thomasem Morganem a Calvinem Bridgesem. Zbytková křídla jsou ta, která nejsou plně vyvinutá a která ztratila funkci. Od objevu zakrnělého genu v Drosophila melanogaster, došlo k mnoha objevům zakrnělého genu u jiných obratlovců a jejich funkcí u obratlovců.[60] Zakrnělý gen je považován za jeden z nejdůležitějších genů pro tvorbu křídel, ale jakmile dojde k jeho nadměrnému vyjádření, začne se formovat otázka ektopických křídel.[61] Zakrnělý gen působí tak, že reguluje expresi imaginárních disků křídel v embryu a působí s jinými geny k regulaci vývoje křídel. Mutovaná zakrnělá alela odstraňuje základní sekvenci DNA potřebnou pro správný vývoj křídel.[62]
- w: bílá- Drosophila melanogaster divoký typ obvykle vyjadřuje cihlově červenou barvu očí. Mutace bílého oka u ovocných mušek je způsobena absencí dvou pigmentů spojených s barvami červených a hnědých očí; peridiny (červené) a ommochromy (hnědé).[56] V lednu 1910 Thomas Hunt Morgan poprvé objevil bílý gen a označil jej jako w. Objev mutace bílých očí Morganem přinesl počátky genetického experimentování a analýzy Drosophila melanogaster. Hunt nakonec zjistil, že gen sledoval podobný vzor dědičnosti související s meiotickou segregací chromozomu X. Zjistil, že s touto informací byl gen lokalizován na X chromozomu. To vedlo k objevu genů vázaných na pohlaví a také k objevení dalších mutací v Drosophila melanogaster.[63] Mutace bílých očí vede u mušek k několika nevýhodám, jako je snížená lezecká schopnost, zkrácená délka života a snížená odolnost vůči stresu ve srovnání s muškami divokého typu.[64] Drosophila melanogaster má řadu chování při páření, které jim umožňují kopulovat v daném prostředí, a proto přispívají k jejich kondici. Po Morganově objevu, že mutace bílých očí je spojena s pohlavím, dospěla studie vedená Sturtevantem (1915) k závěru, že bělovlasí muži byli z hlediska páření se ženami méně úspěšní než muži divokého typu.[65] Bylo zjištěno, že čím větší hustota pigmentace očí, tím větší úspěšnost páření u mužů Dr.osophila melanogaster.[65]
- y: žlutá- Žlutý gen je a genetická mutace známý jako Dmel y v rámci široce používané databáze s názvem flybase. Tuto mutaci lze snadno identifikovat pomocí atypické žlutý pigment pozorovaný v kutikule dospělých much a v ústech kousků larvy.[66] Y mutace zahrnuje následující fenotypový třídy: mutanti, kteří vykazují úplnou ztrátu pigmentace z kutikuly (typ y) a další mutanti, kteří vykazují mozaikový pigmentový vzor s některými oblastmi kutikuly (divoký typ, typ y2).[67] Role žlutého genu je různorodá a je zodpovědná za změny chování, pohlavně specifické reprodukční zrání a epigenetický přeprogramování.[68] Gen y je ideální gen ke studiu, protože je viditelně jasné, kdy organisim má tento gen, což usnadňuje pochopení přechodu DNA k potomkům.[68]

Genom
 D. melanogaster chromozomy v měřítku s odkazy na megabázové páry orientované jako v Databáze Národního centra pro biotechnologické informace, vzdálenosti centimorganů jsou přibližné a odhadované z umístění vybraných mapovaných lokusů. | |
| NCBI ID genomu | 47 |
|---|---|
| Ploidy | diploidní |
| Počet chromozomy | 8 |
| Rok dokončení | 2015 |
The genom z D. melanogaster (seřazeno v roce 2000 a kurátorem v FlyBase databáze[36]) obsahuje čtyři páry chromozomů - pár X / Y a tři autosomy označeny 2, 3 a 4. Čtvrtý chromozom je tak malý, kromě svého důležitého je často ignorován nevidomý gen. The D. melanogaster sekvenovaný genom 139,5 milionů párů bází byl anotován[69] a obsahuje přibližně 15 682 genů podle vydání Ensemble 73. Více než 60% genomu se zdá být funkční DNA, která nekóduje proteiny[70] podílí se na kontrole genové exprese. Stanovení pohlaví v Drosophila nastává X: Poměr chromozomů X na autosomy, ne kvůli přítomnosti chromozomu Y jako při určování lidského pohlaví. Přestože chromozom Y je zcela heterochromatický, obsahuje alespoň 16 genů, z nichž mnohé jsou považovány za funkce spojené s muži.[71]
Podobnost s lidmi
Studie z března 2000 od Národní institut pro výzkum lidského genomu Při srovnání ovocné mušky a lidského genomu se odhaduje, že mezi těmito dvěma druhy je zachováno přibližně 60% genů.[72] Asi 75% známých lidských chorobných genů má rozpoznatelnou shodu v genomu ovocných mušek,[73] a 50% sekvencí bílkovin mouchy má savčí homology[Citace je zapotřebí ]. Online databáze s názvem Homophila je k dispozici k hledání homologů genů lidských nemocí u much a naopak.[74]
Drosophila se používá jako genetický model pro několik lidských onemocnění, včetně neurodegenerativních poruch Parkinsonova choroba, Huntington, spinocerebelární ataxie a Alzheimerova choroba.[75] Moucha se také používá ke studiu základních mechanismů stárnutí a oxidační stres, imunita, cukrovka, a rakovina, stejně jako zneužívání drog.[76][77][78]
Connectome
Drosophila je jedním z mála zvířat (C. elegans jako další), kde podrobné neurální obvody (a konektom ) jsou dostupné.
Pro mozek s plným létáním existuje konektom na vysoké úrovni na úrovni mozkových oddílů a propojovacích cest neuronů.[79] Verze tohoto je k dispozici online.[80]
Podrobná připojení na úrovni obvodu existují pro plátek[81][82] a a dřeň[83] sloupec, a to jak ve vizuálním systému ovocné mušky, tak v alfa laloku těla houby.[84]
V květnu 2017 článek publikovaný v bioRxiv představil svazek obrazů elektronového mikroskopu celého mozku dospělých žen v synaptickém rozlišení. Hlasitost je k dispozici pro řídké trasování vybraných obvodů.[85][86]
V roce 2020 hustý konektom poloviny centrálního mozku Drosophila byl vydán,[87] spolu s webovým serverem, který umožňuje dotazy a průzkum těchto dat.[88] Následovaly metody použité při rekonstrukci a počáteční analýze konomeomu.[89]
Rozvoj
Životní cyklus tohoto hmyzu má čtyři fáze: oplodněné vajíčko, larva, kukla a dospělý.[6]
Embryogeneze v Drosophila byl rozsáhle studován, protože jeho malá velikost, krátká doba generování a velká velikost plodu je ideální pro genetické studie. U modelových organismů je také jedinečný v tom, že se štěpení vyskytuje v a syncytium.

Během oogeneze spojují cytoplazmatické můstky zvané „prstencové kanály“ formující se oocyt se sesterskými buňkami. Živiny a vývojové kontrolní molekuly se pohybují z ošetřovatelských buněk do oocytu. Na obrázku vlevo lze vidět, že tvořící se oocyt je pokryt folikulárními podpůrnými buňkami.
Po oplodnění oocytu, raného embrya (nebo syncyciální embryo ) prochází rychlou replikací DNA a 13 jadernými děleními, dokud se v neoddělené cytoplazmě embrya nehromadí asi 5 000 až 6 000 jader. Na konci osmé divize většina jader migrovala na povrch a obklopila žloutkový váček (zanechala po sobě jen několik jader, která se stanou jádry žloutku). Po 10. dělení se pólové buňky tvoří na zadním konci embrya a oddělují zárodečnou linii od syncytia. Nakonec, po 13. dělení, buněčné membrány pomalu invaginují a rozdělí syncytium na jednotlivé somatické buňky. Jakmile je tento proces dokončen, gastrulace začíná.[90]
Jaderná divize na počátku Drosophila embryo se děje tak rychle, neexistují žádné správné kontrolní body, takže při dělení DNA může dojít k chybám. Chcete-li tento problém obejít, jádra, která udělala chybu, se od nich oddělují centrosomy a spadnout do středu embrya (žloutkový váček), který nebude součástí mouchy.
Genová síť (transkripční a proteinové interakce), která řídí časný vývoj embrya ovocné mušky, je jednou z dosud nejpoužívanějších genových sítí, zejména vzorování podél anteroposteriorní (AP) a dorsoventrální (DV) osy (viz níže morfogeneze ).[90]
Embryo prochází dobře charakterizovaným morfogenetický pohyby během gastrulace a časného vývoje, včetně prodloužení zárodku, vytvoření několika rýh, ventrální invaginace mezoderm a zadní a přední invaginace endoderm (střeva), stejně jako rozsáhlá segmentace těla, až se nakonec vylíhnou z okolní kutikuly do larvy prvního instaru.
Během vývoje larev se tkáně známé jako imaginární disky růst uvnitř larvy. Imaginální disky se vyvíjejí a vytvářejí většinu struktur těla dospělého, jako je hlava, nohy, křídla, hrudník a genitálie. Buňky imaginálních disků jsou během embryogeneze vyčleněny a pokračují v růstu a dělení během larválních stádií - na rozdíl od většiny ostatních buněk larvy, které se diferencovaly, aby plnily specializované funkce a rostly bez dalšího dělení buněk. Při metamorfóze tvoří larva a kukla, uvnitř kterého jsou reaktivně absorbovány larvální tkáně a imaginální tkáně procházejí rozsáhlými morfogenetickými pohyby a vytvářejí struktury dospělých.
Vývojová plasticita
Biotický a abiotický faktory během vývoje ovlivní alokaci vývojových zdrojů vedoucí k fenotypová variace, označovaný také jako vývojová plasticita.[91][92] Jako u všech druhů hmyzu,[92] faktory prostředí mohou ovlivnit několik aspektů rozvoje v roce 2006 Drosophila melanogaster.[93][94] Ovocné mušky chované pod a hypoxie zkušenost s léčením snížila délku hrudníku, zatímco hyperoxie produkuje menší letové svaly, což naznačuje negativní vývojové účinky extrémních hladin kyslíku.[95] Cirkadiánní rytmy podléhají také vývojové plasticitě. Světelné podmínky během vývoje ovlivňují denní vzorce aktivity v Drosophila melanogaster, kde mouchy chované za stálé tmy nebo světla jsou méně aktivní jako dospělí než ty, které jsou chovány za 12hodinového cyklu světlo / tma.[96]
Teplota je jedním z nejvíce prostupujících faktorů, které ovlivňují členovec rozvoj. v Drosophila melanogaster teplotně vyvolaná vývojová plasticita může být prospěšná a / nebo škodlivá.[97][98] Nejčastěji nižší vývojové teploty snižují rychlost růstu, která ovlivňuje mnoho dalších fyziologických faktorů.[99] Například vývoj při 25 ° C zvyšuje rychlost chůze, šířka tepelného výkonu a územní úspěch, zatímco vývoj při 18 ° C zvyšuje tělesnou hmotnost, velikost křídla, což vše souvisí s kondicí.[94][97] Kromě toho vývoj při určitých nízkých teplotách vytváří proporcionálně velká křídla, která zlepšují letový a reprodukční výkon při podobně nízkých teplotách (Vidět aklimatizace ).[100]
Zatímco určité účinky vývojové teploty, jako je velikost těla, jsou nevratné ectotherms, ostatní mohou být reverzibilní.[92][101] Když Drosophila melanogaster vyvíjejí se při nízkých teplotách, budou mít větší toleranci vůči chladu, ale pokud jsou mušky chované za studena udržovány na teplejších teplotách, jejich tolerance vůči chladu klesá a tolerance tepla se časem zvyšuje.[101][102] Vzhledem k tomu, že se hmyz obvykle páří pouze v určitém rozmezí teplot, je jeho tolerance vůči chladu a teplu důležitým znakem při maximalizaci reprodukčního výkonu.[103]
I když se očekává, že výše popsané vlastnosti se projeví podobně u obou pohlaví, vývojová teplota může také vyvolat u pohlaví specifické účinky D. melanogaster Dospělí.
- Ženy- Ovariole počet je významně ovlivněn vývojovou teplotou v D. melanogaster.[104] Velikost vajec je také ovlivněna vývojovou teplotou a zhoršuje se, když se oba rodiče vyvíjejí při teplých teplotách (Vidět Mateřský účinek ).[97] Při stresových teplotách se tyto struktury vyvinou do menších konečných velikostí a sníží reprodukční výkon ženy.[104][97] Časná plodnost (celkový počet vajec uložených během prvních 10 dnů poeclosion ) se maximalizuje při chovu při 25 ° C (proti 17 ° C a 29 ° C) bez ohledu na teplotu dospělých.[105] V širokém rozmezí vývojových teplot mají ženy obvykle větší toleranci vůči teplu než muži.[106]
- Muži - způsobí stresující vývojové teploty sterilita v D. melanogaster muži; i když horní teplotní limit lze zvýšit udržováním kmenů při vysokých teplotách (Vidět aklimatizace ).[98] Male sterility can be reversible if adults are returned to an optimal temperature after developing at stressful temperatures.[107] Male flies are smaller and more successful at defending food/oviposition sites when reared at 25 °C versus 18 °C; thus smaller males will have increased mating success and reproductive output.[94]
Určení pohlaví
Drosophila flies have both X and Y chromosomes, as well as autosomy. Unlike humans, the Y chromosome does not confer maleness; rather, it encodes genes necessary for making sperm. Sex is instead determined by the ratio of X chromosomes to autosomes.[108] Furthermore, each cell "decides" whether to be male or female independently of the rest of the organism, resulting in the occasional occurrence of gynandromorphs.
| X Chromosomes | Autosomy | Ratio of X:A | Sex |
|---|---|---|---|
| XXXX | AAAA | 1 | Normal Female |
| XXX | AAA | 1 | Normal Female |
| XXY | AA | 1 | Normal Female |
| XXYY | AA | 1 | Normal Female |
| XX | AA | 1 | Normal Female |
| XY | AA | 0.50 | Normal Male |
| X | AA | 0.50 | Normal Male (sterile) |
| XXX | AA | 1.50 | Metafemale |
| XXXX | AAA | 1.33 | Metafemale |
| XX | AAA | 0.66 | Intersex |
| X | AAA | 0.33 | Metamale |
Three major genes are involved in determination of Drosophila sex. Tyto jsou sex-lethal, sisterless, a mrtvý muž. Deadpan is an autosomal gene which inhibits sex-lethal, zatímco sisterless is carried on the X chromosome and inhibits the action of mrtvý muž. An AAX cell has twice as much mrtvý muž tak jako sisterless, tak sex-lethal will be inhibited, creating a male. However, an AAXX cell will produce enough sisterless to inhibit the action of mrtvý muž, což umožňuje sex-lethal gene to be transcribed to create a female.
Later, control by mrtvý muž a sisterless disappears and what becomes important is the form of the sex-lethal gen. A secondary promoter causes transcription in both males and females. Analýza cDNA has shown that different forms are expressed in males and females. Sex-lethal has been shown to affect the sestřih Jeho vlastní mRNA. In males, the third exon is included which encodes a stop kodon, causing a truncated form to be produced. In the female version, the presence of sex-lethal causes this exon to be missed out; the other seven aminokyseliny are produced as a full peptid chain, again giving a difference between males and females.[109]
Presence or absence of functional sex-lethal proteins now go on to affect the transcription of another protein known as doublesex. In the absence of sex-lethal, doublesex will have the fourth exon removed and be translated up to and including exon 6 (DSX-M[ale]), while in its presence the fourth exon which encodes a stop codon will produce a truncated version of the protein (DSX-F[emale]). DSX-F causes transcription of Yolk proteins 1 and 2 in somatický cells, which will be pumped into the oocyt on its production.
Imunita
The D. melanogaster immune system can be divided into two responses: humoral and cell-mediated. The former is a systemic response mediated in large part through the Toll a Imd pathways, which are parallel systems for detecting microbes. Other pathways including the stress response pathways JAK-STAT a P38, nutritional signalling via FOXO, a JNK cell death signalling are all involved in key physiological responses to infection. D. melanogaster má tlusté tělo, který je analogický to the human liver. The fat body is the primary secretory organ and produces key immune molecules upon infection, such as serinové proteázy a antimikrobiální peptidy (AMPs). AMPs are secreted into the hemolymfa and bind infectious bacteria and fungi, killing them by forming pores in their buněčné stěny or inhibiting intracellular processes. The cellular immune response instead refers to the direct activity of blood cells (hemocytes) in Drosophila, which are analogous to mammalian monocytes/macrophages. Hemocytes also possess a significant role in mediating humoral immune responses such as the melanizace reakce.[110]
The immune response to infection can involve up to 2,423 genes, or 13.7% of the genome. Although the fly's transcriptional response to microbial challenge is highly specific to individual pathogens, Drosophila differentially expresses a core group of 252 genes upon infection with most bacteria. This core group of genes is associated with gene ontology categories such as antimicrobial response, stress response, secretion, neuron-like, reproduction, and metabolism among others.[111][112] Drosophila also possesses several immune mechanisms to both shape the microbiota and prevent excessive immune responses upon detection of microbial stimuli. For instance, secreted PGRPs with amidase activity scavenge and degrade immunostimulatory DAP-type PGN in order to block Imd activation.[113]
Unlike mammals, Drosophila mít imunita but lack an adaptive immune response. However, the core elements of this innate immune response are conserved between humans and fruit flies. As a result, the fruit fly offers a useful model of innate immunity for disentangling genetic interactions of signalling and effector function, as flies do not have to contend with interference of adaptive immune mechanisms that could confuse results. Various genetic tools, protocols, and assays make Drosophila a classical model for studying the vrozený imunitní systém,[114] which has even included immune research on the international space station.[115]
The Drosophila Toll pathway
První popis Mýtné receptory involved in the response to infection was performed in Drosophila.[119] culminating in a Nobel prize in 2011.[120] The Toll cesta dovnitř Drosophila is homologous to Toll-like pathways in mammals. This regulatory cascade is initiated following pathogen recognition by receptory rozpoznávání vzoru, zejména z Grampozitivní bakterie, parasites, and fungal infection. This activation leads to serinová proteáza signalling cascades ultimately activating the cytokine Spätzle. Alternatively, microbial proteases can directly cleave serine proteases like Persephone that then propagate signalling.[121] The cytokine Spatzle then acts as the ligand for the Toll pathway in flies. Upon infection, pro-Spatzle is cleaved by the protease SPE (Spatzle processing enzyme) to become active Spatzle, which binds to the Toll receptor located on the cell surface of the fat body and dimerizes for activation of downstream NF-kB signaling pathways, including multiple death domain containing proteins and negative regulators such as the ankyrin opakovat protein Cactus. The pathway culminates with the translocation of the NF-kB transcription factors Dorsal and Dif (Dorsal-related immunity factor) into the nucleus.
The Toll pathway was identified by its regulation of antimicrobial peptides (AMPs), including the antifungal peptide Drosomycin. Upon infection, AMPs increase in expression sometimes by 1000-fold, providing unmistakable readouts of pathway activation. Another group of Toll-regulated AMP-like effectors includes the Bomanins, which appear to be responsible for the bulk of Toll-mediated immune defence,[122] however Bomanins alone do not exhibit antimicrobial activity.[123]
It has been proposed that a second SPE-like enzyme similarly acts to activate Spatzle, as loss of SPE does not completely reduce the activity of Toll signalling,[124] however no second SPE has yet been identified. A number of serine proteases are yet to be characterized, including many with homology to SPE.[117] The Toll pathway also interacts with renal filtration of microbiota-derived peptidoglycan, maintaining immune homeostasis. Mechanistically, nephrocytes endocytose Lys-type PGN from systemic circulation and route it to lysosomes for degradation. Without this, Toll signalling is constitutively activated, resulting in a severe drain on nutrient reserves and a significant stress on host physiology.[125]

The Drosophila Imd cesta
The Imd cesta is orthologous to human Nadrodina receptorů TNF signalling, and is triggered by Gramnegativní bakterie through recognition by peptidoglycan recognition proteins (PGRP) including both soluble receptors and cell surface receptors (PGRP-LE and LC, respectively). Imd signalling culminates in the translocation of the NF-kB transcription factor Relish into the nucleus, leading to the upregulation of Imd-responsive genes including the AMP Diptericin. Consequently, flies deficient for AMPs resemble Imd pathway mutants in terms of susceptibility to bacterial infection.[126] Imd signalling and Relish specifically are also involved in the regulation of immunity at surface epithelia including in the gut and respiratory tracts.[110]
The Relish transcription factor has also been implicated in processes regarding cell proliferation[127] and neurodegeneration either through autophagy,[128] or autoimmune toxicity.[129][130] In neurodegenerative models relying on Imd signalling, expression of AMPs in the brain is correlated with brain tissue damage, lesions, and ultimately death.[131][132][133] Relish-regulated AMPs such as Defensin a Diptericin also have anti-cancer properties promoting tumour clearance.[134][135] The Imd-regulated AMP Diptericin B is also produced by the fat body specifically in the head, and Diptericin B is required for long-term memory formation.[136]
JAK-STAT signalling
Multiple elements of the Drosophila JAK-STAT signalling pathway bear direct homology to human JAK-STAT pathway genes. JAK-STAT signalling is induced upon various organismal stresses such as heat stress, dehydration, or infection. JAK-STAT induction leads to the production of a number of stress response proteins including Thioester-containing proteins (TEPs),[137] Turandots,[138] and the putative antimicrobial peptide Listericin.[139] The mechanisms through which many of these proteins act is still under investigation. For instance, the TEPs appear to promote phagocytosis of Gram-positive bacteria and the induction of the Toll pathway. As a consequence, flies lacking TEPs are susceptible to infection by Toll pathway challenges.[137]
The Cellular response to infection
Circulating hemocytes are key regulators of infection. This has been demonstrated both through genetic tools to generate flies lacking hemocytes, or through injecting microglass beads or lipid droplets that saturate hemocyte ability to phagocytose a secondary infection.[140][141] Flies treated like this fail to phagocytose bacteria upon infection, and are correspondingly susceptible to infection.[142] These hemocytes derive from two waves of krvetvorba, one occurring in the early embryo and one occurring during development from larva to adult.[143] However Drosophila hemocytes do not renew over the adult lifespan, and so the fly has a finite number of hemocytes that decrease over the course of its lifespan.[144] Hemocytes are also involved in regulating cell-cycle events and apoptosis of aberrant tissue (e.g. cancerous cells) by producing Eiger, a faktor nekrózy nádorů signalling molecule that promotes JNK signalling and ultimately cell death and apoptosis.[145]
Behavioral genetics and neuroscience
V roce 1971 Ron Konopka a Seymour Benzer published "Clock mutants of Drosophila melanogaster", a paper describing the first mutace that affected an animal's behavior. Wild-type flies show an activity rhythm with a frequency of about a day (24 hours). They found mutants with faster and slower rhythms, as well as broken rhythms—flies that move and rest in random spurts. Work over the following 30 years has shown that these mutations (and others like them) affect a group of genes and their products that form a biochemical or biologické hodiny. This clock is found in a wide range of fly cells, but the clock-bearing cells that control activity are several dozen neurons in the fly's central brain.
Since then, Benzer and others have used behavioral screens to isolate genes involved in vision, olfaction, audition, learning/memory, courtship, pain, and other processes, such as longevity.
Po průkopnické práci Alfred Henry Sturtevant[146] and others, Benzer and colleagues[37] used sexual mosaics to develop a novel mapování osudu technika. This technique made it possible to assign a particular characteristic to a specific anatomical location. For example, this technique showed that male courtship behavior is controlled by the brain.[37] Mosaic fate mapping also provided the first indication of the existence of feromony u tohoto druhu.[147] Males distinguish between conspecific males and females and direct persistent courtship preferentially toward females thanks to a female-specific sex pheromone which is mostly produced by the female's tergity.
The first learning and memory mutants (hlupák, rutabaga, etc.) were isolated by William "Chip" Quinn while in Benzer's lab, and were eventually shown to encode components of an intracellular signaling pathway involving cyklický AMP, protein kinase A, and a transcription factor known as CREB. These molecules were shown to be also involved in synaptic plasticity in Aplysia a savci.[148]
The Nobelova cena za fyziologii nebo medicínu for 2017 was awarded to Jeffrey C. Hall, Michael Rosbash, Michael W. Young for their works using fruit flies in understanding the "molecular mechanisms controlling the cirkadiánní rytmus ".[149]
Male flies sing to the females during courtship using their wings to generate sound, and some of the genetics of sexual behavior have been characterized. Zejména fruitless gene has several different splice forms, and male flies expressing female splice forms have female-like behavior and vice versa. The TRP channels nompC, nanchung, a neaktivní are expressed in sound-sensitive Johnstonovy varhany neurons and participate in the transduction of sound.[150][151] Mutating the Genderblind gene, also known as CG6070, alters the sexual behavior of Drosophila, turning the flies bisexuální.[152]
Flies use a modified version of Bloom filters detekovat novinka of odors, with additional features including similarity of novel odor to that of previously experienced examples, and time elapsed since previous experience of the same odor.[153]
Agrese
As with most insects, aggressive behaviors between male flies commonly occur in the presence of courting a female and when competing for resources. Such behaviors often involve raising wings and legs towards the opponent and attacking with the whole body.[154] Thus, it often causes wing damage, which reduces their fitness by removing their ability to fly and mate.[155]
Acoustic communication
In order for aggression to occur, male flies produce sounds to communicate their intent. A 2017 study found that songs promoting aggression contain pulses occurring at longer intervals.[156] Sekvenování RNA from fly mutants displaying over-aggressive behaviors found more than 50 auditory-related genes (important for transient receptor potentials, Ca.2+ signalizace, a mechanoreceptor potentials) to be upregulated in the AB neurons located in Johnstonovy varhany.[156] In addition, aggression levels were reduced when these genes were knocked out via Interference RNA.[156] This signifies the major role of hearing as a sensory modality in communicating aggression.
Pheromone signaling
Other than hearing, another sensory modality that regulates aggression is feromon signaling, which operates through either the čichový systém nebo chuťový systém depending on the pheromone.[157] An example is cVA, an anti-aphrodisiac pheromone used by males to mark females after copulation and to deter other males from mating.[158] This male-specific pheromone causes an increase in male-male aggression when detected by another male's chuťový systém.[157] However, upon inserting a mutation that makes the flies irresponsive to cVA, no aggressive behaviors were seen.[159] This shows how there are multiple modalities for promoting aggression in flies.
Competition for food
Specifically, when competing for food, aggression occurs based on amount of food available and is independent of any social interactions between males.[160] Konkrétně sacharóza was found to stimulate gustatory receptor neurons, which was necessary to stimulate aggression.[160] However, once the amount of food becomes greater than a certain amount, the competition between males lowers.[160] This is possibly due to an over-abundance of food resources. On a larger scale, food was found to determine the boundaries of a territory since flies were observed to be more aggressive at the food's physical perimeter.
Effect of sleep deprivation
However, like most behaviors requiring arousal and wakefulness, aggression was found to be impaired via nedostatek spánku. Specifically, this occurs through the impairment of Octopamin a dopamin signaling, which are important pathways for regulating arousal in insects.[161][162] Due to reduced aggression, sleep-deprived male flies were found to be disadvantaged at mating compared to normal flies.[162] However, when octopamine agonists were administered upon these sleep-deprived flies, aggression levels were seen to be increased and sexual fitness was subsequently restored.[162] Therefore, this finding implicates the importance of sleep in aggression between male flies.
Transgeneze
It is now relatively simple to generate transgenic flies in Drosophila, relying on a variety of techniques. One approach of inserting foreign genes into the Drosophila genome involves P elements. The transposable P elements, also known as transpozice, are segments of bacterial DNA that are transferred into the fly genome. Transgenic flies have already contributed to many scientific advances, e.g., modeling such human diseases as Parkinsonova choroba, neoplazie, obezita, a cukrovka.[163]
Vidění

The složené oko of the fruit fly contains 760 unit eyes or ommatidia, and are one of the most advanced among insects. Each ommatidium contains eight photoreceptor cells (R1-8), support cells, pigment cells, and a cornea. Wild-type flies have reddish pigment cells, which serve to absorb excess blue light so the fly is not blinded by ambient light. Eye color genes regulate cellular vesicular transport. The enzymes needed for pigment synthesis are then transported to the cell's pigment granule, which holds pigment precursor molecules.[56]
Each photoreceptor cell consists of two main sections, the cell body and the rhabdomere. The cell body contains the jádro, while the 100-μm-long rhabdomere is made up of toothbrush-like stacks of membrane called mikrovilli. Each microvillus is 1–2 μm in length and about 60 nm v průměru.[164] The membrane of the rhabdomere is packed with about 100 million rhodopsin molecules, the visual protein that absorbs light. The rest of the visual proteins are also tightly packed into the microvillar space, leaving little room for cytoplazma.
The photoreceptors in Drosophila express a variety of rhodopsin izoformy. The R1-R6 photoreceptor cells express rhodopsin1 (Rh1), which absorbs blue light (480 nm). The R7 and R8 cells express a combination of either Rh3 or Rh4, which absorb UV light (345 nm and 375 nm), and Rh5 or Rh6, which absorb blue (437 nm) and green (508 nm) light, respectively. Each rhodopsin molecule consists of an opsin protein covalently linked to a karotenoid chromophore, 11-cis-3-hydroxyretinal.[165]
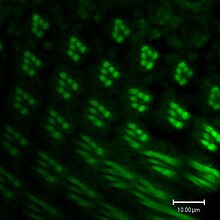
Jako v vertebrate vision, visual transduction in bezobratlých occurs via a G protein-coupled pathway. Nicméně v obratlovců, G protein is transducin, while the G protein in invertebrates is Gq (dgq in Drosophila). When rhodopsin (Rh) absorbs a foton of light its chromophore, 11-cis-3-hydroxyretinal, is isomerized to all-trans-3-hydroxyretinal. Rh undergoes a conformational change into its active form, metarhodopsin. Metarhodopsin activates Gq, which in turn activates a fosfolipáza Cβ (PLCβ) known as NorpA.[166]
PLCβ hydrolyzes phosphatidylinositol (4,5)-bisphosphate (PIP.)2), a fosfolipid nalezen v buněčná membrána, into soluble inositol trifosfát (IP3) a diacylglycerol (DAG), which stays in the cell membrane. DAG or a derivative of DAG causes a vápník -selektivní iontový kanál známý jako transient receptor potential (TRP) to open and calcium and sodík flows into the cell. IP3 is thought to bind to IP3 receptory in the subrhabdomeric cisternae, an extension of the endoplazmatické retikulum, and cause release of calcium, but this process does not seem to be essential for normal vision.[166]
Calcium binds to proteins such as klimodulin (CaM) and an eye-specific protein kináza C. (PKC) known as InaC. These proteins interact with other proteins and have been shown to be necessary for shut off of the light response. In addition, proteins called arrestins bind metarhodopsin and prevent it from activating more Gq. A výměník sodíku a vápníku known as CalX pumps the calcium out of the cell. It uses the inward sodium gradient to export calcium at a stechiometrie of 3 Na+/ 1 Ca++.[167]
TRP, InaC, and PLC form a signaling complex by binding a scaffolding protein called InaD. InaD contains five binding domains called Doména PDZ proteins, which specifically bind the C termini of target proteins. Disruption of the complex by mutations in either the PDZ domains or the target proteins reduces the efficiency of signaling. For example, disruption of the interaction between InaC, the protein kinase C, and InaD results in a delay in inactivation of the light response.
Unlike vertebrate metarhodopsin, invertebrate metarhodopsin can be converted back into rhodopsin by absorbing a photon of orange light (580 nm).
Asi dvě třetiny Drosophila brain is dedicated to visual processing.[168] Ačkoliv prostorové rozlišení of their vision is significantly worse than that of humans, their časové rozlišení is around 10 times better.
Zastřihování
Drosophila are known to exhibit grooming behaviors that are executed in a predictable manner. Drosophila consistently begin a grooming sequence by using their front legs to clean the eyes, then the head and antennae. Using their hind legs, Drosophila proceed to groom their abdomen, and finally the wings and thorax. Throughout this sequence, Drosophila periodically rub their legs together to get rid of excess dust and debris that accumulates during the grooming process.[169]
Grooming behaviors have been shown to be executed in a suppression hierarchy. This means that grooming behaviors that occur at the beginning of the sequence prevent those that come later in the sequence from occurring simultaneously, as the grooming sequence consists of mutually exclusive behaviors.[170][171] This hierarchy does not prevent Drosophila from returning to grooming behaviors that have already been accessed in the grooming sequence.[170] The order of grooming behaviors in the suppression hierarchy is thought to be related to the priority of cleaning a specific body part. For example, the eyes and antennae are likely executed early on in the grooming sequence to prevent debris from interfering with the function of D. melanogaster’s sensory organs.[170][171]
Chůze

Like many other hexapod insects, Drosophila typically walk using a tripod gait.[173] This means that three of the legs swing together while the other three remain stationary, or in stance. Variability around the tripod configuration appears to be continuous, meaning that flies do not exhibit distinct transitions between different gaits.[174] At fast walking speeds (15–30 mm/s), the walking configuration is mostly tripod (3 legs in stance), but at low walking speeds (0–15 mm/s), flies are more likely to have four or five legs in stance.[175][176] These transitions may help to optimize static stability.[177] Because flies are so small, inertial forces are negligible compared with the elastic forces of their muscles and joints or the viscous forces of the surrounding air.[178]
In addition to stability, the robustness of a walking gait is also thought to be important in determining the gait of a fly at a particular walking speed. Robustness refers to how much offset in the timing of a legs stance can be tolerated before the fly becomes statically unstable.[177] For instance, a robust gait may be particularly important when traversing uneven terrain, as it may cause unexpected disruptions in leg coordination. Using a robust gait would help the fly maintain stability in this case. Analyses suggest that Drosophila may exhibit a compromise between the most stable and most robust gait at a given walking speed.[177]
Let
Flies fly via straight sequences of movement interspersed by rapid turns called saccades.[179] During these turns, a fly is able to rotate 90° in less than 50 milliseconds.[179]
Charakteristika Drosophila flight may be dominated by the viskozita of the air, rather than the setrvačnost of the fly body, but the opposite case with inertia as the dominant force may occur.[179] However, subsequent work showed that while the viscous effects on the insect body during flight may be negligible, the aerodynamic forces on the wings themselves actually cause fruit flies' turns to be damped viscously.[180]
Mylné představy
Drosophila is sometimes referred to as a pest due to its tendency to live in human settlements, where fermenting fruit is found. Flies may collect in homes, restaurants, stores, and other locations.[7] Nicméně proto Drosophila do not transmit human disease and are essentially harmless, they do not fulfill the criteria to be classified as a škůdce.
The name and behavior of this species of fly has led to the misconception that it is a biological security risk in Australia. While other "fruit fly" species do pose a risk, the D. melanogaster is attracted to fruit that is already rotting, rather than causing fruit to rot.[181][182]
Viz také
- Zkoušky na zvířatech na bezobratlých
- Eating behavior in Insects#Measurement
- Geneticky modifikovaný hmyz
- Gynandromorfismus
- List of Drosophila databases
- Spätzle (gen)
- Transgeneze
- Zebrafish – another widely used modelový organismus in scientific research
Reference
- ^ Meigen JW (1830). Systematische Beschreibung der bekannten europäischen zweiflügeligen Insekten. (Svazek 6) (PDF) (v němčině). Schulz-Wundermann. Archivovány od originál (PDF) dne 02.02.2012.
- ^ „Nobelovy ceny“. Opatrovník.
- ^ "FruitFly-ResearchGate".
- ^ A b Sang JH (2001-06-23). "Drosophila melanogaster: The Fruit Fly". In Reeve EC (ed.). Encyclopedia of genetics. USA: Fitzroy Dearborn Publishers, I. p. 157. ISBN 978-1-884964-34-3. Citováno 2009-07-01.
- ^ Baudry E, Viginier B, Veuille M (August 2004). "Non-African populations of Drosophila melanogaster have a unique origin". Molekulární biologie a evoluce. 21 (8): 1482–91. doi:10.1093/molbev/msh089. PMID 15014160.
- ^ A b Markow TA (June 2015). "The secret lives of Drosophila flies". eLife. 4. doi:10.7554/eLife.06793. PMC 4454838. PMID 26041333.
- ^ A b "Vinegar Flies, Drosophila species, Family: Drosophilidae". Department of Entomology, College of Agricultural Sciences, Pennsylvania State University. 2017. Citováno 20. července 2017.
- ^ A b Ewart GD, Howells AJ (1998-01-01). "ABC transporters involved in transport of eye pigment precursors in Drosophila melanogaster". Metody v enzymologii. ABC Transporters: Biochemical, Cellular, and Molecular Aspects. Akademický tisk. 292: 213–24. doi:10.1016/S0076-6879(98)92017-1. ISBN 9780121821937. PMID 9711556.
- ^ "FlyBase: A database of Drosophila genes and genomes". Genetická společnost Ameriky. 2009. Archivovány od originál dne 15. srpna 2009. Citováno 11. srpna 2009.
- ^ Linford NJ, Bilgir C, Ro J, Pletcher SD (January 2013). "Measurement of lifespan in Drosophila melanogaster". Žurnál vizualizovaných experimentů (71). doi:10.3791/50068. PMC 3582515. PMID 23328955.
- ^ A b C d E F G Ashburner M, Thompson JN (1978). "The laboratory culture of Drosophila ". In Ashburner M, Wright TRF (ed.). The genetics and biology of Drosophila. 2A. Akademický tisk. 1–81.
- ^ A b C d E F G Ashburner M, Golic KG, Hawley RS (2005). Drosophila: A Laboratory Handbook (2. vyd.). Cold Spring Harbor Laboratory Press. str. 162–4. ISBN 978-0-87969-706-8.
- ^ Bloomington Drosophila Stock Center na Indiana University: Basic Methods of Culturing Drosophila Archivováno 2006-09-01 na Wayback Machine
- ^ A b Chiang HC, Hodson AC (1950). "An analytical study of population growth in Drosophila melanogaster". Ekologické monografie. 20 (3): 173–206. doi:10.2307/1948580. JSTOR 1948580.
- ^ Bakker K (1961). "An analysis of factors which determine success in competition for food among larvae of Drosophila melanogaster". Archivy Néerlandaises de Zoologie. 14 (2): 200–281. doi:10.1163/036551661X00061.
- ^ Fernández-Moreno MA, Farr CL, Kaguni LS, Garesse R (2007). "Drosophila melanogaster as a model system to study mitochondrial biology". Mitochondrie. Methods in Molecular Biology (Clifton, N.J.). 372. 33–49. doi:10.1007/978-1-59745-365-3_3. ISBN 978-1-58829-667-2. PMC 4876951. PMID 18314716.
- ^ Blum JE, Fischer CN, Miles J, Handelsman J (listopad 2013). „Časté doplňování udržuje prospěšný mikrobiom Drosophila melanogaster“. mBio. 4 (6): e00860-13. doi:10.1128/mBio.00860-13. PMC 3892787. PMID 24194543.
- ^ Cook R, Connolly K (1973). "Rejection Responses by Female Drosophila melanogaster: Their Ontogeny, Causality and Effects upon the Behaviour of the Courting Male". Chování. 44 (1/2): 142–166. doi:10.1163/156853973x00364. JSTOR 4533484. S2CID 85393769.
- ^ Houot B, Svetec N, Godoy-Herrera R, Ferveur JF (July 2010). "Effect of laboratory acclimation on the variation of reproduction-related characters in Drosophila melanogaster". The Journal of Experimental Biology. 213 (Pt 13): 2322–31. doi:10.1242/jeb.041566. PMID 20543131.
- ^ Gilbert SF (2006). "9: Fertilization in Drosophila". In 8th (ed.). Vývojová biologie. Sinauer Associates. ISBN 978-0-87893-250-4. Archivovány od originál dne 07.02.2007.
- ^ A b C Price CS, Dyer KA, Coyne JA (July 1999). "Sperm competition between Drosophila males involves both displacement and incapacitation". Příroda. 400 (6743): 449–52. Bibcode:1999Natur.400..449P. doi:10.1038/22755. PMID 10440373. S2CID 4393369.
- ^ A b C d "Fruit fly research may reveal what happens in female brains during courtship, mating". Citováno 5. října 2014.
- ^ Meiselman M, Lee SS, Tran RT, Dai H, Ding Y, Rivera-Perez C, et al. (Květen 2017). "Drosophila melanogaster". Sborník Národní akademie věd Spojených států amerických. 114 (19): E3849–E3858. doi:10.1073/pnas.1620760114. PMC 5441734. PMID 28439025.
- ^ Moshitzky P, Fleischmann I, Chaimov N, Saudan P, Klauser S, Kubli E, Applebaum SW (1996). "Sex-peptide activates juvenile hormone biosynthesis in the Drosophila melanogaster corpus allatum". Archiv biochemie a fyziologie hmyzu. 32 (3–4): 363–74. doi:10.1002/(SICI)1520-6327(1996)32:3/4<363::AID-ARCH9>3.0.CO;2-T. PMID 8756302.
- ^ Carnes MU, Campbell T, Huang W, Butler DG, Carbone MA, Duncan LH, et al. (2015). "The Genomic Basis of Postponed Senescence in Drosophila melanogaster". PLOS ONE. 10 (9): e0138569. Bibcode:2015PLoSO..1038569C. doi:10.1371/journal.pone.0138569. PMC 4574564. PMID 26378456.
- ^ Cassidy D, Epiney DG, Salameh C, Zhou LT, Salomon RN, Schirmer AE, et al. (Listopad 2019). "Evidence for premature aging in a Drosophila model of Werner syndrome". Experimentální gerontologie. 127: 110733. doi:10.1016/j.exger.2019.110733. PMC 6935377. PMID 31518666.
- ^ Pitnick S (1996). "Investment in testes and the cost of making long sperm in Drosophila". Americký přírodovědec. 148: 57–80. doi:10.1086/285911. S2CID 83654824.
- ^ Dagaeff AC, Pocheville A, Nöbel S, Loyau A, Isabel G, Danchin E (2016). "Drosophila mate copying correlates with atmospheric pressure in a speed learning situation". Chování zvířat. 121: 163–174. doi:10.1016/j.anbehav.2016.08.022.
- ^ Dukas R (2004). "Male fruit flies learn to avoid interspecific courtship". Ekologie chování. 15 (4): 695–698. doi:10.1093/beheco/arh068.
- ^ Saleem S, Ruggles PH, Abbott WK, Carney GE (2014). "Sexual experience enhances Drosophila melanogaster male mating behavior and success". PLOS ONE. 9 (5): e96639. Bibcode:2014PLoSO...996639S. doi:10.1371/journal.pone.0096639. PMC 4013029. PMID 24805129.
- ^ A b Haartman Lv (1951). "Postupná polygamie". Chování. 3 (1): 256–273. doi:10.1163 / 156853951x00296.
- ^ A b C d E F G Vartak VR, Varma V, Sharma VK (February 2015). "Effects of polygamy on the activity/rest rhythm of male fruit flies Drosophila melanogaster". Die Naturwissenschaften. 102 (1–2): 1252. Bibcode:2015SciNa.102....3V. doi:10.1007/s00114-014-1252-5. PMID 25604736. S2CID 7529509.
- ^ A b Bateman AJ (December 1948). "Intra-sexual selection in Drosophila". Dědičnost. 2 (Pt. 3): 349–68. doi:10.1038/hdy.1948.21. PMID 18103134.
- ^ A b Pierce BA (2004). Genetika: koncepční přístup (2. vyd.). W. H. Freeman. ISBN 978-0-7167-8881-2.
- ^ Kilbey BJ, MacDonald DJ, Auerbach C, Sobels FH, Vogel EW (June 1981). "The use of Drosophila melanogaster in tests for environmental mutagens". Mutační výzkum. 85 (3): 141–6. doi:10.1016/0165-1161(81)90029-7. PMID 6790982.
- ^ A b Adams MD, Celniker SE, Holt RA, Evans CA, Gocayne JD, Amanatides PG, et al. (Březen 2000). "The genome sequence of Drosophila melanogaster". Věda. 287 (5461): 2185–95. Bibcode:2000Sci...287.2185.. CiteSeerX 10.1.1.549.8639. doi:10.1126/science.287.5461.2185. PMID 10731132.
- ^ A b C Hotta Y, Benzer S (December 1972). "Mapping of behaviour in Drosophila mosaics". Příroda. 240 (5383): 527–35. Bibcode:1972Natur.240..527H. doi:10.1038/240527a0. PMID 4568399. S2CID 4181921.
- ^ Azpiazu N, Frasch M (July 1993). "tinman and bagpipe: two homeo box genes that determine cell fates in the dorsal mesoderm of Drosophila". Geny a vývoj. 7 (7B): 1325–40. doi:10.1101/gad.7.7b.1325. PMID 8101173.
- ^ Stern DL, Frankel N (December 2013). "The structure and evolution of cis-regulatory regions: the shavenbaby story". Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 368 (1632): 20130028. doi:10.1098/rstb.2013.0028. PMC 3826501. PMID 24218640.
- ^ Winberg JO, McKinley-McKee JS (February 1998). "Drosophila melanogaster alcohol dehydrogenase: mechanism of aldehyde oxidation and dismutation". The Biochemical Journal. 329 ( Pt 3) (Pt 3): 561–70. doi:10.1042/bj3290561. PMC 1219077. PMID 9445383.
- ^ A b Ogueta M, Cibik O, Eltrop R, Schneider A, Scholz H (November 2010). "The influence of Adh function on ethanol preference and tolerance in adult Drosophila melanogaster". Chemické smysly. 35 (9): 813–22. doi:10.1093/chemse/bjq084. PMID 20739429.
- ^ A b Park A, Ghezzi A, Wijesekera TP, Atkinson NS (August 2017). "Genetics and genomics of alcohol responses in Drosophila". Neurofarmakologie. 122: 22–35. doi:10.1016/j.neuropharm.2017.01.032. PMC 5479727. PMID 28161376.
- ^ Bayliak MM, Shmihel HV, Lylyk MP, Storey KB, Lushchak VI (September 2016). "Alpha-ketoglutarate reduces ethanol toxicity in Drosophila melanogaster by enhancing alcohol dehydrogenase activity and antioxidant capacity". Alkohol. 55: 23–33. doi:10.1016/j.alcohol.2016.07.009. PMID 27788775.
- ^ "FlyBase Gene Report: DmelAdh". flybase.org. Citováno 2019-03-26.
- ^ Gao HH, Zhai YF, Chen H, Wang YM, Liu Q, Hu QL, Ren FS, Yu Y (September 2018). "Ecological Niche Difference Associated with Varied Ethanol Tolerance between Drosophila suzukii and Drosophila melanogaster (Diptera: Drosophilidae)". Florida entomolog. 101 (3): 498–504. doi:10.1653/024.101.0308. ISSN 0015-4040.
- ^ Parsch J, Russell JA, Beerman I, Hartl DL, Stephan W (September 2000). "Deletion of a conserved regulatory element in the Drosophila Adh gene leads to increased alcohol dehydrogenase activity but also delays development". Genetika. 156 (1): 219–27. PMC 1461225. PMID 10978287.
- ^ A b Phillips AM, Smart R, Strauss R, Brembs B, Kelly LE (May 2005). "The Drosophila black enigma: the molecular and behavioural characterization of the black1 mutant allele" (PDF). Gen. 351: 131–42. doi:10.1016/j.gene.2005.03.013. PMID 15878647.
- ^ A b "FlyBase Gene Report: Dmel b". flybase.org. Citováno 2019-03-26.
- ^ Sherald AF (září 1981). „Intergenní potlačení černé mutace Drosophila melanogaster“. Molekulární a obecná genetika. 183 (1): 102–6. doi:10.1007 / bf00270146. PMID 6799739. S2CID 1210971.
- ^ Shoup JR (květen 1966). „Vývoj pigmentových granulí v očích divokého typu a mutantního druhu Drosophila melanogaster“. The Journal of Cell Biology. 29 (2): 223–49. doi:10.1083 / jcb.29.2.223. PMC 2106902. PMID 5961338.
- ^ „REFERENČNÍ STRÁNKA PRO UČITELE PIGMENTY OČÍ OČÍ“ (PDF).[nespolehlivý zdroj? ]
- ^ Morgan TH (březen 1911). „Původ mutací devíti křídel v Drosophile“. Věda. 33 (848): 496–9. Bibcode:1911Sci .... 33..496M. doi:10.1126 / science.33.848.496. JSTOR 1638587. PMID 17774436.
- ^ "FlyBase Gene Report: Dmel m". flybase.org. Citováno 2019-03-26.
- ^ Bilousov OO, Katanaev VL, Demydov SV, Kozeretska IA (březen – duben 2013). „Downregulace miniaturního genu nereplikuje miniaturní fenotypy ztráty funkce v křídle Drosophila melanogaster v plném rozsahu“. TSitologiia I Genetika. 47 (2): 77–81. PMID 23745366.
- ^ A b Kim J, Suh H, Kim S, Kim K, Ahn C, Yim J (září 2006). „Identifikace a charakteristika strukturního genu pro sépiovou mutantní oční barvu Drosophila kódující PDA syntázu, člena glutathion-S-transferázy třídy omega“. The Biochemical Journal. 398 (3): 451–60. doi:10.1042 / BJ20060424. PMC 1559464. PMID 16712527.
- ^ A b C Grant P, Maga T, Loshakov A, Singhal R, Wali A, Nwankwo J a kol. (Říjen 2016). „Oko na obchodování s geny: identifikace čtyř barevných mutací očí v Drosophile“. G3. 6 (10): 3185–3196. doi:10,1534 / g3,116,032508. PMC 5068940. PMID 27558665.
- ^ „Dědičné vzory v Drosophila Melanogaster“. Citováno 26. března 2019.
- ^ A b Zelená MM (duben 1952). „Mutant Isoalleles at the Vermilion Locus in Drosophila Melanogaster“. Sborník Národní akademie věd Spojených států amerických. 38 (4): 300–5. Bibcode:1952PNAS ... 38..300G. doi:10.1073 / pnas.38.4.300. PMC 1063551. PMID 16589094.
- ^ Oxenkrug, Gregory F. (leden 2010). „Prodloužená životnost mutantů Drosophila melanogaster (bílé a rumělkové) s narušenou tvorbou kynureninu“. Journal of Neural Transmission. 117 (1): 23–26. doi:10.1007 / s00702-009-0341-7. ISSN 0300-9564. PMC 3013506. PMID 19941150.
- ^ Simon E, Faucheux C, Zider A, Thézé N, Thiébaud P (červenec 2016). „Od zakrnělého k zakrnělému: gen Drosophila, který získal křídlo“. Vývojové geny a evoluce. 226 (4): 297–315. doi:10.1007 / s00427-016-0546-3. PMID 27116603. S2CID 16651247.
- ^ Tomoyasu Y, Ohde T, Clark-Hachtel C (2017-03-14). „Jaké sériové homology nám mohou říci o původu hmyzích křídel?“. F1000Výzkum. 6: 268. doi:10.12688 / F1000Research.10285.1. PMC 5357031. PMID 28357056.
- ^ Williams JA, Bell JB, Carroll SB (prosinec 1991). „Kontrola vývoje křídla a halter Drosophila produktem jaderného zakrnělého genu“. Geny a vývoj. 5 (12B): 2481–95. doi:10,1101 / gad. 5,12b.2481. PMID 1752439.
- ^ Zelený MM (leden 2010). „2010: Století genetiky Drosophila prostřednictvím hranolu bílého genu“. Genetika. 184 (1): 3–7. doi:10.1534 / genetika.109.110015. PMC 2815926. PMID 20061564.
- ^ Ferreiro MJ, Pérez C, Marchesano M, Ruiz S, Caputi A, Aguilera P a kol. (2018). „Rosophila melanogaster White Mutant w1118 Undergo Retinal Degeneration“. Frontiers in Neuroscience. 11: 732. doi:10.3389 / fnins.2017.00732. PMC 5758589. PMID 29354028.
- ^ A b Xiao C, Qiu S, Robertson RM (srpen 2017). „Bílý gen řídí úspěch kopulace u Drosophila melanogaster“. Vědecké zprávy. 7 (1): 7712. Bibcode:2017NatSR ... 7,7712X. doi:10.1038 / s41598-017-08155-r. PMC 5550479. PMID 28794482.
- ^ „Gene: Dmel y“. Flybase.org. Konsorcium FlyBase. Citováno 26. března 2019.
- ^ Wittkopp PJ, True JR, Carroll SB (duben 2002). „Vzájemné funkce žlutých a ebenových proteinů Drosophila ve vývoji a vývoji pigmentových vzorů“. Rozvoj. 129 (8): 1849–58. PMID 11934851.
- ^ A b Biessmann H (listopad 1985). "Molekulární analýza oblasti žlutého genu Drosophila melanogaster". Sborník Národní akademie věd Spojených států amerických. 82 (21): 7369–73. Bibcode:1985PNAS ... 82,7369B. doi:10.1073 / pnas.82.21.7369. PMC 391346. PMID 3933004.
- ^ „Databáze genomu NCBI (Národní centrum pro biotechnologické informace)“. Citováno 2011-11-30.
- ^ Halligan DL, Keightley PD (červenec 2006). „Všudypřítomná selektivní omezení v genomu Drosophila odhalená mezidruhovým porovnáním v celém genomu“. Výzkum genomu. 16 (7): 875–84. doi:10,1101 / gr. 5022906. PMC 1484454. PMID 16751341.
- ^ Carvalho AB (prosinec 2002). "Původ a vývoj chromozomu Drosophila Y". Aktuální názor na genetiku a vývoj. 12 (6): 664–8. doi:10.1016 / S0959-437X (02) 00356-8. PMID 12433579.
- ^ „Pozadí srovnávací genomické analýzy“. Americký národní institut pro výzkum lidského genomu. Prosinec 2002.
- ^ Reiter LT, Potocki L, Chien S, Gribskov M, Bier E (červen 2001). „Systematická analýza genových sekvencí souvisejících s lidským onemocněním v Drosophila melanogaster“. Výzkum genomu. 11 (6): 1114–25. doi:10.1101 / gr.169101. PMC 311089. PMID 11381037.
- ^ Chien S, Reiter LT, Bier E, Gribskov M (leden 2002). "Homophila: gen lidské nemoci je příbuzný s Drosophila". Výzkum nukleových kyselin. 30 (1): 149–51. doi:10.1093 / nar / 30.1.149. PMC 99119. PMID 11752278.
- ^ Jaiswal M, Sandoval H, Zhang K, Bayat V, Bellen HJ (2012). „Sondovací mechanismy, které jsou základem lidských neurodegenerativních onemocnění v Drosophile“. Výroční přehled genetiky. 46: 371–96. doi:10.1146 / annurev-genet-110711-155456. PMC 3663445. PMID 22974305.
- ^ Vyberte L (2017). Fly modely lidských nemocí. Svazek 121 aktuálních témat ve vývojové biologii. Akademický tisk. ISBN 978-0-12-802905-3.
- ^ Buchon N, Silverman N, Cherry S (prosinec 2014). „Imunita v Drosophila melanogaster - od mikrobiálního rozpoznání po fyziologii celého organismu“. Recenze přírody. Imunologie. 14 (12): 796–810. doi:10.1038 / nri3763. PMC 6190593. PMID 25421701.
- ^ Kaun KR, Devineni AV, Heberlein U (červen 2012). „Drosophila melanogaster jako model ke studiu drogové závislosti“. Genetika člověka. 131 (6): 959–75. doi:10.1007 / s00439-012-1146-6. PMC 3351628. PMID 22350798.
- ^ Chiang AS, Lin CY, Chuang CC, Chang HM, Hsieh CH, Yeh CW a kol. (Leden 2011). „Trojrozměrná rekonstrukce kabelových sítí v celém mozku v Drosophile při rozlišení jedné buňky“. Aktuální biologie. 21 (1): 1–11. doi:10.1016 / j.cub.2010.11.056. PMID 21129968. S2CID 17155338.
- ^ „FlyCircuit - databáze mozkových neuronů Drosophila“. Citováno 30. srpna 2013.
- ^ Meinertzhagen IA, O'Neil SD (březen 1991). "Synaptická organizace sloupcových prvků v lamině divokého typu v Drosophila melanogaster". The Journal of Comparative Neurology. 305 (2): 232–63. doi:10,1002 / k.903050206. PMID 1902848. S2CID 35301798.
- ^ Rivera-Alba M, Vitaladevuni SN, Mishchenko Y, Mischenko Y, Lu Z, Takemura SY a kol. (Prosinec 2011). "Ekonomika elektroinstalace a vyloučení objemu určují umístění neuronů v mozku Drosophila". Aktuální biologie. 21 (23): 2000–5. doi:10.1016 / j.cub.2011.10.022. PMC 3244492. PMID 22119527.
- ^ Takemura SY, Bharioke A, Lu Z, Nern A, Vitaladevuni S, Rivlin PK a kol. (Srpen 2013). „Vizuální obvod pro detekci pohybu navržený společností Drosophila connectomics“. Příroda. 500 (7461): 175–81. Bibcode:2013 Natur.500..175T. doi:10.1038 / příroda12450. PMC 3799980. PMID 23925240.
- ^ Takemura SY, Aso Y, Hige T, Wong A, Lu Z, Xu CS a kol. (Červenec 2017). "Mozek Drosophila". eLife. 6: e26975. doi:10,7554 / eLife.26975. PMC 5550281. PMID 28718765.
- ^ „Celý mozek ovocných mušek zobrazený elektronovou mikroskopií“. Scientist Magazine®. Citováno 2018-07-15.
- ^ Zheng Z, Lauritzen JS, Perlman E, Robinson CG, Nichols M, Milkie D a kol. (Červenec 2018). „Kompletní objem elektronové mikroskopie mozku dospělých Drosophila melanogaster“. Buňka. 174 (3): 730–743.e22. doi:10.1101/140905. PMC 6063995. PMID 30033368.
- ^ Xu CS, Januszewski M, Lu Z, Takemura SY, Hayworth K, Huang G, Shinomiya K, Maitin-Shepard J, Ackerman D, Berg S, Blakely T a kol. (2020). „Konektom dospělého Drosophila centrální mozek ". bioRxiv. Laboratoř Cold Spring Harbor: 2020.01.21.911859. doi:10.1101/2020.01.21.911859. S2CID 213140797.
- ^ „Analytické nástroje pro konektomiku“. HHMI.
- ^ Scheffer LK, Xu CS, Januszewski M, Lu Z, Takemura SY, Hayworth KJ, Huang G, Shinomiya K, Maitlin-Shepard J, Berg S, Clements J a kol. (2020). „Konektomie a analýza dospělého Drosophila Centrální mozek ". bioRxiv. Cold Spring Harbor. 9. doi:10.1101/2020.04.07.030213. PMC 7546738. PMID 32880371. S2CID 215790785.
- ^ A b Weigmann K, Klapper R, Strasser T, Rickert C, Technau G, Jäckle H a kol. (Červen 2003). „FlyMove - nový způsob pohledu na vývoj Drosophily“. Trendy v genetice. 19 (6): 310–1. doi:10.1016 / S0168-9525 (03) 00050-7. PMID 12801722.
- ^ West-Eberhard MJ (květen 2005). „Vývojová plasticita a původ druhových rozdílů“. Sborník Národní akademie věd Spojených států amerických. 102 Suppl 1 (doplněk 1): 6543–9. Bibcode:2005PNAS..102,6543 W.. doi:10.1073 / pnas.0501844102. PMC 1131862. PMID 15851679.
- ^ A b C Abram PK, Boivin G, Moiroux J, Brodeur J (listopad 2017). „Behavioural effects of temperature on ectothermic animals: unifying tepelné fyziologie and behavioral plasticity“. Biologické recenze Cambridge Philosophical Society. 92 (4): 1859–1876. doi:10.1111 / brv.12312. PMID 28980433. S2CID 9099834.
- ^ Gibert P, Huey RB, Gilchrist GW (leden 2001). "Lokomotorický výkon Drosophila melanogaster: interakce mezi vývojovými a dospělými teplotami, věkem a geografií". Vývoj; International Journal of Organic Evolution. 55 (1): 205–9. doi:10.1111 / j.0014-3820.2001.tb01286.x. PMID 11263741. S2CID 2991855.
- ^ A b C Zamudio KR, Huey RB, Crill WD (1995). „Větší není vždy lepší: velikost těla, vývojová a rodičovská teplota a územní úspěch u Drosophila melanogaster.“ Chování zvířat. 49 (3): 671–677. doi:10.1016/0003-3472(95)80200-2. ISSN 0003-3472. S2CID 9124942.
- ^ Harrison JF, Waters JS, Biddulph TA, Kovacevic A, Klok CJ, Socha JJ (duben 2018). „Vývojová plasticita a stabilita v tracheálních sítích zásobujících letový sval Drosophila v reakci na odchov kyslíku“. Journal of Insect Physiology. Meze funkce dýchání: vnější a vnitřní omezení výměny hmyzích plynů. 106 (Pt 3): 189–198. doi:10.1016 / j.jinsphys.2017.09.006. PMID 28927826.
- ^ Sheeba V, Chandrashekaran MK, Joshi A, Sharma VK (leden 2002). "Vývojová plasticita rytmu pohybové aktivity Drosophila melanogaster". Journal of Insect Physiology. 48 (1): 25–32. doi:10.1016 / S0022-1910 (01) 00139-1. PMID 12770129.
- ^ A b C d Crill WD, Huey RB, Gilchrist GW (červen 1996). „Mezigenerační a mezigenerační účinky teploty na morfologii a fyziologii Drosophila Melanogaster“. Vývoj; International Journal of Organic Evolution. 50 (3): 1205–1218. doi:10.2307/2410661. JSTOR 2410661. PMID 28565273.
- ^ A b David JR, Araripe LO, Chakir M, Legout H, Lemos B, Pétavy G a kol. (Červenec 2005). „Mužská sterilita při extrémních teplotách: významný, ale opomíjený jev pro pochopení klimatických adaptací Drosophila“. Journal of Evolutionary Biology. 18 (4): 838–46. doi:10.1111 / j.1420-9101.2005.00914.x. PMID 16033555. S2CID 23847613.
- ^ French V, Feast M, Partridge L (listopad 1998). "Velikost těla a velikost buněk v Drosophila: vývojová reakce na teplotu". Journal of Insect Physiology. 44 (11): 1081–1089. doi:10.1016 / S0022-1910 (98) 00061-4. PMID 12770407.
- ^ Frazier MR, Harrison JF, Kirkton SD, Roberts SP (červenec 2008). „Odchov za studena zlepšuje výkonnost letu za studena u Drosophily změnami morfologie křídla“. The Journal of Experimental Biology. 211 (Pt 13): 2116–22. doi:10.1242 / jeb.019422. PMID 18552301.
- ^ A b Slotsbo S, Schou MF, Kristensen TN, Loeschcke V, Sørensen JG (září 2016). „Reverzibilita vývojového tepla a studené plasticity je asymetrická a má dlouhodobé důsledky pro tepelnou toleranci dospělých“. The Journal of Experimental Biology. 219 (Pt 17): 2726–32. doi:10.1242 / jeb.143750. PMID 27353229.
- ^ Gilchrist GW, Huey RB (leden 2001). „Vliv rodičů a teploty na vývoj na tepelnou závislost kondice u Drosophila melanogaster“. Vývoj; International Journal of Organic Evolution. 55 (1): 209–14. doi:10.1111 / j.0014-3820.2001.tb01287.x. PMID 11263742. S2CID 1329035.
- ^ Austin CJ, Moehring AJ (květen 2013). "Optimální teplotní rozsah druhu plastu, Drosophila simulans". The Journal of Animal Ecology. 82 (3): 663–72. doi:10.1111/1365-2656.12041. PMID 23360477.
- ^ A b Hodin J, Riddiford LM (říjen 2000). "Různé mechanismy jsou základem fenotypové plasticity a mezidruhové variace reprodukčního charakteru u drosofilidů (Insecta: Diptera)". Vývoj; International Journal of Organic Evolution. 54 (5): 1638–53. doi:10.1111 / j.0014-3820.2000.tb00708.x. PMID 11108591. S2CID 6875815.
- ^ Klepsatel P, Girish TN, Dircksen H, Gáliková M (květen 2019). „Drosophila je maximalizována optimální vývojovou teplotou“. The Journal of Experimental Biology. 222 (Pt 10): jeb202184. doi:10.1242 / jeb.202184. PMID 31064855.
- ^ Schou MF, Kristensen TN, Pedersen A, Karlsson BG, Loeschcke V, Malmendal A (únor 2017). "Metabolická a funkční charakterizace účinků vývojové teploty u Drosophila melanogaster". American Journal of Physiology. Regulační, integrační a srovnávací fyziologie. 312 (2): R211 – R222. doi:10.1152 / ajpregu.00268.2016. PMC 5336569. PMID 27927623.
- ^ Cohet Y, David J (leden 1978). „Kontrola reprodukčního potenciálu dospělých preimaginálními tepelnými podmínkami: Studie u Drosophila melanogaster“. Ekologie. 36 (3): 295–306. Bibcode:1978Ocol..36..295C. doi:10.1007 / BF00348055. PMID 28309916. S2CID 12465060.
- ^ Rideout EJ, Narsaiya MS, Grewal SS (prosinec 2015). „Genový transformátor pro stanovení pohlaví reguluje rozdíly mezi velikostí těla Drosophila mezi muži a ženami“. Genetika PLOS. 11 (12): e1005683. doi:10.1371 / journal.pgen.1005683. PMC 4692505. PMID 26710087.
- ^ Gilbert SF (2000). Vývojová biologie (6. vydání). Sunderland (MA): Sinauer Associates; 2000.
- ^ A b C Lemaitre B, Hoffmann J (2007). „Hostitelská obrana Drosophila melanogaster“ (PDF). Výroční přehled imunologie. 25: 697–743. doi:10.1146 / annurev.immunol.25.022106.141615. PMID 17201680.
- ^ Troha K, Im JH, Revah J, Lazzaro BP, Buchon N (únor 2018). „Srovnávací transkriptomika odhalují CrebA jako nového regulátora tolerance k infekci u D. melanogaster“. PLOS patogeny. 14 (2): e1006847. doi:10.1371 / journal.ppat.1006847. PMC 5812652. PMID 29394281.
- ^ De Gregorio E, Spellman PT, Tzou P, Rubin GM, Lemaitre B (červen 2002). „Cesty Toll a Imd jsou hlavními regulátory imunitní odpovědi u Drosophily“. Časopis EMBO. 21 (11): 2568–79. doi:10.1093 / emboj / 21.11.2568. PMC 126042. PMID 12032070.
- ^ Paredes JC, Welchman DP, Poidevin M, Lemaitre B (listopad 2011). „Negativní regulace amidázovými PGRP formuje antibakteriální reakci Drosophila a chrání mouchu před neškodnou infekcí“ (PDF). Imunita. 35 (5): 770–9. doi:10.1016 / j.immuni.2011.09.018. PMID 22118526.
- ^ Troha K, Buchon N (září 2019). "Metody pro studium vrozené imunity u Drosophila melanogaster". Wiley Interdisciplinární hodnocení. Vývojová biologie. 8 (5): e344. doi:10,1002 / wdev.344. PMID 30993906. S2CID 119527642.
- ^ Gilbert R, Torres M, Clemens R, Hateley S, Hosamani R, Wade W, Bhattacharya S (únor 2020). „Model infekce Drosophila melanogaster“. Mikrogravitace NPJ. 6 (1): 4. doi:10.1038 / s41526-019-0091-2. PMC 7000411. PMID 32047838.
- ^ Valanne S, Wang JH, Rämet M (leden 2011). „Drosophila Toll signální cesta“. Journal of Immunology. 186 (2): 649–56. doi:10,4049 / jimmunol. 1002302. PMID 21209287.
- ^ A b Dudzic JP, Hanson MA, Iatsenko I, Kondo S, Lemaitre B (duben 2019). „Více než černá nebo bílá: Melanizace a mýtné sdílejí regulační serinové proteázy v Drosophile“. Zprávy buněk. 27 (4): 1050–1061.e3. doi:10.1016 / j.celrep.2019.03.101. PMID 31018123.
- ^ Hanson MA, Hamilton PT, Perlman SJ (říjen 2016). "Imunitní geny a odlišné antimikrobiální peptidy u much podrodů Drosophila". BMC Evoluční biologie. 16 (1): 228. doi:10.1186 / s12862-016-0805-r. PMC 5078906. PMID 27776480.
- ^ Lemaitre B, Nicolas E, Michaut L, Reichhart JM, Hoffmann JA (září 1996). „Dorsoventrální regulační genová kazeta spätzle / Toll / kaktus řídí silnou antifungální odpověď u dospělých Drosophila“ (PDF). Buňka. 86 (6): 973–83. doi:10.1016 / s0092-8674 (00) 80172-5. PMID 8808632. S2CID 10736743.
- ^ „Nobelova cena za fyziologii nebo medicínu 2011“. NobelPrize.org. Citováno 2020-09-05.
- ^ Issa N, Guillaumot N, Lauret E, Matt N, Schaeffer-Reiss C, Van Dorsselaer A a kol. (Únor 2018). „Cirkulující proteáza persefon je imunitní senzor pro mikrobiální proteolytické aktivity před cestou mýtného Drosophila“. Molekulární buňka. 69 (4): 539–550.e6. doi:10.1016 / j.molcel.2018.01.029. PMC 5823974. PMID 29452635.
- ^ Clemmons AW, Lindsay SA, Wasserman SA (duben 2015). „Rodina efektorových peptidů potřebná pro imunitu zprostředkovanou mýtem Drosophila“. PLOS patogeny. 11 (4): e1004876. doi:10.1371 / journal.ppat.1004876. PMC 4411088. PMID 25915418.
- ^ Lindsay SA, Lin SJ, Wasserman SA (2018). „Bomaniny v krátké formě zprostředkovávají humorální imunitu v Drosophile“. Journal of Innate Immunity. 10 (4): 306–314. doi:10.1159/000489831. PMC 6158068. PMID 29920489.
- ^ Yamamoto-Hino M, Goto S (květen 2016). „Spätzle-processing Enzyme-independent Activation of the Toll Pathway in Drosophila Innate Immunity“. Struktura a funkce buněk. 41 (1): 55–60. doi:10.1247 / csf.16002. PMID 26843333.
- ^ Troha K, Nagy P, Pivovar A, Lazzaro BP, Hartley PS, Buchon N (říjen 2019). „Nefrocyty odstraňují ze systémového oběhu peptidoglykan odvozený z mikrobioty k udržení imunitní homeostázy“. Imunita. 51 (4): 625–637.e3. doi:10.1016 / j.immuni.2019.08.020. PMID 31564469.
- ^ Hanson MA, Dostálová A, Ceroni C, Poidevin M, Kondo S, Lemaitre B (únor 2019). „Synergie a pozoruhodná specificita antimikrobiálních peptidů in vivo pomocí systematického knockout přístupu“. eLife. 8. doi:10,7554 / eLife.44341. PMC 6398976. PMID 30803481.
- ^ Zhai Z, Boquete JP, Lemaitre B (červen 2017). "Genetický rámec kontrolující diferenciaci střevních kmenových buněk během regenerace v Drosophila". Genetika PLOS. 13 (6): e1006854. doi:10.1371 / journal.pgen.1006854. PMC 5510897. PMID 28662029.
- ^ Nandy A, Lin L, Velentzas PD, Wu LP, Baehrecke EH, Silverman N (listopad 2018). „NF-κB Factor Relish reguluje expresi Atg1 a řídí autofagii“. Zprávy buněk. 25 (8): 2110–2120.e3. doi:10.1016 / j.celrep.2018.10.076. PMC 6329390. PMID 30463009.
- ^ Hanson MA, Lemaitre B (únor 2020). „Nové poznatky o funkci antimikrobiálního peptidu Drosophila v obraně hostitele i mimo ni“. Aktuální názor na imunologii. 62: 22–30. doi:10.1016 / j.coi.2019.11.008. PMID 31835066.
- ^ Kounatidis I, Chtarbanova S (2018). „Perspektiva Drosophila“. Hranice v imunologii. 9: 1362. doi:10.3389 / fimmu.2018.01362. PMC 6004738. PMID 29942319.
- ^ Cao Y, Chtarbanova S, Petersen AJ, Ganetzky B (květen 2013). „Dnr1 mutace způsobují neurodegeneraci v Drosophile aktivací vrozené imunitní odpovědi v mozku“. Sborník Národní akademie věd Spojených států amerických. 110 (19): E1752-60. Bibcode:2013PNAS..110E1752C. doi:10.1073 / pnas.1306220110. PMC 3651420. PMID 23613578.
- ^ Petersen AJ, Katzenberger RJ, Wassarman DA (květen 2013). „Vrozená imunitní odpověď transkripční faktor je nezbytná pro neurodegeneraci v modelu ataxie-teleangiektázie Drosophila“. Genetika. 194 (1): 133–42. doi:10.1534 / genetika.113.150854. PMC 3632461. PMID 23502677.
- ^ Kounatidis I, Chtarbanova S, Cao Y, Hayne M, Jayanth D, Ganetzky B, Ligoxygakis P (duben 2017). „Imunita NF-κB v mozku určuje životnost mouchy ve zdravém stárnutí a neurodegeneraci související s věkem“. Zprávy buněk. 19 (4): 836–848. doi:10.1016 / j.celrep.2017.04.007. PMC 5413584. PMID 28445733.
- ^ Parvy JP, Yu Y, Dostalova A, Kondo S, Kurjan A, Bulet P a kol. (Červenec 2019). "Drosophila". eLife. 8. doi:10,7554 / eLife.45061. PMC 6667213. PMID 31358113.
- ^ Araki M, Kurihara M, Kinoshita S, Awane R, Sato T, Ohkawa Y, Inoue YH (červen 2019). „Mutanti Drosophila mxc“. Modely a mechanismy nemocí. 12 (6). doi:10,1242 / dmm.037721. PMC 6602314. PMID 31160313.
- ^ Barajas-Azpeleta R, Wu J, Gill J, Welte R, Seidel C, McKinney S a kol. (Říjen 2018). „Antimikrobiální peptidy modulují dlouhodobou paměť“. Genetika PLOS. 14 (10): e1007440. doi:10.1371 / journal.pgen.1007440. PMC 6224176. PMID 30312294.
- ^ A b Dostálová A, Rommelaere S, Poidevin M, Lemaitre B (září 2017). „Proteiny obsahující thioester regulují Toll cestu a hrají roli v obraně Drosophila proti mikrobiálním patogenům a parazitoidním vosám“. Biologie BMC. 15 (1): 79. doi:10.1186 / s12915-017-0408-0. PMC 5584532. PMID 28874153.
- ^ Srinivasan N, Gordon O, Ahrens S, Franz A, Deddouche S, Chakravarty P a kol. (Listopad 2016). "Drosophila melanogaster". eLife. 5. doi:10,7554 / eLife.19662. PMC 5138034. PMID 27871362.
- ^ Goto A, Yano T, Terashima J, Iwashita S, Oshima Y, Kurata S (květen 2010). „Kooperativní regulace indukce nového antibakteriálního listericinu peptidem rozpoznávajícím protein LE a cestou JAK-STAT“. The Journal of Biological Chemistry. 285 (21): 15731–8. doi:10.1074 / jbc.M109.082115. PMC 2871439. PMID 20348097.
- ^ Wang L, Kounatidis I, Ligoxygakis P (leden 2014). „Drosophila jako model ke studiu úlohy krevních buněk při zánětu, vrozené imunitě a rakovině“. Hranice v buněčné a infekční mikrobiologii. 3: 113. doi:10.3389 / fcimb.2013.00113. PMC 3885817. PMID 24409421.
- ^ Neyen C, Bretscher AJ, Binggeli O, Lemaitre B (červen 2014). „Metody ke studiu imunity vůči Drosophila“ (PDF). Metody. 68 (1): 116–28. doi:10.1016 / j.ymeth.2014.02.023. PMID 24631888.
- ^ Hashimoto Y, Tabuchi Y, Sakurai K, Kutsuna M, Kurokawa K, Awasaki T a kol. (Prosinec 2009). „Identifikace kyseliny lipoteichoové jako ligandu pro řasení při fagocytóze Staphylococcus aureus pomocí Drosophila hemocytes“. Journal of Immunology. 183 (11): 7451–60. doi:10,4049 / jimmunol.0901032. PMID 19890048.
- ^ Holz A, Bossinger B, Strasser T, Janning W, Klapper R (říjen 2003). „Dva počátky hemocytů v Drosophile“. Rozvoj. 130 (20): 4955–62. doi:10,1242 / dev.00702. PMID 12930778.
- ^ Sanchez Bosch P, Makhijani K, Herboso L, Gold KS, Baginsky R, Woodcock KJ a kol. (Prosinec 2019). „Dospělá Drosophila postrádá hematopoézu, ale spoléhá se na rezervu krevních buněk v respiračním epitelu, aby přenášela signály infekce do okolních tkání“. Vývojová buňka. 51 (6): 787–803.e5. doi:10.1016 / j.devcel.2019.10.017. PMC 7263735. PMID 31735669.
- ^ Parvy JP, Yu Y, Dostalova A, Kondo S, Kurjan A, Bulet P a kol. (Červenec 2019). "Drosophila". eLife. 8: e45061. doi:10,7554 / eLife.45061. PMC 6667213. PMID 31358113.
- ^ Sturtevant AH (1929). „Klaretový mutantní typ Drosophila simulans: studie eliminace chromozomů a buněčné linie“. Zeitschrift für Wissenschaftliche Zoologie. 135: 323–356.
- ^ Nissani M (květen 1975). „Nový behaviorální biologický test pro analýzu sexuální přitažlivosti a feromonů u hmyzu“. The Journal of Experimental Zoology. 192 (2): 271–5. doi:10.1002 / jez.1401920217. PMID 805823.
- ^ Khan FA (2011). Základy biotechnologie. CRC Press. p. 213. ISBN 978-1-4398-2009-4.
- ^ „Nobelova cena za fyziologii nebo medicínu za rok 2017 společně s Jeffrey C. Hall, Michaelem Rosbashem a Michaelem W. Youngem za objev molekulárních mechanismů ovládajících cirkadiánní rytmus“. Nobelprize.org. 2. října 2017. Citováno 5. října 2017.
- ^ Lehnert BP, Baker AE, Gaudry Q, Chiang AS, Wilson RI (leden 2013). "Zřetelné role TRP kanálů ve sluchové transdukci a amplifikaci v Drosophile". Neuron. 77 (1): 115–28. doi:10.1016 / j.neuron.2012.11.030. PMC 3811118. PMID 23312520.
- ^ Zhang W, Yan Z, Jan LY, Jan YN (srpen 2013). „Zvuková odezva zprostředkovaná kanály TRP NOMPC, NANCHUNG a INACTIVE v chordotonálních orgánech larev Drosophila“. Sborník Národní akademie věd Spojených států amerických. 110 (33): 13612–7. Bibcode:2013PNAS..11013612Z. doi:10.1073 / pnas.1312477110. PMC 3746866. PMID 23898199.
- ^ „Homosexualita se zapíná a vypíná u ovocných mušek“
- ^ Dasgupta S, Sheehan TC, Stevens CF, Navlakha S (prosinec 2018). „Neurální datová struktura pro detekci novinek“. Sborník Národní akademie věd Spojených států amerických. 115 (51): 13093–13098. doi:10.1073 / pnas.1814448115. PMC 6304992. PMID 30509984.
- ^ Zwarts L, Versteven M, Callaerts P (01.01.2012). „Genetika a neurobiologie agrese u Drosophily“. Létat. 6 (1): 35–48. doi:10,4161 / létat. 19249. PMC 3365836. PMID 22513455.
- ^ Davis SM, Thomas AL, Liu L, Campbell IM, Dierick HA (leden 2018). „Drosophila pomocí obrazovky pro poškození křídla“. Genetika. 208 (1): 273–282. doi:10.1534 / genetika.117.300292. PMC 5753862. PMID 29109180.
- ^ A b C Versteven M, Vanden Broeck L, Geurten B, Zwarts L, Decraecker L, Beelen M a kol. (Únor 2017). "Agrese Drosophila". Sborník Národní akademie věd Spojených států amerických. 114 (8): 1958–1963. doi:10.1073 / pnas.1605946114. PMC 5338383. PMID 28115690.
- ^ A b Sengupta S, Smith DP (2014). Mucignat-Caretta C (ed.). Jak Drosophila detekuje těkavé feromony: signalizace, obvody a chování. Neurobiologie chemické komunikace. Frontiers in Neuroscience. CRC Press / Taylor & Francis. ISBN 9781466553415. PMID 24830032. Citováno 2019-05-30.
- ^ Laturney M, Billeter JC (srpen 2016). „Samice Drosophila melanogaster obnovují svoji atraktivitu po páření odstraněním mužských antiafrodiziakálních feromonů“. Příroda komunikace. 7 (1): 12322. Bibcode:2016NatCo ... 712322L. doi:10.1038 / ncomms12322. PMC 4976142. PMID 27484362.
- ^ Wang L, Han X, Mehren J, Hiroi M, Billeter JC, Miyamoto T a kol. (Červen 2011). „Hierarchická chemosenzorická regulace sociálních interakcí mezi muži a muži v Drosophile“. Přírodní neurovědy. 14 (6): 757–62. doi:10.1038 / č. 2800. PMC 3102769. PMID 21516101.
- ^ A b C Lim RS, Eyjólfsdóttir E, Shin E, Perona P, Anderson DJ (2014-08-27). „Jak jídlo reguluje agresi v Drosophile“. PLOS ONE. 9 (8): e105626. Bibcode:2014PLoSO ... 9j5626L. doi:10.1371 / journal.pone.0105626. PMC 4146546. PMID 25162609.
- ^ Erion R, DiAngelo JR, Crocker A, Sehgal A (září 2012). „Interakce mezi spánkem a metabolismem u Drosophily se změněnou signalizací oktopaminu“. The Journal of Biological Chemistry. 287 (39): 32406–14. doi:10,1074 / jbc.M112,360875. PMC 3463357. PMID 22829591.
- ^ A b C Kayser MS, Mainwaring B, Yue Z, Sehgal A (červenec 2015). Griffith LC (ed.). „Spánková deprivace potlačuje agresi v Drosophile“. eLife. 4: e07643. doi:10,7554 / eLife.07643. PMC 4515473. PMID 26216041.
- ^ Hughes TT, Allen AL, Bardin JE, Christian MN, Daimon K, Dozier KD a kol. (Únor 2012). „Drosophila jako genetický model pro studium patogenních lidských virů“. Virologie. 423 (1): 1–5. doi:10.1016 / j.virol.2011.11.016. PMC 3253880. PMID 22177780.
- ^ Hardie RC, Raghu P (září 2001). "Vizuální transdukce v Drosophile". Příroda. 413 (6852): 186–93. Bibcode:2001 Natur.413..186H. doi:10.1038/35093002. PMID 11557987. S2CID 4415605.
- ^ Nichols R, Pak WL (říjen 1985). "Charakterizace rhodopsinu Drosophila melanogaster". The Journal of Biological Chemistry. 260 (23): 12670–4. PMID 3930500.
- ^ A b Raghu P, Colley NJ, Webel R, James T, Hasan G, Danin M a kol. (Květen 2000). "Normální fototransdukce ve fotoreceptorech Drosophila, kterým chybí gen receptoru InsP (3)". Molekulární a buněčné neurovědy. 15 (5): 429–45. doi:10,1006 / mcne.2000.0846. PMID 10833300. S2CID 23861204.
- ^ Wang T, Xu H, Oberwinkler J, Gu Y, Hardie RC, Montell C (únor 2005). „Funkce aktivace, adaptace a přežití buněk výměníku NaX / Ca2 + CalX“. Neuron. 45 (3): 367–78. doi:10.1016 / j.neuron.2004.12.046. PMID 15694324.
- ^ Rein K, Zöckler M, Mader MT, Grübel C, Heisenberg M (únor 2002). "Standardní mozek Drosophila". Aktuální biologie. 12 (3): 227–31. doi:10.1016 / S0960-9822 (02) 00656-5. PMID 11839276. S2CID 15785406.
- ^ Dawkins R, Dawkins M (1976). "Hierarchická organizace a usnadnění držení těla: pravidla pro péči o mouchy". Chování zvířat. 24 (4): 739–755. doi:10.1016 / S0003-3472 (76) 80003-6. S2CID 53186674.
- ^ A b C Davis WJ (1979). Msgstr "Hierarchie chování". Trendy v neurovědách. 2 (2): 5–7. doi:10.1016/0166-2236(79)90003-1. S2CID 53180462.
- ^ A b Seeds AM, Ravbar P, Chung P, Hampel S, Midgley FM, Mensh BD, Simpson JH (srpen 2014). „Hierarchie potlačení mezi konkurenčními motorickými programy pohání sekvenční péči v Drosophile“. eLife. 3: e02951. doi:10,7554 / eLife.02951. PMC 4136539. PMID 25139955.
- ^ Mathis A, Mamidanna P, Cury KM, Abe T, Murthy VN, Mathis MW, Bethge M (září 2018). "DeepLabCut: odhad pórů bez použití značek u uživatelem definovaných částí těla s hlubokým učením". Přírodní neurovědy. 21 (9): 1281–1289. doi:10.1038 / s41593-018-0209-r. PMID 30127430. S2CID 4748395.
- ^ Strauss R, Heisenberg M (srpen 1990). „Koordinace nohou při přímé chůzi a zatáčení v Drosophila melanogaster“. Journal of Comparative Physiology. A, senzorická, nervová a behaviorální fyziologie. 167 (3): 403–12. doi:10.1007 / BF00192575. PMID 2121965. S2CID 12965869.
- ^ DeAngelis BD, Zavatone-Veth JA, Clark DA (červen 2019). "Drosophila". eLife. 8. doi:10,7554 / eLife.46409. PMC 6598772. PMID 31250807.
- ^ Wosnitza A, Bockemühl T, Dübbert M, Scholz H, Büschges A (únor 2013). „Koordinace mezi nohama při řízení rychlosti chůze v Drosophile“. The Journal of Experimental Biology. 216 (Pt 3): 480–91. doi:10.1242 / jeb.078139. PMID 23038731.
- ^ Mendes CS, Bartos I, Akay T, Márka S, Mann RS (leden 2013). "Kvantifikace parametrů chůze u volně žijícího divokého typu a senzoricky zbavených Drosophila melanogaster". eLife. 2: e00231. doi:10,7554 / eLife.00231. PMC 3545443. PMID 23326642.
- ^ A b C Szczecinski NS, Bockemühl T, Chockley AS, Büschges A (listopad 2018). "Drosophila". The Journal of Experimental Biology. 221 (Pt 22): jeb189142. doi:10.1242 / jeb.189142. PMID 30274987.
- ^ Hooper SL (květen 2012). "Velikost těla a nervová kontrola pohybu". Aktuální biologie. 22 (9): R318-22. doi:10.1016 / j.cub.2012.02.048. PMID 22575473.
- ^ A b C Fry SN, Sayaman R, Dickinson MH (duben 2003). „Aerodynamika volných manévrů v Drosophile“ (PDF). Věda. 300 (5618): 495–8. Bibcode:2003Sci ... 300..495F. doi:10.1126 / science.1081944. PMID 12702878. S2CID 40952385. Archivovány od originál (PDF) dne 24. 09. 2015.
- ^ Hesselberg T, Lehmann FO (prosinec 2007). „Chování při zatáčení závisí na tlumení třením u ovocné mušky Drosophila“. The Journal of Experimental Biology. 210 (Pt 24): 4319–34. doi:10.1242 / jeb.010389. PMID 18055621.
- ^ „Druhy bez škůdců“. Plant Health Australia. Citováno 19. září 2017.
- ^ McEvey S (5. února 2014). „Ovocné mušky: případ chybné identity“. Australské muzeum. Citováno 19. září 2017.
Další čtení
- Kohler RE (1994). Lords of the Fly: Genetika drosophily a experimentální život. Chicago: University of Chicago Press. ISBN 978-0-226-45063-6.
- Gilbert SF (2000). Vývojová biologie (6. vydání). Sunderland (MA): Sinauer Associates; 2000.
- Perrimon N, Bonini NM, Dhillon P (březen 2016). „Ovocné mušky v první linii: translační dopad Drosophily“. Modely a mechanismy nemocí. 9 (3): 229–31. doi:10,1242 / dmm.024810. PMC 4833334. PMID 26935101.
- Henderson M (8. dubna 2010). "Veslovat nad ovocnou muškou Drosophila melanogaster jméno chyby vědci". Časy. Australan. Citováno 19. září 2017.
externí odkazy
| Scholia má téma profil pro Drosophila melanogaster. |
- "Rychlý a jednoduchý úvod do Drosophila melanogaster". Virtuální knihovna Drosophila.
- „Centrum zdrojů pro genomiku Drosophila“ - sbírá, udržuje a distribuuje klony a buněčné linie Drosophila DNA.
- „Bloomington Drosophila Stock Center“ - sbírá, udržuje a distribuuje kmeny Drosophila melanogaster pro výzkum
- „FlyBase - databáze genů a genů Drosophila“.
- „Prohlížeč map NCBI - Drosophila melanogaster".
- „Virtuální knihovna Drosophila“.
- „Berkeley Drosophila Projekt genomu “.
- „FlyMove“. Video zdroje pro Drosophila rozvoj
- "Drosophila Nomenklatura - pojmenování genů “. Archivovány od originál dne 8. října 2011.
- Zobrazit Fenomén genomu na Ensembl
- Zobrazit dm6 shromáždění genomu v UCSC Genome Browser.
- Manchester Fly Facility - pro veřejnost z University of Manchester
- Web droso4schools se školními zdroji o Drosophile
- Část 1 výukového videa "Malá muška: VELKÝ dopad" vysvětlující historii a význam modelového organismu Drosophila.
- Část 2 vzdělávacích videí „Malá muška: VELKÝ dopad“ vysvětlujících, jak probíhá výzkum v Drosophile.
- „Inside the Fly Lab“ —Vysílat WGBH a PBS, v programové řadě Zvědavý, Leden 2008.
- „Jak moucha detekuje jed“ —Článek WhyFiles.org popisuje, jak ovocná muška chutná chemikálii zabíjející larvy v potravinách.