RB-101 - RB-101
 | |
 | |
| Klinické údaje | |
|---|---|
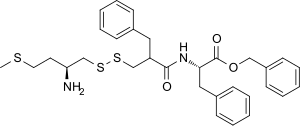
| Ostatní jména | RB-101; fenylmethyl (2S)-2-[(2-([(2S) -2-amino-4-methylsulfanylbutyl] disulfanylmethyl) -3-fenylpropanoyl) amino] -3-fenylpropanoát |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| ChemSpider | |
| Řídicí panel CompTox (EPA) | |
| Chemické a fyzikální údaje | |
| Vzorec | C31H38N2Ó3S3 |
| Molární hmotnost | 582.84 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| (ověřit) | |
RB-101 je droga, která působí jako enkefalináza inhibitor, který se používá ve vědeckém výzkumu.
RB-101 je a proléčivo který působí rozdělením na disulfidová vazba jednou v mozku, za vzniku dvou selektivních inhibitorů enzymů a blokování obou typů enzymů zinek-metalopeptidáza enkefalináza. To inhibuje rozklad endogenních opioidních peptidů známých jako enkefaliny.[1] Tyto dva enzymy, aminopeptidáza N (APN) a neutrální endopeptidáza 24.11 (NEP), jsou zodpovědné za rozpad obou druhů enkefalinu přirozeně se vyskytujících v těle, a tak RB-101 způsobuje hromadění obou Met-enkefalin a Leu-enkefalin.[2][3]
Tyto peptidy působí primárně na delta opioidní receptor, i když také stimulují mu opioidní receptor do určité míry prostřednictvím interakce s jiným peptidem zprostředkovanou delta-opioidním receptorem cholecystokinin a enzymové inhibiční účinky RB-101 tak způsobují nepřímou stimulaci obou těchto podtypů opioidních receptorů.[4] To způsobí, že RB-101 bude silně synergický s antagonisté cholecystokininu, jako proglumid.[5][6]
Na rozdíl od běžněji používaného inhibitoru enkefalinázy racecadotril, který působí pouze okrajově a má proti průjmu účinky, RB-101 je schopen vstoupit do mozku, a tak vytváří řadu účinků, které působí jako analgetikum, anxiolytikum a antidepresivum.[7] Antidepresivní a anxiolytické účinky jsou považovány za zprostředkované delta opioidním receptorem, zatímco analgetické účinky jsou nejpravděpodobnější výsledkem kombinace aktivity mu a delta.[8] Studie na zvířatech naznačují, že RB-101 je také pravděpodobně užitečný při zmírnění příznaků akutního vysazení opioidů[9] a při léčbě závislosti na opioidech.[10][11][12]
Významnou výhodou inhibice odbourávání endogenních opioidních peptidů spíše než stimulace opioidních receptorů exogenními léky je to, že hladiny opioidních peptidů jsou jen mírně zvýšeny z přirozených hladin, čímž se zabrání nadměrné stimulaci a nadregulaci opioidních receptorů. To znamená, že i když je RB-101 používán ve vysokých dávkách po delší dobu, nedochází k vývoji závislosti na léku nebo toleranci k jeho analgetickým účinkům.[13][14] Z toho vyplývá, že i když je RB-101 schopen prostřednictvím opioidního systému vyvolat silné analgetické účinky, je nepravděpodobné, že by vyvolal návyk.[15][16]
Na rozdíl od konvenčních opioidních agonistů RB-101 také nedokázal vyrobit respirační deprese, což naznačuje, že by to mohla být mnohem bezpečnější droga než tradiční opioidní léky proti bolesti.[17] RB-101 také silně potencoval účinky tradičních analgetik, jako je ibuprofen a morfium, což naznačuje, že by mohlo být použito k posílení účinku nízké dávky normálních opioidů, které by jinak byly neúčinné.[18]
RB-101 sám o sobě není orálně aktivní, a proto nebyl vyvinut pro lékařské použití u lidí, avšak modifikace léčiva vedla k novějším orálně působícím sloučeninám, jako je RB-120 a RB-3007, které mohou být s větší pravděpodobností přijaty pro lékařské použití, pokud budou klinické studie úspěšné.[19][20][21][22][23]
Viz také
Reference
- ^ Roques BP (duben 1992). „Peptidomimetika jako agonisté receptorů nebo inhibitory peptidázy: Strukturální přístup v oblasti enkefalinů, ANP a CCK“. Biopolymery. 32 (4): 407–10. doi:10,1002 / bip.360320417. PMID 1320419.
- ^ Noble F, Soleilhac JM, Soroca-Lucas E, Turcaud S, Fournie-Zaluski MC, Roques BP (duben 1992). „Inhibice enzymů metabolizujících enkefaliny prvním systémově aktivním směsným inhibitorem proléčiva RB 101 indukuje silné analgetické reakce u myší a potkanů.“ The Journal of Pharmacology and Experimental Therapeutics. 261 (1): 181–90. PMID 1560364.
- ^ Fournié-Zaluski MC, Coric P, Turcaud S, Lucas E, Noble F, Maldonado R, Roques BP (červen 1992). „Smíšený inhibitor-proléčivo“ jako nový přístup k systémově aktivním inhibitorům enzymů degradujících enkefaliny. Journal of Medicinal Chemistry. 35 (13): 2473–81. doi:10.1021 / jm00091a016. PMID 1352352.
- ^ Noble F, Smadja C, Roques BP (prosinec 1994). „Role endogenního cholecystokininu při usnadňování mu zprostředkované antinocicepce delta-opioidními agonisty“. The Journal of Pharmacology and Experimental Therapeutics. 271 (3): 1127–34. PMID 7996417.
- ^ Valverde O, Maldonado R, Fournie-Zaluski MC, Roques BP (červenec 1994). „Antagonisté cholecystokininu B silně potencují antinocicepci zprostředkovanou endogenními enkefaliny“. The Journal of Pharmacology and Experimental Therapeutics. 270 (1): 77–88. PMID 8035345.
- ^ Honore P, Buritova J, Fournié-Zaluski MC, Roques BP, Besson JM (duben 1997). „Antinociceptivní účinky RB101, úplného inhibitoru enzymů katabolizujících enkefaliny, jsou zvýšeny antagonistou receptoru cholecystokininu typu B, jak dokazuje škodlivá evokovaná spinální exprese c-Fos u potkanů.“ The Journal of Pharmacology and Experimental Therapeutics. 281 (1): 208–17. PMID 9103499.
- ^ Jutkiewicz EM, Torregrossa MM, Sobczyk-Kojiro K a kol. (Únor 2006). „Behaviorální a neurobiologické účinky inhibitoru enkefalinázy RB101 ve srovnání s jeho antidepresivními účinky“. European Journal of Pharmacology. 531 (1–3): 151–9. doi:10.1016 / j.ejphar.2005.12.002. PMC 1828120. PMID 16442521.
- ^ Jutkiewicz EM (2007). „Ochrana endogenních opioidů zprostředkovaná RB101: potenciální terapeutické využití?“ (PDF). Recenze drog CNS. 13 (2): 192–205. doi:10.1111 / j.1527-3458.2007.00011.x. PMID 17627672.
- ^ Maldonado R, Valverde O, Ducos B, Blommaert AG, Fournie-Zaluski MC, Roques BP (březen 1995). „Inhibice odnětí morfinu spojením RB 101, inhibitoru katabolismu enkefalinu, a antagonisty CCKB PD-134 308“. British Journal of Pharmacology. 114 (5): 1031–9. doi:10.1111 / j.1476-5381.1995.tb13309.x. PMC 1510310. PMID 7780637.
- ^ Ruiz F, Fournié-Zaluski MC, Roques BP, Maldonado R (září 1996). „Podobné snížení spontánní abstinence morfinu metadonem a RB 101, inhibitorem katabolismu enkefalinů“. British Journal of Pharmacology. 119 (1): 174–82. doi:10.1111 / j.1476-5381.1996.tb15691.x. PMC 1915744. PMID 8872371.
- ^ Roques BP, Noble F (listopad 1996). „Sdružení inhibitorů katabolismu enkefalinu a antagonistů CCK-B: potenciální použití při léčbě bolesti a závislosti na opioidech“. Neurochemický výzkum. 21 (11): 1397–410. doi:10.1007 / bf02532381. PMID 8947930.
- ^ Cordonnier L, Sanchez M, Roques BP, Noble F (květen 2007). „Blokování senzibilizace chování vyvolané morfinem kombinací amisulpridu a RB101, srovnání s klasickou udržovací léčbou opioidy“. British Journal of Pharmacology. 151 (1): 94–102. doi:10.1038 / sj.bjp.0707195. PMC 2012985. PMID 17351659.
- ^ Noble F, Turcaud S, Fournié-Zaluski MC, Roques BP (listopad 1992). „Opakované systémové podávání směsného inhibitoru enzymů degradujících enkefaliny, RB101, nevyvolává ani antinociceptivní toleranci, ani zkříženou toleranci s morfinem.“ European Journal of Pharmacology. 223 (1): 83–9. doi:10.1016 / 0014-2999 (92) 90821-K. PMID 1478260.
- ^ Noble F, Coric P, Turcaud S, Fournié-Zaluski MC, Roques BP (březen 1994). „Posouzení fyzické závislosti po kontinuální perfuzi smíšeného inhibitoru enzymů degradujících enkefalin do jugulární žíly krysy, RB 101“. European Journal of Pharmacology. 253 (3): 283–7. doi:10.1016/0014-2999(94)90203-8. PMID 8200422.
- ^ Noble F, Fournié-Zaluski MC, Roques BP (leden 1993). „Na rozdíl od morfinu nejsou endogenní enkefaliny chráněné RB101 schopny stanovit preferované podmíněné místo u myší“. European Journal of Pharmacology. 230 (2): 139–49. doi:10.1016 / 0014-2999 (93) 90796-K. PMID 8422896.
- ^ Stein, editoval Christoph (1999). Opioidy v léčbě bolesti: základní a klinické aspekty. Cambridge, Velká Británie: Cambridge University Press. ISBN 978-0521622691.CS1 maint: další text: seznam autorů (odkaz)
- ^ Boudinot E, Morin-Surun M, Foutz AS, Fournié-Zaluski M, Roques BP, Denavit-Saubié M (únor 2001). "Účinky silných analgetických inhibitorů enzymu katabolizujících enkefaliny RB101 a kelatorfanu na dýchání". Bolest. 90 (1–2): 7–13. doi:10.1016 / S0304-3959 (00) 00382-1. PMID 11166965.
- ^ Nieto MM, Wilson J, Walker J a kol. (Září 2001). „Usnadnění antinocicepce vyvolané inhibitorem katabolismu enkefalinů léky klasicky používanými při léčbě bolesti“. Neurofarmakologie. 41 (4): 496–506. doi:10.1016 / S0028-3908 (01) 00077-6. PMID 11543770.
- ^ Noble F, Smadja C, Valverde O a kol. (Prosinec 1997). „Účinky potlačující bolest na různé nociceptivní podněty (tepelné, chemické, elektrické a zánětlivé) prvního perorálně aktivního inhibitoru enzymu metabolizujícího enkefalin RB 120“. Bolest. 73 (3): 383–91. doi:10.1016 / S0304-3959 (97) 00125-5. PMID 9469529.
- ^ Le Guen S, Mas Nieto M, Canestrelli C a kol. (Červenec 2003). „Léčba bolesti novou řadou duálních inhibitorů enzymů degradujících enkefaliny: dlouhodobé antinociceptivní vlastnosti a potenciace antagonistou CCK2 nebo metadonem“. Bolest. 104 (1–2): 139–48. doi:10.1016 / S0304-3959 (02) 00486-4. PMID 12855323.
- ^ Le Guen S, Mas Nieto M, Canestrelli C, Chen H, Fournié-Zaluski MC, Cupo A, Maldonado R, Roques BP, Noble F (červenec 2003). „Léčba bolesti novou řadou duálních inhibitorů enzymů degradujících enkefaliny: dlouhodobé antinociceptivní vlastnosti a potenciace antagonistou CCK2 nebo metadonem“. Bolest. 104 (1–2): 139–48. doi:10.1016 / S0304-3959 (02) 00486-4. PMID 12855323.
- ^ Noble F, Roques BP (únor 2007). „Ochrana endogenního katabolismu enkefalinu jako přirozeného přístupu k novým analgetikům a antidepresivům“. Znalecký posudek na terapeutické cíle. 11 (2): 145–59. doi:10.1517/14728222.11.2.145. PMID 17227231.
- ^ Thanawala V, Kadam VJ, Ghosh R (říjen 2008). „Inhibitory enkefalinázy: potenciální látky pro zvládání bolesti“. Aktuální drogové cíle. 9 (10): 887–94. doi:10.2174/138945008785909356. PMID 18855623.
