Ohmefentanyl - Ohmefentanyl
 | |
| Klinické údaje | |
|---|---|
| ATC kód |
|
| Právní status | |
| Právní status |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Chemické a fyzikální údaje | |
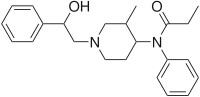
| Vzorec | C23H30N2Ó2 |
| Molární hmotnost | 366.505 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| (ověřit) | |
Ohmefentanyl (také známý jako p-hydroxy-3-methylfentanyl, OMF a RTI-4614-4)[1] je extrémně silný opioid analgetikum lék, který se selektivně váže na u-opioidní receptor.[2][3]
Ohmefentanyl je jedním z nejúčinnějších μ-opioidních receptorů agonisté známé, srovnatelné se superpotentními opioidy jako carfentanil a etorfin které se legálně používají pouze k uklidnění velkých zvířat jako např sloni v veterinární medicína. Ve studiích na myších je nejaktivnější izomer 3R, 4S, βS-ohmefentanyl byl 28krát silnější než lék proti bolesti než fentanyl, chemikálie, ze které je odvozen, a 6300krát silnější než morfium.[4][5][6][7] Ohmefentanyl má tři stereogenní centra a osm stereoizomery, které jsou pojmenovány F9201 – F9208. Vědci studují jejich různé farmaceutické vlastnosti izomery.[8]
4 ″ -fluorový analog (tj. Substituovaný na fenethyl kruh) 3R, 4S, βS izomer ohmefentanylu je jedním z nejúčinnějších opioid agonisté dosud objevili a vlastnili analgetikum účinnost přibližně 18 000krát vyšší než u morfinu.[9] Mezi další analogy s vyšší účinností než samotný ohmefentanyl patří 2'-fluoroderivát (tj. Substituovaný na anilinovém fenylovém kruhu) a deriváty, kde byla N-propionylová skupina nahrazena N-methoxyacetylovou nebo 2-furamidovou skupinou, nebo karboethoxy skupina se přidá do polohy 4 piperidinového kruhu. Druhá uvedená látka je uvedena až jako 30 000krát účinnější než morfin.[10]
Nežádoucí účinky fentanyl analogy jsou podobné analogům samotného fentanylu, které zahrnují svědění, nevolnost a potenciálně vážné respirační deprese, což může být životu nebezpečné. Nedovoleně použité analogy fentanylu zabily stovky lidí v celé Evropě a v bývalých sovětských republikách od doby, kdy poslední obnova používání začala v Estonsko v časném 2000s, a nové deriváty pokračují se objevit.[11]
Syntéza

Viz také

- Opioid
- Fentanyl
- 3-methylfentanyl
- Carfentanil
- Ohmecarfentanil (RTI-4614-38) je 30 000krát účinnější než morfin v testu potlačení jedné dávky u opice rhesus.[12] Díky tomu je nejsilnějším opioidem, který je v současné době znám, dokonce překonávajícím lofentanil.
Reference
- ^ Rothman, R. B .; Heng Xu; Seggel, M .; Jacobson, A.E .; Rice, K. C .; Solanka, G. A .; Carroll, F. I. (duben 1991). "RTI-4614-4: Analog (+) - cis-3-methylfentanylu s 27 000násobnou vazebnou selektivitou pro vazebná místa opioidů proti mu a delta". Humanitní vědy. 48 (23): PL111 – PL116. doi:10.1016 / 0024-3205 (91) 90346-D. PMID 1646357.
- ^ Solanka, G. A .; Stark, P. A .; Liu, Y .; Carroll, F. I .; Singh, P .; Xu, H .; Rothman, R. B. (1995). "Enantiomery diastereomerních cis-N- [1- (2-hydroxy-2-fenylethyl) -3-methyl-4-piperidyl] -N-fenylpropanamidů: syntéza, rentgenová analýza a biologické aktivity". Journal of Medicinal Chemistry. 38 (9): 1547–1557. doi:10.1021 / jm00009a015. PMID 7739013.
- ^ Wang, Z. X .; Zhu, Y. C .; Jin, W. Q .; Chen, X. J .; Chen, J .; Ji, R. Y .; Chi, Z. Q. (září 1995). „Stereoizomery N- [l- (2-hydroxy-2-fenylethyl) -3-methyl-4-piperidyl] -N-fenylpropanamidu: syntéza, stereochemie, analgetická aktivita a vazebné charakteristiky opioidních receptorů.“. Journal of Medicinal Chemistry. 38 (18): 3652–3659. doi:10.1021 / jm00018a026. PMID 7658453.
- ^ H. D. Banks, C. P. Ferguson (září 1988). "Metabolity fentanylu a jeho deriváty" (PDF). Centrum pro chemický výzkum, vývoj a inženýrství americké armády, Aberdeen Proving Ground, MD.
- ^ Jin, W. Q .; Xu, H .; Zhu, Y. C .; Fang, S.N .; Xia, X. L .; Huang, Z. M .; Ge, B.L .; Chi, Z. Q. (květen 1981). „Studie syntézy a vztahu mezi analgetickou aktivitou a afinitou k receptorům pro 3-methylfentanylové deriváty“. Scientia Sinica. 24 (5): 710–720. PMID 6264594.
- ^ Zhu, Y. C .; Wu, R. Q .; Chou, D. P .; Huang, Z. M. (prosinec 1983). "Studie na silných analgetikách. VII. Syntéza a analgetická aktivita diastereoizomerů 1-beta-hydroxy-3-methylfentanylu (7302) a příbuzných sloučenin". Yao Xue Xue Bao = Acta Pharmaceutica Sinica. 18 (12): 900–904. PMID 6679170.
- ^ Guo, G. W .; Ahoj.; Jin, W. Q .; Zou, Y .; Zhu, Y. C .; Chi, Z. Q. (červen 2000). "Srovnání fyzikální závislosti stereoizomerů ohmefentanylu u myší". Humanitní vědy. 67 (2): 113–120. doi:10.1016 / S0024-3205 (00) 00617-2. PMID 10901279.
- ^ Liu, Z .; Ahoj.; Jin, W .; Chen, X .; Shen, Q .; Chi, Z. (duben 2004). "Účinek chronické léčby ohmefentanyl stereoizomery na cyklickou tvorbu AMP v hmyzích buňkách Sf9 exprimujících lidské μ-opioidní receptory". Humanitní vědy. 74 (24): 3001–3008. doi:10.1016 / j.lfs.2003.10.027. PMID 15051423.
- ^ Yong, Z .; Hao, W .; Weifang, Y .; Qiyuan, D .; Xinjian, C .; Wenqiao, J .; Youcheng, Z. (květen 2003). "Syntéza a analgetická aktivita stereoizomerů cis-fluor-ohmefentanylu". Die Pharmazie. 58 (5): 300–302. PMID 12779044.
- ^ Brine GA, Carroll FI, Richardson-Leibert TM, Xu H, Rothman RB (srpen 1997). „Ohmefentanyl a jeho stereoizomery: chemie a farmakologie“. Současná léčivá chemie. 4 (4): 247–270. ISSN 0929-8673.
- ^ Mounteney J, Giraudon I, Denissov G, Griffiths P (červenec 2015). „Fentanyly: Chybí nám znamení? Vysoce účinný a v Evropě na vzestupu“. International Journal of Drug Policy. 26 (7): 626–631. doi:10.1016 / j.drugpo.2015.04.003. PMID 25976511.
- ^ Carroll, F. Ivy; Lewin, Anita H .; Mascarella, S. Wayne; Seltzman, Herbert H .; Reddy, P. Anantha (2020). „Značkové léky: perspektiva léčivé chemie (II)“. Annals of the New York Academy of Sciences. doi: 10,1111 / nyas.14349.
externí odkazy
- Ohmefentanyl v americké národní lékařské knihovně Lékařské předměty (Pletivo)
