Fosfolipáza C. - Phospholipase C

Fosfolipáza C. (PLC) je třída spojená s membránou enzymy to štěpení fosfolipidy těsně před fosfát skupina (viz obrázek). Nejčastěji se považuje za synonymum lidských forem tohoto enzymu, které v něm hrají důležitou roli eukaryotický buňka fyziologie, zejména signální transdukce cesty. Existuje třináct druhů savčí fosfolipázy C, které jsou podle struktury klasifikovány do šesti izotypů (β, γ, δ, ε, ζ, η). Každý PLC má jedinečnou a překrývající se kontrolu nad expresí a subcelulární distribucí. Aktivátory jednotlivých PLC se liší, ale obvykle zahrnují heterotrimerní G protein podjednotky, bílkoviny tyrosinkinázy, malé G proteiny, Ca2+a fosfolipidy.[1]
Varianty
Savčí varianty
Rozsáhlý počet funkcí vyvíjených reakcí PLC vyžaduje, aby byl přísně regulován a byl schopen reagovat na více extra- a intracelulárních vstupů vhodnou kinetikou. Tato potřeba vedla k vývoji šesti izotypů PLC u zvířat, z nichž každý má odlišný způsob regulace. Pre-mRNA PLC může také podléhat diferenciálnímu sestřihu, takže savec může mít až 30 PLC enzymů.[2]
- beta: PLCB1, PLCB2, PLCB3, PLCB4
- gama: PLCG1, PLCG2
- delta: PLCD1, PLCD3, PLCD4
- epsilon: PLCE1
- eta: PLCH1, PLCH2
- zeta: PLCZ1
- fosfolipáza jako C: PLCL1, PLCL2
Bakteriální varianty
Většina bakteriálních variant fosfolipázy C je charakterizována do jedné ze čtyř skupin strukturně příbuzných proteinů. Toxické fosfolipázy C jsou schopné interagovat s eukaryotickými buněčnými membránami a hydrolyzovat fosfatidylcholin a sfingomyelin, což nakonec vede k lýze buněk.[3]
- Zinek-metalofosfolipázy C: Clostridium perfringens alfa-toxin, Bacillus cereus PLC (BC-PLC)
- Sfingomyelinázy: B. cereus, Zlatý stafylokok
- Enzymy hydrolyzující fosfatidylinositol: B. cereus, B. thuringiensis, L. monocytogenes (PLC-A)
- Pseudomonádové fosfolipázy C: Pseudomonas aeruginosa (PLC-H a PLC-N)
Struktura enzymu

U savců sdílejí PLC konzervovanou strukturu jádra a liší se v jiných doménách specifických pro každou rodinu. Základní enzym zahrnuje štěpení hlaveň triosefosfát izomerázy (TIM), pleckstrinová homologická (PH) doména, čtyři tandemové ruční domény EF a Doména C2.[1] TIM hlaveň obsahuje aktivní místo, všechny katalytické zbytky a Ca2+ vazebné místo. Má autoinhibiční vložku, která přerušuje jeho činnost nazývanou X-Y linker. Ukázalo se, že linker X-Y uzavírá aktivní místo a jeho odstraněním je aktivován PLC.[4]
Geny kódující alfa-toxin (Clostridium perfringens), Bacillus cereus PLC (BC-PLC) a PLC z Clostridium bifermentans a Listeria monocytogenes byly izolovány a nukleotidy sekvenovány. Existuje významná homologie sekvencí, přibližně 250 zbytků, z N-konce. Alfa-toxin má dalších 120 zbytků na C-konci. C-konec alfa-toxinu byl označen jako doména typu „C2“, odkazující na Doména C2 nachází se v eukaryotech, které se účastní signální transdukce a vyskytují se u savců fosfoinositid fosfolipáza C.[5]
Enzymový mechanismus

Primární katalyzovaná reakce PLC probíhá na nerozpustném substrátu na rozhraní lipid-voda. Zbytky v aktivním místě jsou konzervovány ve všech izotypech PLC. U zvířat PLC selektivně katalyzuje hydrolýzu fosfolipidů fosfatidylinositol 4,5-bisfosfát (PIP2) na straně glycerolu fosfodiesterové vazby. Dochází k tvorbě slabě enzymově vázaného meziproduktu, inositolu 1,2-cyklického fosfodiesteru, a uvolňování diacyl glycerol (DAG). Meziprodukt se poté hydrolyzuje na inositol 1,4,5-trisfosfát (IP3).[6] Dva konečné produkty jsou tedy DAG a IP3. Kyselinová / bazická katalýza vyžaduje dva konzervované histidinové zbytky a Ca2+ ion je potřebný pro PIP2 hydrolýza. Bylo pozorováno, že aktivní místo Ca2+ souřadnice se čtyřmi kyselými zbytky a pokud je některý ze zbytků mutován, pak větší Ca2+ koncentrace je potřebná pro katalýzu.[7]
Nařízení
Aktivace
Receptory, které aktivují tuto cestu, jsou hlavně Receptory spojené s G proteinem spojený s Gαq podjednotka, počítaje v to:
- 5-HT2 serotonergní receptory
- α1 (Alfa-1) adrenergní receptory[8]
- Kalcitoninové receptory
- H1 histaminové receptory
- Metabotropní glutamátové receptory, Skupina I
- M1, M3, a M5 muskarinové receptory
- Hormonový receptor uvolňující štítnou žlázu v přední hypofýze
Jiné, vedlejší aktivátory než Gαq jsou:
- MAP kináza. Mezi aktivátory této cesty patří PDGF a FGF.[8]
- βγ-komplex z heterotrimerní G-proteiny, jako na vedlejší cestě z růstový hormon uvolnit do hormon uvolňující růstový hormon.[9]
- Kanabinoidní receptory
Inhibice
- Malá molekula U73122: aminosteroid, předpokládaný inhibitor PLC.[10][11] Specifičnost U73122 však byla zpochybněna.[12][13] Bylo hlášeno, že U73122 aktivuje fosfolipázovou aktivitu čištěných PLC.[14]
- Edelfosin: lipidové, antineoplastické činidlo (ET-18-OCH3)[15]
- Autoinhibice X-Y linkeru v savčích buňkách: Navrhuje se, aby X-Y linker sestával z dlouhých úseků kyselých aminokyselin, které tvoří husté oblasti záporného náboje. Tyto oblasti by mohly být odpuzovány záporně nabitou membránou po navázání PLC na membránové lipidy. Předpokládá se, že kombinace odpuzování a sterických omezení odstraní X-Y linker z blízkosti aktivního místa a zmírní autoinhibici.[1]
- Sloučeniny obsahující kostru kyseliny morfolinobenzoové patří do třídy inhibitorů PLC podobných léčivým fosfatidylcholinům[16][17]
- Ó-fenanthrolin: heterocyklická organická sloučenina, o které je známo, že inhibuje metaloenzymy zinku[18]
- EDTA: molekula, která chelatuje Zn2+ ionty a účinně inaktivuje PLC, o kterém je známo, že inhibuje metaloenzymy zinku[19]
Biologická funkce
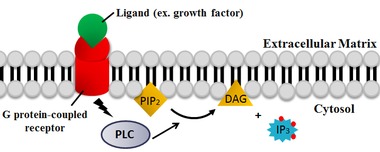
PLC štěpí fosfolipid fosfatidylinositol 4,5-bisfosfát (PIP.)2) do diacyl glycerol (DAG) a inositol 1,4,5-trisfosfát (IP3). PLC má tedy zásadní dopad na vyčerpání PIP2, který funguje jako membránová kotva nebo alosterický regulátor.[20] PIP2 působí také jako substrát pro syntézu vzácnějších lipidů fosfatidylinositol 3,4,5-trisfosfát (PIP3), který je zodpovědný za signalizaci v několika reakcích.[21] Proto PIP2 vyčerpání reakcí PLC je rozhodující pro regulaci lokálního PIP3 koncentrace v plazmatické membráně i v jaderné membráně.
Dva produkty reakce katalyzované PLC, DAG a IP3, jsou důležití druzí poslové, kteří řídí různé buněčné procesy a jsou substráty pro syntézu dalších důležitých signálních molekul. Když PIP2 je štěpen, DAG zůstává vázán na membránu a IP3 se uvolňuje jako rozpustná struktura do cytosol. IP3 pak difunduje cytosolem, na který se váže IP3 receptory, zejména vápníkové kanály v hladké endoplazmatické retikulum (ER). To způsobí zvýšení cytosolické koncentrace vápníku, což způsobí kaskádu intracelulárních změn a aktivity.[22] Kromě toho vápník a DAG společně aktivují protein kináza C., který dále fosforyluje další molekuly, což vede ke změně buněčné aktivity.[22] Mezi konečné účinky patří chuť, podpora nádoru a exocytóza vezikul, superoxid výroba od NADPH oxidáza, a JNK aktivace.[22][23]
DAG i IP3 jsou substráty pro syntézu regulačních molekul. DAG je substrát pro syntézu kyselina fosfatidová, regulační molekula. IP3 je substrát omezující rychlost pro syntézu inositol polyfosfátů, které stimulují více proteinových kináz, transkripci a zpracování mRNA.[24] Regulace aktivity PLC je tedy zásadní pro koordinaci a regulaci dalších enzymů drah, které jsou ústřední pro řízení buněčné fyziologie.
Fosfolipáza C navíc hraje důležitou roli v cestě zánětu. Vazba agonistů, jako je trombin, epinefrin nebo kolagen, do destička povrchové receptory mohou spustit aktivaci fosfolipázy C, aby katalyzovaly uvolňování kyselina arachidonová ze dvou hlavních membránových fosfolipidů, fosfatidylinositol a fosfatidylcholin. Kyselina arachidonová pak může pokračovat do cyklooxygenázové dráhy (produkující prostoglandiny (PGE1, PGE2, PGF2), prostacykliny (PGI2) nebo tromboxany (TXA2)) a lipoxygenázová cesta (produkující leukotrieny (LTB4, LTC4, LTD4, LTE4)).[25]
Bakteriální varianta Clostridium perfringens typ A produkuje alfa-toxin. Toxin má aktivitu fosfolipázy C a způsobuje hemolýza, letalita a dermonekróza. Při vysokých koncentracích vyvolává alfa-toxin masivní degradaci fosfatidylcholin a sfingomyelin, produkující diacylglycerol a ceramid, resp. Tyto molekuly se poté účastní drah přenosu signálu.[5] Bylo popsáno, že toxin aktivuje kaskádu kyseliny arachidonové v izolované krysí aortě.[26] Kontrakce vyvolaná toxiny souvisela s tvorbou tromboxanu A2 z kyseliny arachidonové. Je tedy pravděpodobné, že bakteriální PLC napodobuje působení endogenního PLC v eukaryotických buněčných membránách.
Viz také
- Glykosylfosfatidylinositol diacylglycerol-lyáza ES 4.6.1.14 Trypanosomální enzym.
- Fosfatidylinositol diacylglycerol-lyáza ES 4.6.1.13 Další související bakteriální enzym
- Fosfoinositid fosfolipáza C. ES 3.1.4.11 Hlavní forma nalezená u eukaryot, zejména u savců.
- Zinek-závislá fosfolipáza C. rodina bakteriálních enzymů ES 3.1.4.3 který zahrnuje alfa toxiny z C. perfringens (také známý jako lecitináza ), P. aeruginosa, a S. aureus.
Reference
- ^ A b C Kadamur G, Ross EM (2013). "Savčí fosfolipáza C". Roční přehled fyziologie. 75: 127–54. doi:10,1146 / annurev-physiol-030212-183750. PMID 23140367.
- ^ Suh, PG; Park, JI; Manzoli, L; Cocco, L; Peak, JC; Katan, M; Fukami, K; Kataoka, T; Yun, S; Ryu, SH (2008). "Více rolí fosfoinositidově specifických fosfolipázových C izozymů". Zprávy BMB. 41 (6): 415–34. doi:10,5483 / bmbrep.2008.41.6.415. PMID 18593525.
- ^ Titball, RW (1993). "Bakteriální fosfolipázy C." Mikrobiologické recenze. 57 (2): 347–66. doi:10.1128 / MMBR.57.2.347-366.1993. PMC 372913. PMID 8336671.
- ^ Hicks SN, Jezyk MR, Gershburg S, Seifert JP, Harden TK, Sondek J (srpen 2008). "Obecná a všestranná autoinhibice izozymů PLC". Molekulární buňka. 31 (3): 383–94. doi:10.1016 / j.molcel.2008.06.018. PMC 2702322. PMID 18691970.
- ^ A b Sakurai J, Nagahama M, Oda M (listopad 2004). „Clostridium perfringens alfa-toxin: charakterizace a způsob účinku“. Journal of Biochemistry. 136 (5): 569–74. doi:10.1093 / jb / mvh161. PMID 15632295.
- ^ Essen LO, Perisic O, Katan M, Wu Y, Roberts MF, Williams RL (únor 1997). „Strukturní mapování katalytického mechanismu pro fosfolipázu C specifickou pro savčí fosfoinositid“. Biochemie. 36 (7): 1704–18. doi:10.1021 / bi962512p. PMID 9048554.
- ^ Ellis, MV; James, SR; Perisic, O; Downes, PC; Williams, RL; Katan, M (1998). „Catalytic Domain of Phosphoinositide-specific Phospholipase C (PLC): mutation analysis of zbytky uvnitř aktivního místa hydrofobního hřebenu PLCD1“. The Journal of Biological Chemistry. 273 (19): 11650–9. doi:10.1074 / jbc.273.19.11650. PMID 9565585.
- ^ A b Walter F. Boron (2003). Lékařská fyziologie: buněčný a molekulární přístup. Elsevier / Saunders. str. 1300. ISBN 978-1-4160-2328-9. Stránka 104
- ^ GeneGlobe -> Signalizace GHRH[trvalý mrtvý odkaz ] Citováno 31. května 2009
- ^ Bleasdale JE, Thakur NR, Gremban RS, Bundy GL, Fitzpatrick FA, Smith RJ, Bunting S (listopad 1990). „Selektivní inhibice procesů vázaných na receptory spojené s fosfolipázou C v lidských krevních destičkách a polymorfonukleárních neutrofilech“. The Journal of Pharmacology and Experimental Therapeutics. 255 (2): 756–68. PMID 2147038.
- ^ Macmillan D, McCarron JG (červenec 2010). „Inhibitor fosfolipázy C U-73122 inhibuje uvolňování Ca (2+) z intracelulárního sarkoplazmatického retikula Ca (2+) tím, že inhibuje pumpy Ca (2+) v hladkém svalu.“. British Journal of Pharmacology. 160 (6): 1295–301. doi:10.1111 / j.1476-5381.2010.00771.x. PMC 2938802. PMID 20590621.
- ^ Huang W, Barrett M, Hajicek N, Hicks S, Harden TK, Sondek J, Zhang Q (únor 2013). „Inhibitory fosfolipázy C s malou molekulou z nového vysoce výkonného screeningu“. The Journal of Biological Chemistry. 288 (8): 5840–8. doi:10,1074 / jbc.M112.422501. PMC 3581404. PMID 23297405.
- ^ Leitner MG, Michel N, Behrendt M, Dierich M, Dembla S, Wilke BU, Konrad M, Lindner M, Oberwinkler J, Oliver D (srpen 2016). „Přímá modulace kanálů TRPM4 a TRPM3 inhibitorem fosfolipázy C U73122“. British Journal of Pharmacology. 173 (16): 2555–69. doi:10.1111 / bph.13538. PMC 4959952. PMID 27328745.
- ^ Klein RR, Bourdon DM, Costales CL, Wagner CD, White WL, Williams JD, Hicks SN, Sondek J, Thakker DR (duben 2011). „Přímá aktivace lidské fosfolipázy C jejím dobře známým inhibitorem u73122“. The Journal of Biological Chemistry. 286 (14): 12407–16. doi:10.1074 / jbc.M110.191783. PMC 3069444. PMID 21266572.
- ^ Horowitz LF, Hirdes W, Suh BC, Hilgemann DW, Mackie K, Hille B (září 2005). „Fosfolipáza C v živých buňkách: aktivace, inhibice, potřeba Ca2 + a regulace M proudu“. The Journal of General Physiology. 126 (3): 243–62. doi:10.1085 / jgp.200509309. PMC 2266577. PMID 16129772.
- ^ Eurtivong, C .; Pilkington, L. I .; van Rensburg, M .; White, R. M .; Kaur Brar, H .; Rees, S .; Paulin, E. K .; Xu, C. S .; Sharma, N .; Leung, I. K. H .; Leung, E .; Barker, D .; Reynisson, J. (1. února 2020). „Objev nových fosfatidylcholin-specifických fosfolipázových C inhibitorů podobných lékům jako potenciálních protinádorových látek“. European Journal of Medicinal Chemistry. 187: 111919. doi:10.1016 / j.ejmech.2019.111919. PMID 31810783.CS1 maint: používá parametr autoři (odkaz)
- ^ Pilkington, L. I .; Sparrow, K .; Rees, S. W. P .; Paulin, E. K .; van Rensburg, M .; Xu, C. S .; Langley, R. J .; Leung, I. K. H .; Reynisson, J .; Leung, E .; Barker, D. (2020). „Vývoj, syntéza a biologický výzkum nové třídy silných inhibitorů PC-PLC“. European Journal of Medicinal Chemistry. 191: 112162. doi:10.1016 / j.ejmech.2020.112162. PMID 32101781.CS1 maint: používá parametr autoři (odkaz)
- ^ Little C, Otnåss AB (červen 1975). "Závislost kovových iontů na fosfolipáze C z Bacillus cereus". Biochimica et Biophysica Acta (BBA) - Enzymologie. 391 (2): 326–33. doi:10.1016/0005-2744(75)90256-9. PMID 807246.
- ^ „Fosfolipáza C, specifická pro fosfatidylinositol z Bacillus cereus“ (PDF). Informace o produktu. Sigma Aldrich.
- ^ Hilgemann DW (říjen 2007). "Místní signály PIP (2): kdy, kde a jak?". Archiv Pflügers. 455 (1): 55–67. doi:10.1007 / s00424-007-0280-9. PMID 17534652. S2CID 29839094.
- ^ Falkenburger BH, Jensen JB, Dickson EJ, Suh BC, Hille B (září 2010). "Fosfoinositidy: lipidové regulátory membránových proteinů". The Journal of Physiology. 588 (Pt 17): 3179–85. doi:10.1113 / jphysiol.2010.192153. PMC 2976013. PMID 20519312.
- ^ A b C Alberts B, Lewis J, Raff M, Roberts K, Walter P (2002). Molekulární biologie buňky (4. vydání). New York: Garland Science. ISBN 978-0-8153-3218-3.
- ^ Li Z, Jiang H, Xie W, Zhang Z, Smrcka AV, Wu D (únor 2000). „Role PLC-beta2 a -beta3 a PI3Kgamma v signální transdukci zprostředkované chemoatraktantem“. Věda. 287 (5455): 1046–9. doi:10.1126 / science.287.5455.1046. PMID 10669417.
- ^ Gresset A, Sondek J, Harden TK (2012). "Izozymy fosfolipázy C a jejich regulace". Fosfoinositidy I: Enzymy syntézy a degradace. Subcelulární biochemie. 58. 61–94. doi:10.1007/978-94-007-3012-0_3. ISBN 978-94-007-3011-3. PMC 3638883. PMID 22403074.
- ^ Piomelli, Daniele (01.04.1993). "Kyselina arachidonová v buněčné signalizaci" (PDF). Současný názor na buněčnou biologii. 5 (2): 274–280. doi:10.1016/0955-0674(93)90116-8. PMID 7685181.
- ^ Fujii Y, Sakurai J (květen 1989). „Kontrakce izolované aorty krysy způsobená alfa toxinem Clostridium perfringens (fosfolipáza C): důkazy o zapojení metabolismu kyseliny arachidonové“. British Journal of Pharmacology. 97 (1): 119–24. doi:10.1111 / j.1476-5381.1989.tb11931.x. PMC 1854495. PMID 2497921.
