Endonukleáza - Endonuclease
Endonukleázy jsou enzymy které štěpí fosfodiesterová vazba v rámci polynukleotid řetěz. Některé, jako např deoxyribonukleáza I, rozřezat DNA relativně nespecificky (bez ohledu na sekvenci), zatímco mnoho, obvykle nazývaných restrikční endonukleázy nebo restrikční enzymy, štěpí pouze na velmi specifických nukleotidových sekvencích. Endonukleázy se liší od exonukleázy, které štěpí konce rozpoznávacích sekvencí místo střední (endo) části. Některé enzymy známé jako „exo-endonukleázy„, ale nejsou omezeny na žádnou nukleázovou funkci, vykazující vlastnosti, které jsou jak endo-, tak exo.[1] Důkazy naznačují, že aktivita endonukleázy vykazuje zpoždění ve srovnání s aktivitou exonukleáz.[2]
Restrikční enzymy jsou endonukleázy z eubakterie a archaea které rozpoznávají specifickou sekvenci DNA.[3] Nukleotidová sekvence rozpoznaná pro štěpení restrikčním enzymem se nazývá restrikční místo. Typicky bude restrikčním místem a palindromický sekvence dlouhá asi čtyři až šest nukleotidů. Většina restrikčních endonukleáz štěpí řetězec DNA nerovnoměrně a zanechává komplementární jednovláknové konce. Tyto konce se mohou znovu spojit hybridizací a nazývají se „lepivé konce“. Po spárování mohou být fosfodiesterové vazby fragmentů spojeny DNA ligáza. Jsou známy stovky restrikčních endonukleáz, z nichž každá útočí na jiné restrikční místo. Fragmenty DNA štěpené stejnou endonukleázou mohou být spojeny dohromady bez ohledu na původ DNA. Taková DNA se nazývá rekombinantní DNA; DNA vytvořená spojením genů do nových kombinací.[4] Restrikční endonukleázy (restrikční enzymy ) jsou rozděleny do tří kategorií, typu I, typu II a typu III, podle jejich mechanismu působení. Tyto enzymy se často používají v genetické inženýrství dělat rekombinantní DNA pro zavedení do bakteriálních, rostlinných nebo zvířecích buněk, stejně jako v syntetická biologie.[5] Jednou z nejznámějších endonukleáz je Cas9.
Kategorie
Nakonec existují tři kategorie restrikční endonukleázy které relativně přispívají ke štěpení specifických sekvencí. Typy I a III jsou velké multisubunitové komplexy, které zahrnují oba endonukleázy a methyláza činnosti. Typ I se může od rozpoznávací sekvence štěpit na náhodných místech o velikosti asi 1000 párů bází a vyžaduje jako zdroj energie ATP. Typ II se chová mírně odlišně a byl poprvé izolován Hamiltonem Smithem v roce 1970. Jsou to jednodušší verze endonukleáz a ve svých procesech degradace nevyžadují žádnou ATP. Některé příklady restrikčních endonukleáz typu II zahrnují BamAHOJ, EcoRI, EcoRV, HindIII a HaeIII. Typ III však štěpí DNA na přibližně 25 párech bází od rozpoznávací sekvence a v procesu také vyžaduje ATP.[4]
Zápisy
Běžně používaný zápis pro restrikční endonukleázy[6] má formu "VwxyZ ", kde"Vwx„jsou kurzívou první písmeno rodu a první dvě písmena druhu, kde lze tuto restrikční endonukleázu nalézt, například Escherichia coli, Eco, a Haemophilus influenzae, Hin. Poté následuje nepovinný kurzívový symbol „y“, který označuje typ nebo identifikaci kmene, například EcoR pro E-coli kmeny nesoucí faktor přenosu lékové rezistence RTF-1,[6] EcoB pro E-coli kmen B,[7] a Hind pro H. influenzae kmen d.[6] Nakonec, když určitý typ nebo kmen má několik různých restrikčních endonukleáz, jsou identifikovány římskými číslicemi, tedy restrikční endonukleázy z H. influenzae kmen d jsou pojmenovány HindI, HindII, HindIII atd. Další příklad: "HaeII „a“HaeIII "označují bakterii Haemophilus aegyptius (kmen není specifikován), restrikční endonukleázy číslo II, respektive číslo III.[4]:64–64 Restrikční enzymy používané v molekulární biologii obvykle rozpoznávají krátké cílové sekvence přibližně 4 - 8 párů bází. Například EcoRI enzym rozpoznává a štěpí sekvenci 5 '- GAATTC - 3'.[8]
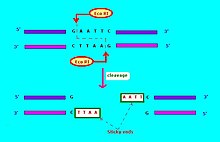
Restrikční endonukleázy mají několik typů. Restrikční endonukleáza typicky vyžaduje rozpoznávací místo a vzor štěpení (obvykle nukleotidových bází: A, C, G, T). Pokud je rozpoznávací místo mimo oblast štěpícího vzoru, potom se restrikční endonukleáza označuje jako typ I. Pokud se rozpoznávací sekvence překrývá se štěpnou sekvencí, potom restrikční endonukleáza restrikční enzym je typu II.
Další diskuse
Lze nalézt restrikční endonukleázy, které štěpí standardní dsDNA (dvouvláknová DNA) nebo ssDNA (jednořetězcová DNA) nebo dokonce RNA. Tato diskuse je omezena na dsDNA; diskusi však lze rozšířit na následující:
- Standardní dsDNA
- Nestandardní DNA
- Křižovatky Holliday
- Trojřetězcová DNA, čtyřřetězcová DNA (G-quadruplex )
- Dvouřetězcové hybridy DNA a RNA (jedno vlákno je DNA, druhé vlákno je RNA)[4]:72–73
- Syntetická nebo umělá DNA (například obsahující jiné báze než A, C, G, T, odkazují na dílo Eric T. Kool ). Výzkum se syntetickým kodony, odkazují na výzkum S. Bennera a zvětšení sady aminokyselin v polypeptidech, čímž se zvětší proteom nebo proteomika, viz výzkum P. Schultze.[4]:Kapitola 3
Kromě toho nyní probíhá výzkum konstruování syntetických nebo umělých restrikčních endonukleáz, zejména s rozpoznávacími místy, která jsou v genomu jedinečná.
Restrikční endonukleázy nebo restrikční enzymy obvykle se štěpí dvěma způsoby: tupými konci nebo lepkavými konci. Příklad restrikční endonukleázy typu I.[4]:64
Kromě toho existují Nespecifické endonukleázy DNA / RNA, jako jsou ty, které se nacházejí v Serratia marcescens, které působí na dsDNA, ssDNA a RNA.
Oprava DNA
Endonukleázy hrají roli při opravě DNA. AP endonukleáza konkrétně katalyzuje incizi DNA výhradně na AP místech, a proto připravuje DNA pro následnou excizi, reparační syntézu a ligaci DNA. Například, když dojde k vyčištění, tato léze zanechává deoxyribózový cukr s chybějící základnou.[9] AP endonukleáza rozpoznává tento cukr a v podstatě štěpí DNA na tomto místě a poté umožňuje pokračování opravy DNA.[10] E-coli Buňky obsahují dvě AP endonukleázy: endonukleázu IV (endoIV) a exonukleázu III (exoIII), zatímco v eukaryotech existuje pouze jedna AP endonukleáza.[11]

Běžné endonukleázy
Níže jsou uvedeny tabulky běžných prokaryotických a eukaryotických endonukleáz.[12]
| Prokaryotický enzym | Zdroj | Komentáře |
|---|---|---|
| RecBCD enonukleáza | E-coli | Částečně závislé na ATP; také exonukleáza; funkce při rekombinaci a opravách |
| T7 endonukleáza (P00641) | fág T7 (gen 3) | Nezbytné pro replikaci; preference pro jednořetězcovou před dvouřetězcovou DNA |
| T4 endonukleáza II (P07059) | fág T4 (denA) | Štěpí sekvenci -TpC za získání oligonukleotidů zakončených 5'-dCMP; délka řetězu produktu se liší podle podmínek |
| Bal 31 endonukleáza | P. espejiana | Také exonukleáza; okusuje 3 'a 5' konce duplexní DNA. Směs nejméně dvou nukleáz, rychlé a pomalé.[13] |
| Endonukleáza I (endo I; P25736) | E. coli (endA) | Periplazmatické umístění; průměrná délka řetězu produktu je 7; inhibována tRNA; produkuje dvouvláknový zlom DNA; produkuje nick v komplexu s tRNA; endo I mutanti rostou normálně |
| Mikrokokální nukleáza (P00644) | Staphylococcus | Produkuje 3'-P konce; vyžaduje Ca2 +; také působí na RNA; upřednostňuje jednovláknové DNA a oblasti bohaté na AT |
| Endonukleáza II (endo VI, exo III; P09030) | E. coli (xthA) | Štěpení vedle AP místa; také 3 '-> 5' exonukleáza; fosfomonoesteráza na 3'-P koncích |
| Eukaryotický enzym | Zdroj | Komentáře |
| Endonukleáza Neurospora[14] | Neurospora crassa, mitochondrie | Působí také na RNA. |
| S1 nukleáza (P24021) | Aspergillus oryzae | Působí také na RNA |
| P1-nukleáza (P24289) | Penicillium citrinum | Působí také na RNA |
| Nukleáza z fazolí mungo Já | klíčky fazole mungo | Působí také na RNA |
| Nukleáza Ustilago (Dnase I)[15] | Ustilago maydis | Působí také na RNA |
| Dnase I (P00639) | Hovězí pankreas | Průměrná délka řetězu produktu je 4; produkuje dvouvláknový zlom v přítomnosti Mn2 + |
| AP endonukleáza | Jádro, mitochondrie | Podílí se na opravné dráze DNA Base Excision Repair |
| Endo R.[16] | HeLa buňky | Specifické pro stránky GC |
Mutace
Xeroderma pigmentosa je vzácné, autozomálně recesivní onemocnění způsobené defektní UV-specifickou endonukleázou. Pacienti s mutacemi nejsou schopni opravit poškození DNA způsobené slunečním zářením.[17]
Srpkovitá anémie je onemocnění způsobené bodovou mutací. Sekvence pozměněná mutací eliminuje rozpoznávací místo pro restrikční endonukleázu MstII, které rozpoznává nukleotidovou sekvenci.[18]
Mutace endonukleázy sestřihu tRNA způsobují pontocerebelární hypoplázii. Pontocerebelární hypoplázie (PCH) představují skupinu neurodegenerativních autosomálně recesivních poruch, která je způsobena mutacemi ve třech ze čtyř různých podjednotek komplexu endonukleázy spojujícího tRNA.[19]
Viz také
Reference
- ^ "Vlastnosti exonukleáz a endonukleáz". New England BioLabs. 2017. Citováno 21. května 2017.
- ^ Slor, Hanoch (14. dubna 1975). „Diferenciace mezi exonukleázami a endonukleázami a mezi haplotomickými a diplotomickými endonukleázami za použití jamek plastických depresních desek potažených 3H-DNA jako substrátu“. Výzkum nukleových kyselin. 2 (6): 897–903. doi:10.1093 / nar / 2.6.897. PMC 343476. PMID 167356.
- ^ Stephen T. Kilpatrick; Jocelyn E. Krebs; Lewin, Benjamin; Goldstein, Elliott (2011). Lewinovy geny X. Boston: Jones a Bartlett. ISBN 978-0-7637-6632-0.
- ^ A b C d E F Cox M, Nelson DR, Lehninger AL (2005). Lehningerovy principy biochemie. San Francisco: W.H. Freemane. str.952. ISBN 978-0-7167-4339-2.
- ^ Simon M (2010). Naléhavý výpočet: Zdůraznění bioinformatiky. New York: Springer. str. 437. ISBN 978-1441919632.
- ^ A b C Smith, HO; Nathans, D (15. prosince 1973). "Navrhovaná nomenklatura pro bakteriální hostitelské modifikační a restrikční systémy a jejich enzymy". Journal of Molecular Biology. 81 (3): 419–23. doi:10.1016/0022-2836(73)90152-6. PMID 4588280.
- ^ Rubin, RA; Modrich, P (25. října 1977). "EcoRI methyláza". The Journal of Biological Chemistry. 252 (20): 7265–72. PMID 332688.
- ^ Losick R, Watson JD, Baker TA, Bell S, Gann S, Levine MW (2008). Molekulární biologie genu. San Francisco: Pearson / Benjamin Cummings. ISBN 978-0-8053-9592-1.
- ^ Ellenberger T, Friedberg EC, Walker GS, Wolfram S, Wood RJ, Schultz R (2006). Oprava DNA a mutageneze. Washington, DC: ASM Press. ISBN 978-1-55581-319-2.
- ^ Alberts B (2002). Molekulární biologie buňky. New York: Garland Science. ISBN 978-0-8153-3218-3.
- ^ Nishino T, Morikawa K (prosinec 2002). „Struktura a funkce nukleáz při opravě DNA: tvar, přilnavost a čepel nůžek na DNA“. Onkogen. 21 (58): 9022–32. doi:10.1038 / sj.onc.1206135. PMID 12483517.
- ^ Tania A. Baker; Kornberg, Arthur (2005). replikace DNA. University Science. ISBN 978-1-891389-44-3.
- ^ Wei, CF; Alianell, GA; Bencen, GH; Gray HB, Jr. (25. listopadu 1983). „Izolace a srovnání dvou molekulárních druhů nukleázy BAL 31 z Alteromonas espejiana s odlišnými kinetickými vlastnostmi“. The Journal of Biological Chemistry. 258 (22): 13506–12. PMID 6643438.
- ^ Linn, S; Lehman, IR (10. června 1966). "Endonukleáza z mitochondrií Neurospora crassa". The Journal of Biological Chemistry. 241 (11): 2694–9. PMID 4287861.
- ^ Holloman, WK; Holliday, R (10. prosince 1973). "Studie na nukleázu z Ustilago maydis. I. Čištění, vlastnosti a implikace v rekombinaci enzymu". The Journal of Biological Chemistry. 248 (23): 8107–13. PMID 4201782.
- ^ Gottlieb, J; Muzyczka, N (5. července 1990). "Čištění a charakterizace HeLa endonukleázy R. G-specifická savčí endonukleáza". The Journal of Biological Chemistry. 265 (19): 10836–41. PMID 2358441.
- ^ Stručný přehled lékařské biochemie. New York: Wiley. 2012. ISBN 978-0-470-65451-4.
- ^ Ferrier DR, Champe PC, Harvey RP (2008). Biochemie. Philadelphia: Wolters Kluwer / Lippincott Williams & Wilkins. ISBN 978-0-7817-6960-0.
- ^ Budde BS, Namavar Y, Barth PG, Poll-The BT, Nürnberg G, Becker C, van Ruissen F, Weterman MA, Fluiter K, te Beek ET, Aronica E, van der Knaap MS, Höhne W, Toliat MR, Crow YJ , Steinling M, Voit T, Roelenso F, Brussel W, Brockmann K, Kyllerman M, Boltshauser E, Hammersen G, Willemsen M, Basel-Vanagaite L, Krägeloh-Mann I, de Vries LS, Sztriha L, Muntoni F, Ferrie CD Battini R, Hennekam RC, Grillo E, Beemer FA, Stoets LM, Wollnik B, Nürnberg P, Baas F (září 2008). „mutace endonukleázy sestřihu tRNA způsobují pontocerebelární hypoplázii“. Nat. Genet. 40 (9): 1113–8. doi:10,1038 / ng.204. PMID 18711368.
