RNA-indukovaný umlčovací komplex - RNA-induced silencing complex
The RNA-indukovaný umlčovací komplexnebo RISC, je multiproteinový komplex, konkrétně a ribonukleoprotein, který zahrnuje jedno vlákno jednovláknové RNA (ssRNA) fragment, jako je mikroRNA (miRNA) nebo dvouvláknové malá interferující RNA (siRNA).[1] Jedno vlákno funguje jako šablona, kterou má RISC rozpoznat komplementární messenger RNA (mRNA) přepis. Jakmile byl nalezen, zavolal jeden z proteinů v RISC Argonaute, aktivuje a štěpí mRNA. Tento proces se nazývá Interference RNA (RNAi) a nachází se v mnoha eukaryoty; je to klíčový proces umlčování genů a obrana proti virové infekce.[2][3]
Objev
The biochemické identifikaci RISC provedl Gregory Hannon a jeho kolegové v Cold Spring Harbor Laboratory.[4] Bylo to jen pár let po objevu interference RNA v roce 1998 Andrew Fire a Craig Mello, který sdílel rok 2006 Nobelova cena za fyziologii nebo medicínu.[2]

Hannon a jeho kolegové se pokusili identifikovat mechanismy RNAi, kterých se účastní gen umlčení pomocí dsRNA, v Drosophila buňky. Drosophila Buňky S2 byly transfektovaný s lacZ expresivní vektor kvantifikovat genová exprese s β-galaktosidáza aktivita. Jejich výsledky ukázaly kotransfekci s lacZ dsRNA významně snížila aktivitu p-galaktosidázy ve srovnání s kontrolní dsRNA. Proto dsRNA kontrolují genovou expresi prostřednictvím sekvence doplňkovost.
Buňky S2 pak byly transfekovány Drosophila cyklin E dsRNA. Cyklin E je nezbytný gen pro buněčný cyklus postup do S fáze. Cyklin E dsRNA zastavil buněčný cyklus na G1 fáze (před fází S). Proto mohou RNAi cílit endogenní geny.
Kromě toho cyklin E dsRNA pouze snížila RNA cyklinu E - podobný výsledek byl také prokázán při použití dsRNA odpovídající cyklin A který působí v S, G2 a M fáze buněčného cyklu. To ukazuje charakteristický znak RNAi: snížené hladiny mRNA odpovídají přidaným hladinám dsRNA.
Chcete-li otestovat, zda jejich pozorování snížených hladin mRNA bylo výsledkem přímého cílení mRNA (jak naznačují údaje z jiných systémů), Drosophila Buňky S2 byly transfekovány buď Drosophila cyklin E dsRNA nebo lacZ dsRNA a poté inkubovány se syntetickými mRNA pro cyklin E nebo lacZ.
Buňky transfektované cyklinem E dsRNA vykazovaly degradaci pouze v transkriptech cyklinu E - lacZ přepisy byly stabilní. Naopak buňky transfekované lacZ dsRNA vykazovaly degradaci pouze v lacZ transkripty, nikoli přepisy cyklinu E. Jejich výsledky vedly Hannona a jeho kolegy k tomu, že navrhli, že RNAi degraduje cílovou mRNA prostřednictvím sekvenčně specifického nukleáza aktivita'. Pojmenovali nukleázu enzym RISC.[4]
Funkce při interferenci RNA

Načítání dsRNA
The RNáza III Hráč v kostky pomáhá RISC v interferenci RNA štěpením dsRNA na 21-23 nukleotid dlouhé fragmenty s dvěma nukleotidy 3' převis.[5][6] Tyto dsRNA fragmenty jsou zavedeny do RISC a každé vlákno má jiný osud na základě fenoménu pravidla asymetrie.[7][8][9]
- Pramen s méně stabilním 5 'konec je vybrán proteinem Argonaute a integrován do RISC.[9][10] Toto vlákno je známé jako vodicí vlákno.
- Druhé vlákno, známé jako vlákno pro cestující, je degradováno RISC.[11]

Regulace genů
RISC používá vázaný naváděcí řetězec k cílení na doplňkové 3'-nepřekládané oblasti (3'UTR) transkriptů mRNA prostřednictvím Watson-Crickovo párování základen.[12][13] RISC může nyní regulovat genovou expresi transkriptu mRNA mnoha způsoby.
degradace mRNA
Nejrozšířenější funkcí RISC je degradace cílové mRNA, která snižuje dostupné úrovně transkriptu, který má být přeložen ribozomy. Existují dva hlavní požadavky na to, aby došlo k degradaci mRNA:
- téměř dokonalá komplementární shoda mezi vodicím řetězcem a cílovou sekvencí mRNA a
- katalyticky aktivní protein Argonaute, nazývaný „kráječ“, který štěpí cílovou mRNA.[13]
Degradace mRNA je lokalizována v cytoplazmatický těla volala P-těla.[14]
Translační represe
RISC může modulovat zatížení faktorů ribozomu a příslušenství v překlad na potlačit exprese vázaného transkriptu mRNA. Translační represe vyžaduje pouze částečnou shodu sekvence mezi vodicím řetězcem a cílovou mRNA.[13]
Překlad lze regulovat v iniciačním kroku:
- zabránění vazbě eukaryotický iniciační faktor translace (eIF) do 5 'čepice. Bylo zjištěno, že RISC může deadenylát 3 ' poly (A) ocas což by mohlo přispět k represi přes 5 'čepici.[1][12]
- zabránění vazbě Ribosomální podjednotka 60S vazba na mRNA může potlačit překlad.[15]
Překlad lze regulovat v krocích po zahájení:
Stále se spekuluje o tom, zda se translační represe prostřednictvím iniciace a postinicializace vzájemně vylučují.
Tvorba heterochromatinu
Některá RISC jsou schopna přímo cílit na genom náborem histonmethyltransferázy tvořit heterochromatin na gen místo a tím umlčení genu. Tato RISC mají formu a Komplex tlumení transkripce indukovaný RNA (RITS). Nejlépe prostudovaným příkladem je droždí RITS.[13][18][19]
Mechanismus není dobře znám, ale RITS degraduje rodící se transkripty mRNA. Bylo navrženo, aby tento mechanismus fungoval jako „samonosný zpětnovazební smyčka „protože degradované rodící se přepisy používá RNA-dependentní RNA polymeráza (RdRp) pro generování více siRNA.[20]
Eliminace DNA
Zdá se, že RISC mají roli při degradaci DNA během somatický makronukleus vývoj v prvoky Tetrahymena. Je to podobné tvorbě heterochromatinu a předpokládá se to jako obrana proti napadení genetických prvků.[21]
Proteiny spojené s RISC
Úplná struktura RISC není dosud vyřešena. Mnoho studií uvádí řadu velikostí a komponentů pro RISC, ale není zcela jisté, zda je to kvůli množství RISC komplexů nebo kvůli různým zdrojům, které různé studie používají.[22]
| Komplex | Zdroj | Známé / zjevné složky | Odhadovaná velikost | Zdánlivá funkce v dráze RNAi |
|---|---|---|---|---|
| Dcr2-R2D2[23] | D. melanogaster Buňky S2 | Dcr2, R2D2 | ~ 250 kDa | zpracování dsRNA, vazba siRNA |
| RLC (A)[24][25] | D. melanogaster embrya | Dcr2, R2D2 | NR | zpracování dsRNA, vazba siRNA, předchůdce RISC |
| Holo-RISC[24][25] | D. melanogaster embrya | Před 2, Dcr1, Dcr2, Fmr1 /Fxr, R2D2, Tsn, Vig | ~ 80S | Vazba a štěpení cílové RNA |
| RISC[4][26][27][28] | D. melanogaster Buňky S2 | Ago2, Fmr1 / Fxr, Tsn, Vig | ~ 500 kDa | Vazba a štěpení cílové RNA |
| RISC[29] | D. melanogaster Buňky S2 | Před 2 | ~ 140 kDa | Vazba a štěpení cílové RNA |
| Komplex asociovaný s Fmr1[30] | D. melanogaster Buňky S2 | L5, L11, 5S rRNA, Fmr1 / Fxr, Ago2, Dmp68 | NR | Možná vazba a štěpení cílové RNA |
| Minimální RISC[31][32][33][34] | HeLa buňky | eIF2C1 (před 1) nebo eIF2C2 (Ago2) | ~ 160 kDa | Vazba a štěpení cílové RNA |
| miRNP[35][36] | HeLa buňky | eIF2C2 (ago2), Gemin3, Gemin4 | ~ 550 kDa | asociace miRNA, vazba na cílovou RNA a štěpení |
Před Argonaute; Dcr, Dicer; Dmp68, D. melanogaster ortolog savčí p68 uvolnění RNA; eIF2C1, eukaryotický iniciační faktor translace 2C1; eIF2C2, eukaryotický iniciační faktor translace 2C2; Fmr1 / Fxr, D. melanogaster ortholog proteinu mentální retardace fragile-X; miRNP, miRNA-proteinový komplex; NR, není hlášeno; Tsn, tudor-stafylokoková nukleáza; Vig, vasa intronický gen.

Bez ohledu na to je zřejmé, že jsou přítomny proteiny Argonaute a jsou nezbytné pro fungování. Kromě toho existují poznatky o některých klíčových proteinech (kromě Argonaute) v komplexu, které umožňují RISC vykonávat svou funkci.
Argonaute proteiny
Argonaute proteiny jsou rodina proteinů nalezených v prokaryoty a eukaryoty. Jejich funkce u prokaryot není známa, ale u eukaryot jsou zodpovědní za RNAi.[37] V lidských Argonautes je osm členů rodiny, z nichž pouze Argonaute 2 se výhradně účastní cíleného štěpení RNA v RISC.[34]

RISC-loading komplex
Komplex RISC-loading (RLC) je základní strukturou potřebnou k zavedení fragmentů dsRNA do RISC za účelem cílení mRNA. RLC se skládá z kostky, proteinu vázajícího transaktivační odpověď RNA (TRBP ) a Argonaute 2.
- Hráč v kostky je RNáza III endonukleáza který generuje dsRNA fragmenty, které mají být zavedeny, které řídí RNAi.
- TRBP je protein se třemi dvouvláknovými vazbami RNA domén.
- Argonaute 2 je RNáza a je katalytickým centrem RISC.
Dicer se přidruží k TRBP a Argonaute 2, aby usnadnil přenos fragmentů dsRNA generovaných Dicerem do Argonaute 2.[38][39]
Novější výzkum ukázal člověka RNA helikáza A může pomoci usnadnit RLC.[40]
Jiné bílkoviny
Nedávno identifikovaní členové RISC jsou SND1 a MTDH.[41] SND1 a MTDH jsou onkogeny a regulují expresi různých genů.[42]
| Protein | Druhy, ve kterých se protein nachází |
|---|---|
| Dcr1[24] | D. melanogaster |
| Dcr2[23][24][25] | D. melanogaster |
| R2D2[24][25] | D. melanogaster |
| Před 2[24][26][29][30] | D. melanogaster |
| Dmp68[30] | D. melanogaster |
| Fmr1 / Fxr[24][27][30] | D. melanogaster |
| Tsn[24][28] | D. melanogaster |
| Vig[24][27] | D. melanogaster |
| Polyribozomy, komponenty ribozomu[4][24][26][30][43] | D. melanogaster, T. brucei |
| eIF2C1 (před 1)[31] | H. sapiens |
| eIF2C2 (Ago2)[31][32][34][36] | H. sapiens |
| Gemin3[35][36] | H. sapiens |
| Gemin4[35][36] | H. sapiens |
Před Argonaute; Dcr, Dicer; Dmp68, D. melanogaster ortholog savčí p68 uvolnění RNA; eIF2C1, eukaryotický iniciační faktor translace 2C1; eIF2C2, eukaryotický iniciační faktor translace 2C2; Fmr1 / Fxr, D. melanogaster ortholog proteinu mentální retardace fragile-X; Tsn, tudor-stafylokoková nukleáza; Vig, vasa intronický gen.
Vazba mRNA
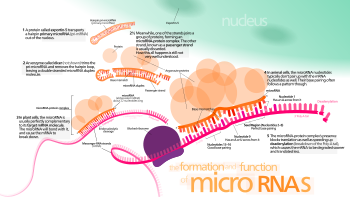
Dosud není jasné, jak aktivovaný komplex RISC lokalizuje mRNA cíle v buňce, i když se ukázalo, že proces může nastat v situacích mimo probíhající translaci proteinu z mRNA.[44]
Endogenně exprimovaná miRNA v metazoans obvykle není dokonale komplementární s velkým počtem genů, a proto modulují expresi translační represí.[45][46] Nicméně, v rostliny, proces má mnohem větší specificitu pro cílení mRNA a obvykle se každá miRNA váže pouze na jednu mRNA. Vyšší specificita znamená, že je pravděpodobnější, že dojde k degradaci mRNA.[47]
Viz také
Reference
- ^ A b Filipowicz W, Bhattacharyya SN, Sonenber N (2008). „Mechanismy post-transkripční regulace pomocí mikroRNA: jsou odpovědi v dohledu?“. Genetika hodnocení přírody. 9 (2): 102–114. doi:10.1038 / nrg2290. PMID 18197166.
- ^ A b Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC (1998). „Silná a specifická genetická interference dvouvláknovou RNA v Caenorhabditis elegans". Příroda. 391 (6669): 806–811. doi:10.1038/35888. PMID 9486653.
- ^ Watson, James D. (2008). Molekulární biologie genu. San Francisco, CA: Cold Spring Harbor Laboratory Press. 641–648. ISBN 978-0-8053-9592-1.
- ^ A b C d Hammond SM, Bernstein E, Beach D, Hannon GJ (2000). „Nukleáza zaměřená na RNA zprostředkovává posttranskripční umlčování genů v DNA Drosophila buňky ". Příroda. 404 (6775): 293–296. doi:10.1038/35005107. PMID 10749213.
- ^ Zamore PD, Tuschl T, Sharp PA, Bartel DP (2000). „RNAi: dvouvláknová RNA řídí ATP-závislé štěpení mRNA v intervalech 21 až 23 nukleotidů“. Buňka. 101 (1): 25–33. doi:10.1016 / S0092-8674 (00) 80620-0. PMID 10778853.
- ^ Vermeulen A, Behlen L, Reynolds A, Wolfson A, Marshall W, Karpilow J, Khvorova A (2005). „Příspěvek dsRNA struktury ke specifičnosti a efektivitě Dicer“. RNA. 11 (5): 674–682. doi:10,1261 / rna.7272305. PMC 1370754. PMID 15811921.
- ^ Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (2003). "Asymetrie v sestavě komplexu enzymů RNAi". Buňka. 115 (2): 199–208. doi:10.1016 / S0092-8674 (03) 00759-1. PMID 14567917.
- ^ Khvorova A, Reynolds A, Jayasena SD (2003). "Funkční siRNA a miRNA vykazují zkreslení vlákna". Buňka. 115 (2): 209–216. doi:10.1016 / S0092-8674 (03) 00801-8. PMID 14567918.
- ^ A b Siomi H, Siomi MC (2009). „Na cestě ke čtení kódu interference RNA“. Příroda. 457 (7228): 396–404. doi:10.1038 / nature07754. PMID 19158785.
- ^ Preall JB, He Z, Gorra JM, Sontheimer EJ (2006). „Krátký výběr interferujících RNA řetězců je nezávislý na polaritě zpracování dsRNA během RNAi v Drosophila". Aktuální biologie. 16 (5): 530–535. doi:10.1016 / j.cub.2006.01.061. PMID 16527750.
- ^ Gregory RI, Chendrimada TP, Cooch N, Shiekhattar R (2005). „Lidský RISC spojuje biogenezi mikroRNA a potlačení posttranskripčního genu“. Buňka. 123 (4): 631–640. doi:10.1016 / j.cell.2005.10.022. PMID 16271387.
- ^ A b Wakiyama M, Takimoto K, Ohara O, Yokoyama S (2007). "Let-7 microRNA zprostředkovaná mRNA deadenylace a translační represi v systému bezbuněčných savců". Geny a vývoj. 21 (15): 1857–1862. doi:10.1101 / gad.1566707. PMC 1935024. PMID 17671087.
- ^ A b C d Pratt AJ, MacRae IJ (2009). „Komplex umlčování vyvolaný RNA: Všestranný stroj pro umlčování genů“. Journal of Biological Chemistry. 284 (27): 17897–17901. doi:10,1074 / jbc.R900012200. PMC 2709356. PMID 19342379.
- ^ Sen GL, Blau HM (2005). „Argonaute2 / RISC se nachází v místech rozpadu savčí mRNA známém jako cytoplazmatická těla“. Přírodní buněčná biologie. 7 (6): 633–636. doi:10.1038 / ncb1265. PMID 15908945.
- ^ Chendrimada TP, Finn KJ, Ji X, Baillat D, Gregory RI, Liebhaber SA, Pasquinelli AE, Shiekhattar R (2007). "MikroRNA umlčení prostřednictvím RISC náboru eIF6". Příroda. 447 (7146): 823–828. doi:10.1038 / nature05841.
- ^ Petersen CP, Bordeleau ME, Pelletier J, Sharp PA (2006). "Krátké RNA potlačují translaci po iniciaci v savčích buňkách". Molekulární buňka. 21 (4): 533–542. doi:10.1016 / j.molcel.2006.01.031. PMID 16483934.
- ^ Maroney PA, Yu Y, Fisher J, Nilsen TW (2006). „Důkaz, že mikroRNA jsou spojeny s překladem messengerových RNA v lidských buňkách“. Přírodní strukturní a molekulární biologie. 13 (12): 1102–1107. doi:10.1038 / nsmb1174.
- ^ Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal SI, Moazed D (2004). "RNAi zprostředkované cílení heterchromatinu komplexem RITS". Věda. 303 (5658): 672–676. doi:10.1126 / science.1093686. PMC 3244756. PMID 14704433.
- ^ Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal SI, Moazed D (2004). „RITS působí v cis podporovat transkripci zprostředkovanou interferencí RNA a posttranskripční umlčování ". Genetika přírody. 36 (11): 1174–1180. doi:10.1038 / ng1452. PMID 15475954.
- ^ Sugiyama T, Cam H, Verdel A, Moazed D, Grewal SI (2005). „RNA-dependentní RNA polymeráza je nezbytnou součástí samonabíjecí smyčky spojující heterochromatinovou sestavu s produkcí siRNA“. Sborník Národní akademie věd Spojených států amerických. 102 (1): 152–157. doi:10.1073 / pnas.0407641102. PMC 544066. PMID 15615848.
- ^ Mochizuki K, Gorovsky MA (2004). "Malé RNA v uspořádání genomu v Tetrahymena". Aktuální názor na genetiku a vývoj. 14 (2): 181–187. doi:10.1016 / j.gde.2004.01.004.
- ^ A b C Sontheimer EJ (2005). "Sestavení a funkce komplexů umlčujících RNA". Nature Reviews Molecular Cell Biology. 6 (2): 127–138. doi:10.1038 / nrm1568.
- ^ A b Liu Q, Rand TA, Kalidas S, Du F, Kim HE, Smith DP, Wang X (2003). "R2D2, most mezi iniciačními a efektorovými kroky Drosophila Dráha RNAi ". Věda. 301 (5641): 1921–1925. doi:10.1126 / science.1088710. PMID 14512631.
- ^ A b C d E F G h i j Pham JW, Pellio JL, Lee YS, Carthew RW, Sontheimer EJ (2004). „Komplex 80S závislý na Dicer-2 štěpí cílené mRNA během RNAi v Drosophila". Buňka. 117 (1): 83–94. doi:10.1016 / S0092-8674 (04) 00258-2.
- ^ A b C d Tomari Y, Du T, Haley B, Schwarz DS, Bennett R, Cook HA, Koppetsch BS, Theurkauf WE, Zamore PD (2004). "Vady sestavy RISC v Drosophila RNAi mutant armitáž". Buňka. 116 (6): 831–841. doi:10.1016 / S0092-8674 (04) 00218-1. PMID 15035985.
- ^ A b C Hammond SM, Boettcher S, Caudy AA, Kobayashi R, Hannon GJ (2001). „Argonaute2, spojení mezi genetickými a biochemickými analýzami RNAi“. Věda. 293 (5532): 1146–1150. doi:10.1126 / science.1064023. PMID 11498593.
- ^ A b C Caudy AA, Myers M, Hannon GJ, Hammond SM (2002). „Křehký protein související s X a VIG se spojuje s interferenčním mechanismem RNA“. Geny a vývoj. 16 (19): 2491–2496. doi:10.1101 / gad.1025202. PMC 187452. PMID 12368260.
- ^ A b Caudy AA, Ketting RF, Hammond SM, Denli AM, Bathoorn AM, Tops BB, Silva JM, Myers MM, Hannon GJ, Plasterk RH (2003). "Mikokokový homolog nukleázy v efektorových komplexech RNAi". Příroda. 425 (6956): 411–414. doi:10.1038 / nature01956. PMID 14508492.
- ^ A b Rand TA, Ginalski K, Grishin NV, Wang X (2004). „Biochemická identifikace Argonaute 2 jako jediného proteinu požadovaného pro aktivitu komplexu umlčování vyvolaného RNA“. Sborník Národní akademie věd Spojených států amerických. 101 (40): 14385–14389. doi:10.1073 / pnas.0405913101. PMC 521941. PMID 15452342.
- ^ A b C d E Ishizuka A, Siomi MC, Siomi H (2002). "A Drosophila křehký X protein interaguje se složkami RNAi a ribozomálních proteinů ". Geny a vývoj. 16 (19): 2497–2508. doi:10.1101 / gad.1022002. PMC 187455. PMID 12368261.
- ^ A b C Martinez J, Patkaniowska A, Urlaub H, Luhrmann R, Tuschl T (2002). "Jednovláknové antisense siRNA vedou štěpení cílové RNA v RNAi". Buňka. 110 (5): 563–574. doi:10.1016 / S0092-8674 (02) 00908-X. hdl:11858 / 00-001M-0000-0012-F2FD-2. PMID 12230974.
- ^ A b Liu J, Carmell MA, Rivas FV, Marsden CG, Thomson JM, Song JJ, Hammond SM, Joshua-Tor L, Hannon GJ (2004). „Argonaute2 je katalytický motor savčích RNAi“. Věda. 305 (5689): 1437–1441. doi:10.1126 / science.1102513. PMID 15284456.
- ^ Martinez J, Tuschl T (2004). "RISC je 5 'fosfomonoester produkující RNA endonukleáza". Geny a vývoj. 18 (9): 975–980. doi:10.1101 / gad.1187904. PMC 406288. PMID 15105377.
- ^ A b C Meister G, Landthaler M, Patkaniowska A, Dorsett Y, Teng G, Tuschl T (2004). „Human Argonaute2 zprostředkovává štěpení RNA cílené miRNA a siRNA“. Molekulární buňka. 15 (2): 1403–1408. doi:10.1016 / j.molcel.2004.07.007. PMID 15260970.
- ^ A b C Mourelatos Z, Dostie J, Paushkin S, Sharma A, Charroux B, Abel L, Rappsilber J, Mann M, Dreyfuss G (2002). „miRNPs: nová třída ribonukleoproteinů obsahujících četné mikroRNA“. Geny a vývoj. 16 (6): 720–728. doi:10,1101 / gad.974702. PMC 155365. PMID 11914277.
- ^ A b C d Hutvágner G, Zamore PD (2002). "MikroRNA v komplexu enzymů RNAi s více obraty". Věda. 297 (5589): 2056–2060. doi:10.1126 / science.1073827. PMID 12154197.
- ^ Hall TM (2005). "Struktura a funkce proteinů Argonaute". Buňka. 13 (10): 1403–1408. doi:10.1016 / j.str.2005.08.005.
- ^ Chendrimada TP, Gregory RI, Kumaraswamy E, Norman J, Cooch N, Nishikura K, Shiekhatter R (2005). „TRBP rekrutuje komplex Dicer na Ago2 pro zpracování mikroRNA a umlčení genů“. Příroda. 436 (7051): 740–744. doi:10.1038 / nature03868. PMC 2944926. PMID 15973356.
- ^ Wang HW, Noland C, Siridechadilok B, Taylor DW, Ma E, Felderer K, Doudna JA, Nogales E (2009). „Strukturální pohledy na zpracování RNA lidským komplexem RISC-načítání“. Přírodní strukturní a molekulární biologie. 16 (11): 1148–1153. doi:10.1038 / nsmb.1673. PMC 2845538. PMID 19820710.
- ^ Fu Q, Yuan YA (2013). „Strukturální vhledy do sestavy RISC usnadněné dsRNA-vazebnými doménami lidských RNA helixů A (DHX9)“. Výzkum nukleových kyselin. 41 (5): 3457–3470. doi:10.1093 / nar / gkt042. PMC 3597700. PMID 23361462.
- ^ Yoo BK, Santhekadur PK, Gredler R, Chen D, Emdad L, Bhutia S, Pannell L, Fisher PB, Sarkar D (2011). „Zvýšená aktivita umlčovacího komplexu indukovaného RNA (RISC) přispívá k hepatocelulárnímu karcinomu“. Hepatologie. 53 (5): 1538–1548. doi:10.1002 / hep.24216. PMC 3081619. PMID 21520169.
- ^ Yoo BK, Emdad L, Lee SG, Su Z, Santhekadur P, Chen D, Gredler R, Fisher PB, Sarkar D (2011). „Gen zvýšený v astrocytech (AEG-1): multifunkční regulátor normální a abnormální fyziologie“. Farmakologie a terapeutika. 130 (1): 1–8. doi:10.1016 / j.pharmthera.2011.01.008. PMC 3043119. PMID 21256156.
- ^ Djikeng A, Shi H, Tschudi C, Shen S, Ullu E (2003). „Bylo zjištěno, že ribonukleoprotein siRNA je asociován s polyribosomy v Trypanosoma brucei". RNA. 9 (7): 802–808. doi:10,1261 / rna.5270203. PMC 1370447. PMID 12810914.
- ^ Sen GL, Wehrman TS, Blau HM (2005). „Translace mRNA není předpokladem pro malé interferující štěpení mRNA zprostředkované RNA“. Diferenciace. 73 (6): 287–293. doi:10.1111 / j.1432-0436.2005.00029.x. PMID 16138829.
- ^ Saumet A, Lecellier CH (2006). „Ztlumení antivirové RNA: vypadáme jako rostliny?“. Retrovirologie. 3: 3. doi:10.1186/1742-4690-3-3. PMC 1363733. PMID 16409629.
- ^ Bartel DP (2009). „MicroRNA: rozpoznávání cílů a regulační funkce“. Buňka. 136 (2): 215–233. doi:10.1016 / j.cell.2009.01.002. PMC 3794896. PMID 19167326.
- ^ Jones-Rhoades MW, Bartel DP, Bartel B (2006). "MicroRNA a jejich role regulátorů v rostlinách". Roční přehled biologie rostlin. 57: 19–53. doi:10.1146 / annurev.arplant.57.032905.105218. PMID 16669754.
Další čtení
- Sontheimer, EJ (2005). "Sestavení a funkce komplexů umlčujících RNA". Nature Reviews Molecular Cell Biology. 6 (2): 127–138. doi:10.1038 / nrm1568.
- Fu Q, Yuan YA (březen 2013). „Strukturální pohledy na sestavení RISC usnadněné doménami vázajícími dsRNA lidské RNA helikázy A (DHX9)“. Výzkum nukleových kyselin. 41 (5): 3457–70. doi:10.1093 / nar / gkt042. PMC 3597700. PMID 23361462.
- Schwarz DS, Tomari Y, Zamore PD (2004). „Komplex umlčování vyvolaný RNA je Mg2+-závislá endonukleáza “. Aktuální biologie. 14 (9): 787–91. doi:10.1016 / j.cub.2004.03.008. PMID 15120070.
externí odkazy
- RNA-indukované + umlčování + komplex v americké národní lékařské knihovně Lékařské předměty (Pletivo)
