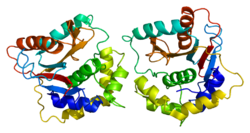
Ubikvitin karboxy-terminální hydroláza L1 - Ubiquitin carboxy-terminal hydrolase L1
Ubikvitin karboxy-terminální hydroláza L1 (ES 3.1.2.15, ubikvitin C-terminální hydroláza, UCH-L1) je deubikvitinační enzym.
| Ubikvitin Karboxy-terminální hydroláza L1 (UCH-L1) | |
|---|---|
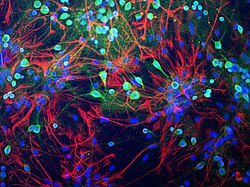 Neurony z potkaní mozkové tkáně obarvené zeleně protilátkou na ubikvitin C-terminální hydrolázu L1 (UCH-L1), která silně zvýrazní buněčné tělo a buněčné procesy slabší. Astrocyty jsou červeně obarveny protilátkou na protein GFAP nacházející se v cytoplazmatických vláknech. Jádra všech buněčných typů jsou obarvena modře barvivem vázajícím DNA. Protilátky, buněčná příprava a obraz generovaný EnCor Biotechnology Inc. | |
| Anatomické termíny mikroanatomie |
Funkce
UCH-L1 je členem rodiny genů, jejíž produkty hydrolyzují malé C-koncové adukty ubikvitinu za vzniku ubikvitinového monomeru. Exprese UCH-L1 je vysoce specifická pro neurony a pro buňky difúzního neuroendokrinního systému a jejich nádory. Je hojně přítomen ve všech neuronech (tvoří 1–2% celkového mozkového proteinu), vyjádřeno specificky v neuronech a varlatech / vaječnících.[5][6]
Katalytická triáda UCH-L1 obsahuje cystein v poloze 90, aspartát v poloze 176 a histidin v poloze 161, které jsou odpovědné za jeho aktivitu hydrolázy.[7]
Význam pro neurodegenerativní poruchy
A bodová mutace (I93M) v gen kódování tohoto proteinu je implikováno jako příčina Parkinsonova choroba v jedné německé rodině, i když je tento nález kontroverzní, protože nebyl nalezen žádný jiný pacient s Parkinsonovou chorobou s touto mutací.[8][9]
Dále, a polymorfismus Bylo zjištěno, že (S18Y) v tomto genu souvisí se sníženým rizikem Parkinsonovy choroby.[10] Ukázalo se, že tento polymorfismus má antioxidační aktivitu.[11]
Další potenciálně ochrannou funkcí UCH-L1 je jeho hlášená schopnost stabilizovat monoubikvitin, důležitá součást ubikvitinový proteazomový systém. Předpokládá se, že stabilizací monomerů ubikvitinu a tím zabráněním jejich degradaci zvyšuje UCH-L1 dostupnou zásobu ubikvitinu, která se má značit na proteiny určené k degradaci proteazomem.[12]
Gen je také spojován s Alzheimerova choroba a vyžadováno pro normální synaptický a poznávací funkce.[13] Ztráta Uchl1 zvyšuje náchylnost beta-buněk pankreatu k programované buněčné smrti, což naznačuje, že tento protein hraje ochrannou roli v neuroendokrinních buňkách a ilustruje souvislost mezi diabetem a neurodegenerativními chorobami.[14]
Pacienti s časnou neurodegenerací, u nichž byla příčinná mutace v genu UCHL1 (konkrétně ubiquitinová vazebná doména, E7A), vykazovali slepotu, cerebelární ataxii, nystagmus, dysfunkci hřbetního sloupce a dysfunkci horních motorických neuronů.[15]
Mimomaternicový výraz
Ačkoli je exprese proteinu UCH-L1 specifická pro neurony a tkáně varlat / vaječníků, bylo zjištěno, že je exprimován v určitých buněčných liniích nádorů plic.[16] Tato abnormální exprese UCH-L1 se podílí na rakovině a vedla k označení UCH-L1 jako onkogen.[17]Dále existují důkazy, že UCH-L1 může hrát roli v patogenezi membránové glomerulonefritidy, protože exprese UCH-L1 de novo v podocytech byla pozorována u PHN, modelu potkana lidského mGN.[18]Předpokládá se, že tato exprese UCH-L1 indukuje alespoň částečně hypertrofii podocytů.[19]
Struktura bílkovin
Lidský UCH-L1 a blízce příbuzný protein UCHL3 mít jeden z nejsložitějších uzel dosud objevená struktura proteinu s pěti kříženími uzlů. Spekuluje se, že struktura uzlu může zvýšit odolnost proteinu vůči degradaci v proteazom.[20][21]
Konformace proteinu UCH-L1 může být také důležitým indikátorem neuroprotekce nebo patologie. Například bylo prokázáno, že dimer UCH-L1 vykazuje potenciálně patogenní ligázovou aktivitu a může vést k výše uvedenému zvýšení agregace a-synukleinu.[22] Ukázalo se, že polymorfismus S18Y UCH-L1 je méně náchylný k dimerizaci.[12]
Interakce
Bylo prokázáno, že ubikvitin karboxy-terminální hydroláza L1 komunikovat s COP9 konstitutivní fotomorfogenní homologická podjednotka 5.[23]
Bylo také prokázáno, že UCH-L1 interaguje s a-synuklein, další protein podílející se na patologii Parkinsonova choroba. Uvádí se, že tato aktivita je výsledkem její aktivity všudypřítomné ligázy, která může být spojena s patogenní mutací I93M v genu.[22]
V poslední době byla prokázána interakce UCH-L1 s E3 ligázou, zaparkovat. Bylo prokázáno, že Parkin se váže a podporuje ubikvitinylát UCH-L1 lysozomální degradace UCH-L1.[24]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000154277 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000029223 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Doran JF, Jackson P, Kynoch PA, Thompson RJ (červen 1983). „Izolace PGP 9.5, nového proteinu specifického pro lidský neuron, detekovaného dvourozměrnou elektroforézou s vysokým rozlišením“. Journal of Neurochemistry. 40 (6): 1542–7. doi:10.1111 / j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- ^ "Entrez Gene: UCHL1 ubikvitin karboxyl-terminální esteráza L1 (ubikvitin thiolesteráza)".
- ^ Das C, Hoang QQ, Kreinbring CA, Luchansky SJ, Meray RK, Ray SS, Lansbury PT, Ringe D, Petsko GA (březen 2006). „Strukturální základ pro konformační plasticitu ubikvitin hydrolázy spojené s Parkinsonovou chorobou UCH-L1“. Sborník Národní akademie věd Spojených států amerických. 103 (12): 4675–80. doi:10.1073 / pnas.0510403103. PMC 1450230. PMID 16537382.
- ^ Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (říjen 1998 ). "Cesta ubikvitinu při Parkinsonově nemoci". Příroda. 395 (6701): 451–2. doi:10.1038/26652. PMID 9774100. S2CID 204997455.
- ^ Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (červenec 1999). „Mutace Ile93Met v genu ubiquitin karboxy-terminální-hydrolázy-L1 není v evropských případech s familiární Parkinsonovou chorobou pozorována.“ Neurovědy Dopisy. 270 (1): 1–4. doi:10.1016 / s0304-3940 (99) 00465-6. PMID 10454131. S2CID 26352360.
- ^ Wang J, Zhao CY, Si YM, Liu ZL, Chen B, Yu L (červenec 2002). "ACT a UCH-L1 polymorfismy u Parkinsonovy nemoci a věku nástupu". Poruchy pohybu. 17 (4): 767–71. doi:10,1002 / mds.10179. PMID 12210873. S2CID 23026015.
- ^ Kyratzi E, Pavlaki M, Stefanis L (červenec 2008). „Polymorfní varianta S18Y UCH-L1 poskytuje antioxidační funkci neuronálním buňkám“. Lidská molekulární genetika. 17 (14): 2160–71. doi:10,1093 / hmg / ddn115. PMID 18411255.
- ^ A b Osaka H, Wang YL, Takada K, Takizawa S, Setsuie R, Li H, Sato Y, Nishikawa K, Sun YJ, Sakurai M, Harada T, Hara Y, Kimura I, Chiba S, Namikawa K, Kiyama H, Noda M , Aoki S, Wada K (srpen 2003). „Ubiquitin karboxy-terminální hydroláza L1 se váže na a stabilizuje monoubiquitin v neuronu“. Lidská molekulární genetika. 12 (16): 1945–58. doi:10,1093 / hmg / ddg211. PMID 12913066.
- ^ Gong B, Cao Z, Zheng P, Vitolo OV, Liu S, Staniszewski A, Moolman D, Zhang H, Shelanski M, Arancio O (srpen 2006). „Ubikvitin hydroláza Uch-L1 zachraňuje poklesy synaptické funkce a kontextové paměti vyvolané beta-amyloidy“. Buňka. 126 (4): 775–88. doi:10.1016 / j.cell.2006.06.046. PMID 16923396. S2CID 10916274.
- ^ Chu KY, Li H, Wada K, Johnson JD (leden 2012). „Ubiquitin C-terminální hydroláza L1 je nutná pro přežití beta buněk pankreatu a funkci v lipotoxických podmínkách“. Diabetologie. 55 (1): 128–40. doi:10.1007 / s00125-011-2323-1. PMID 22038515.
- ^ Bilguvar K, Tyagi NK, Ozkara C, Tuysuz B, Bakircioglu M, Choi M, Delil S, Caglayan AO, Baranoski JF, Erturk O, Yalcinkaya C, Karacorlu M, Dincer A, Johnson MH, Mane S, Chandra SS, Louvi A Boggon TJ, Lifton RP, Horwich AL, Gunel M (únor 2013). „Recesivní ztráta funkce neuronální ubikvitinhydrolázy UCHL1 vede k progresivní neurodegeneraci s časným nástupem“. Sborník Národní akademie věd Spojených států amerických. 110 (9): 3489–94. doi:10.1073 / pnas.1222732110. PMC 3587195. PMID 23359680.
- ^ Liu Y, Lashuel HA, Choi S, Xing X, případ A, Ni J, Yeh LA, Cuny GD, Stein RL, Lansbury PT (září 2003). „Objev inhibitorů, které objasňují roli aktivity UCH-L1 v buněčné linii rakoviny plic H1299“. Chemie a biologie. 10 (9): 837–46. doi:10.1016 / j.chembiol.2003.08.010. PMID 14522054.
- ^ Hussain S, Foreman O, Perkins SL, Witzig TE, Miles RR, van Deursen J, Galardy PJ (září 2010). „Ubiquitináza UCH-L1 je onkogen, který řídí vývoj lymfomu in vivo deregulováním signalizace PHLPP1 a Akt“. Leukémie. 24 (9): 1641–55. doi:10.1038 / leu.2010.138. PMC 3236611. PMID 20574456.
- ^ Meyer-Schwesinger C, Meyer TN, Münster S, Klug P, Saleem M, Helmchen U, Stahl RA (únor 2009). „Nová role neuronového ubikvitinu C-terminální hydroláza-L1 (UCH-L1) při tvorbě podocytárního procesu a poškození podocytů v lidských glomerulopatiích“. The Journal of Pathology. 217 (3): 452–64. doi:10,1002 / cesta 2446. PMID 18985619. S2CID 23851206.
- ^ Lohmann F, Sachs M, Meyer TN, Sievert H, Lindenmeyer MT, Wiech T, Cohen CD, Balabanov S, Stahl RA, Meyer-Schwesinger C (červenec 2014). „UCH-L1 indukuje hypertrofii podocytů v membranózní nefropatii akumulací bílkovin“. Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1842 (7): 945–58. doi:10.1016 / j.bbadis.2014.02.011. PMID 24583340.
- ^ Peterson, Ivars (2006-10-14). "Uzly v bílkovinách". Vědecké zprávy. Archivovány od originál dne 2008-04-21. Citováno 2008-09-11.
- ^ Virnau P, Mirny LA, Kardar M (září 2006). "Složité uzly v proteinech: funkce a vývoj". PLOS výpočetní biologie. 2 (9): e122. doi:10.1371 / journal.pcbi.0020122. PMC 1570178. PMID 16978047.
- ^ A b Liu Y, Fallon L, Lashuel HA, Liu Z, Lansbury PT (říjen 2002). „Gen UCH-L1 kóduje dvě protichůdné enzymatické aktivity, které ovlivňují degradaci alfa-synukleinu a náchylnost k Parkinsonově chorobě“. Buňka. 111 (2): 209–18. doi:10.1016 / s0092-8674 (02) 01012-7. PMID 12408865. S2CID 6849108.
- ^ Caballero OL, Resto V, Patturajan M, Meerzaman D, Guo MZ, Engles J, Yochem R, Ratovitski E, Sidransky D, Jen J (květen 2002). "Interakce a kolokace PGP9.5 s JAB1 a p27 (Kip1)". Onkogen. 21 (19): 3003–10. doi:10.1038 / sj.onc.1205390. PMID 12082530.
- ^ McKeon JE, Sha D, Li L, Chin LS (květen 2015). "Parkinem zprostředkovaná K63-polyubikvitinace cílí na ubikvitin C-terminální hydrolázu L1 pro degradaci autofagy-lysozomovým systémem". Buněčné a molekulární biologické vědy. 72 (9): 1811–24. doi:10.1007 / s00018-014-1781-2. PMC 4395523. PMID 25403879.
Další čtení
- Healy DG, Abou-Sleiman PM, Wood NW (říjen 2004). „Genetické příčiny Parkinsonovy choroby: UCHL-1“. Výzkum buněk a tkání. 318 (1): 189–94. doi:10.1007 / s00441-004-0917-3. PMID 15221445. S2CID 22530636.
- Rasmussen HH, van Damme J, Puype M, Gesser B, Celis JE, Vandekerckhove J (prosinec 1992). „Mikrosekvence 145 proteinů zaznamenané v databázi dvourozměrných gelových proteinů normálních lidských epidermálních keratinocytů“. Elektroforéza. 13 (12): 960–9. doi:10,1002 / elps.11501301199. PMID 1286667. S2CID 41855774.
- Edwards YH, Fox MF, Povey S, Hinks LJ, Thompson RJ, Day IN (říjen 1991). „Gen pro lidskou neuronově specifickou ubikvitinovou C-terminální hydrolázu (UCHL1, PGP9.5) se mapuje na chromozom 4p14“. Annals of Human Genetics. 55 (Pt 4): 273–8. doi:10.1111 / j.1469-1809.1991.tb00853.x. PMID 1840236. S2CID 25763146.
- Honoré B, Rasmussen HH, Vandekerckhove J, Celis JE (březen 1991). „Produkt neuronového proteinového genu 9.5 (IEF SSP 6104) je exprimován v kultivovaných lidských fibroblastech MRC-5 normálního původu a je silně down-regulován v jejich protějšcích transformovaných SV40“. FEBS Dopisy. 280 (2): 235–40. doi:10.1016 / 0014-5793 (91) 80300-R. PMID 1849484. S2CID 40473683.
- Den IN, Hinks LJ, Thompson RJ (červen 1990). „Struktura lidského genu kódujícího proteinový genový produkt 9.5 (PGP9.5), neuronově specifická ubikvitinová C-koncová hydroláza“. The Biochemical Journal. 268 (2): 521–4. doi:10.1042 / bj2680521. PMC 1131465. PMID 2163617.
- Den IN, Thompson RJ (leden 1987). "Molekulární klonování cDNA kódující lidský protein PGP 9.5. Nový cytoplazmatický marker pro neurony a neuroendokrinní buňky." FEBS Dopisy. 210 (2): 157–60. doi:10.1016/0014-5793(87)81327-3. PMID 2947814. S2CID 39218297.
- Doran JF, Jackson P, Kynoch PA, Thompson RJ (červen 1983). „Izolace PGP 9.5, nového proteinu specifického pro lidský neuron, detekovaného dvourozměrnou elektroforézou s vysokým rozlišením“. Journal of Neurochemistry. 40 (6): 1542–7. doi:10.1111 / j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- Onno M, Nakamura T, Mariage-Samson R, Hillova J, Hill M (březen 1993). „Lidský onkogen TRE17 je generován z rodiny homologních polymorfních sekvencí změnami jedné báze.“ DNA a buněčná biologie. 12 (2): 107–18. doi:10.1089 / dna.1993.12.107. PMID 8471161.
- Larsen CN, Price JS, Wilkinson KD (květen 1996). "Vazba substrátu a katalýza ubikvitinovými C-koncovými hydrolázami: identifikace dvou zbytků aktivního místa". Biochemie. 35 (21): 6735–44. doi:10.1021 / bi960099f. PMID 8639624.
- Nejlepší CL, Pudney J, Welch WR, Burger N, Hill JA (duben 1996). „Lokalizace a charakterizace populací bílých krvinek v lidském vaječníku během menstruačního cyklu a menopauzy“. Lidská reprodukce. 11 (4): 790–7. doi:10.1093 / oxfordjournals.humrep.a019256. PMID 8671330.
- D'Andrea V, Malinovsky L, Berni A, Biancari F, Biassoni L, Di Matteo FM, Corbellini L, Falvo L, Santoni F, Spyrou M, De Antoni E (říjen 1997). "Imunolokalizace PGP 9,5 v normálním lidském karcinomu ledvin a ledvin". Il Giornale di Chirurgia. 18 (10): 521–4. PMID 9435142.
- Larsen CN, Krantz BA, Wilkinson KD (březen 1998). „Substrátová specificita deubikvitinačních enzymů: ubikvitinové C-koncové hydrolázy“. Biochemie. 37 (10): 3358–68. doi:10.1021 / bi972274d. PMID 9521656.
- Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (říjen 1998 ). „Cesta ubikvitinu u Parkinsonovy choroby“. Příroda. 395 (6701): 451–2. doi:10.1038/26652. PMID 9774100. S2CID 204997455.
- Wada H, Kito K, Caskey LS, Yeh ET, Kamitani T (říjen 1998). "Štěpení C-konce NEDD8 pomocí UCH-L3". Sdělení o biochemickém a biofyzikálním výzkumu. 251 (3): 688–92. doi:10.1006 / bbrc.1998.9532. PMID 9790970.
- Leroy E, Boyer R, Polymeropoulos MH (prosinec 1998). "Intron-exonová struktura ubikvitinové c-terminální hydrolázy-L1". Výzkum DNA. 5 (6): 397–400. doi:10.1093 / dnares / 5.6.397. PMID 10048490.
- Lincoln S, Vaughan J, Wood N, Baker M, Adamson J, Gwinn-Hardy K, Lynch T, Hardy J, Farrer M (únor 1999). „Nízká frekvence patogenních mutací v genu pro ubikvitin karboxy-terminální hydrolázu u familiární Parkinsonovy choroby“. NeuroReport. 10 (2): 427–9. doi:10.1097/00001756-199902050-00040. PMID 10203348.
- Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (červenec 1999). „Mutace Ile93Met v genu ubiquitin karboxy-terminální-hydrolázy-L1 není v evropských případech s familiární Parkinsonovou chorobou pozorována.“ Neurovědy Dopisy. 270 (1): 1–4. doi:10.1016 / S0304-3940 (99) 00465-6. PMID 10454131. S2CID 26352360.
- Saigoh K, Wang YL, Suh JG, Yamanishi T, Sakai Y, Kiyosawa H, Harada T, Ichihara N, Wakana S, Kikuchi T, Wada K (září 1999). „Intragenní delece v genu kódujícím ubikvitin karboxy-terminální hydrolázu u myší gad“. Genetika přírody. 23 (1): 47–51. doi:10.1038/12647. PMID 10471497. S2CID 34253163.
- Mellick GD, Silburn PA (říjen 2000). „Polymorfismus genu S18Y ubikvitin karboxy-terminální hydrolázy-L1 neposkytuje ochranu před idiopatickou Parkinsonovou chorobou“. Neurovědy Dopisy. 293 (2): 127–30. doi:10.1016 / S0304-3940 (00) 01510-X. PMID 11027850. S2CID 25234210.
- Sharma N, McLean PJ, Kawamata H, Irizarry MC, Hyman BT (říjen 2001). „Alfa-synuklein má pozměněnou konformaci a vykazuje těsnou intermolekulární interakci s ubikvitinem v Lewyho tělech“. Acta Neuropathologica. 102 (4): 329–34. doi:10,1007 / s004010100369. PMID 11603807. S2CID 33892290.
externí odkazy
- Ubikvitin + karboxy-terminál + hydroláza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P09936 (Ubiquitin karboxyl-terminální hydroláza isozym L1) na PDBe-KB.