Fosfolipáza D - Phospholipase D
| Fosfolipáza D | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | PLDc | ||||||||
| Pfam | PF03009 | ||||||||
| InterPro | IPR001736 | ||||||||
| CHYTRÝ | SM00155 | ||||||||
| STRÁNKA | PDOC50035 | ||||||||
| SCOP2 | 1byr / Rozsah / SUPFAM | ||||||||
| OPM nadčeleď | 118 | ||||||||
| OPM protein | 3rlh | ||||||||
| CDD | cd00138 | ||||||||
| Membranome | 306 | ||||||||
| |||||||||
| fosfolipáza D | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 3.1.4.4 | ||||||||
| Číslo CAS | 9001-87-0 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Fosfolipáza D (ES 3.1.4.4, lipofosfodiesteráza II, lecitináza D, cholin fosfatáza) (PLD) je enzym z fosfolipáza nadčeleď. Fosfolipázy se vyskytují široce a lze je nalézt v široké škále organismů, včetně bakterií, kvasinek, rostlin, zvířat a virů.[1][2] Princip fosfolipázy D. Podklad je fosfatidylcholin, který to hydrolyzuje vyrábět signál molekula kyselina fosfatidová (PA) a rozpustný cholin. Rostliny obsahují četné geny, které kódují různé PLD izoenzymy, s molekulové hmotnosti v rozmezí od 90 do 125 kDa.[3] Savčí buňky kódují dvě izoformy fosfolipázy D: PLD1 a PLD2.[4] Fosfolipáza D je v mnoha zemích důležitým hráčem fyziologický procesy, včetně obchodování s membránami, cytoskeletální reorganizace, receptorem zprostředkovaná endocytóza, exocytóza, a migrace buněk.[5] Prostřednictvím těchto procesů to bylo dále zapleteno do patofyziologie více nemoci: zejména postup Parkinsonova choroba a Alzheimerova choroba, stejně jako různé rakoviny.[3][5] PLD může také pomoci nastavit práh citlivosti na anestezii a mechanickou sílu.[6][7]
Objev
Typ PLD aktivita poprvé ohlásili v roce 1947 Donald J. Hanahan a I.L. Chaikoff.[1] To nebylo až do roku 1975, nicméně, že hydrolytický mechanismus účinku byl objasněn v savčí buňky. Rostlina izoformy PLD byli první očištěno ze zelí a fazole; PLDα byl nakonec naklonovaný a charakterizované z různých rostlin, včetně rýže, kukuřice a rajčat.[1] Rostlinné PLD byly klonovány do tří izoforem: PLDα, PLDβ, a PLDγ.[8]Více než půl století biochemických studií zahrnovalo fosfolipázu D a PA činnost v širokém rozsahu fyziologické procesy a nemoci, počítaje v to zánět, cukrovka, fagocytóza, neuronální & srdeční signalizace a onkogeneze.[9]
Funkce
Přísně vzato, fosfolipáza D je a transfosfatidyláza: zprostředkovává výměnu polárních hlavových skupin kovalentně připojených k lipidy vázané na membránu. Využití vody jako a nukleofil, tento enzym katalyzuje výstřih z fosfodiesterová vazba ve strukturálním fosfolipidy jako fosfatidylcholin a fosfatidylethanolamin.[3] Výrobky tohoto hydrolýza jsou vázány na membránu lipid kyselina fosfatidová (PA) a cholin, který šíří do cytosol. Tak jako cholin má málo druhý posel aktivita, aktivita PLD je většinou transdukované produkcí PA.[5][10] PA je silně zapojena do intracelulární signální transdukce.[11] Kromě toho někteří členové PLD nadčeleď může zaměstnat primární alkoholy jako ethanol nebo 1-butanol ve štěpení fosfolipid, účinně katalyzující výměnu polární lipidová hlavní skupina.[3][8] Ostatní členové této rodiny jsou schopni hydrolyzovat jiné fosfolipidové substráty, jako např kardiolipin, nebo dokonce fosfodiesterová vazba tvořící páteř DNA.[4]
Kyselina fosfatidová
Mnoho fosfolipáz D buněčné funkce jsou zprostředkovány jeho hlavním produktem, kyselina fosfatidová (PA). PA je záporně účtováno fosfolipid, jehož malé hlavní skupina propaguje zakřivení membrány.[4] Předpokládá se tedy, že to usnadní membrána -fúze vezikul a štěpení analogickým způsobem klatrinem zprostředkovaná endocytóza.[4] PA může také získávat bílkoviny které obsahují jeho odpovídající vazebná doména, a kraj charakterizovaný základní aminokyselina - bohaté regiony. Dodatečně, PA lze převést na řadu dalších lipidy, jako kyselina lysofosfatidová (lyso-PA) nebo diacylglycerol, signální molekuly které mají mnoho účinků na po proudu buněčné dráhy.[8]PA a jeho lipid deriváty jsou zapleteny do myriády procesy které zahrnují intracelulární obchodování s vezikuly, endocytóza, exocytóza, aktin dynamika cytoskeletu, proliferace buněk diferenciace, a migrace.[4]

Savčí PLD přímo interaguje s kinázy jako PKC, ERK, TYK a řídí signalizaci indikující, že tyto kinázy aktivují PLD.[12] Tak jako cholin je v buňce velmi hojný, aktivita PLD významně neovlivňuje hladiny cholinu a je nepravděpodobné, že by cholin hrál nějakou roli v signalizaci.
Kyselina fosfatidová je signální molekula a jedná na nábor SK1 na membrány. PA je extrémně krátkodobý a je rychlý hydrolyzovaný enzymem fosfatidát fosfatáza tvořit diacylglycerol (DAG). DAG lze také převést na PA pomocí DAG kináza. Ačkoli jsou PA a DAG vzájemně směnitelné, nejednají stejně cesty. Podněty že aktivovat PLD neaktivují enzymy po proudu DAG a naopak.
Je možné, že i když jsou PA a DAG vzájemně směnitelné, oddělené skupiny signalizace a nesignalizace lipidy mohou být zachovány. Studie naznačují, že DAG signalizace je zprostředkována polynenasycené DAG, zatímco PA odvozený z PLD je mononenasycené nebo nasycený. Funkční nasycený / mononenasycený PA lze tedy degradovat jeho hydrolýzou za vzniku nefunkčního nasyceného / mononenasyceného DAG, zatímco funkční polynenasycený DAG lze degradovat jeho převedením na nefunkční polynenasycený PA.[13][14][15]
Volala lysofosfolipáza D. autotaxin byl nedávno identifikován jako produkt hrající důležitou roli v buněčné proliferaci,kyselina lysofosfatidová (LPA).
Struktura
Rostlinné a živočišné PLD jsou konzistentní molekulární struktura, charakterizovaný místa katalýzy obklopen sortimentem regulační sekvence.[3] The Aktivní stránky PLD se skládá ze čtyř vysoce konzervovaný aminokyselina sekvence (I-IV), z toho motivy II a IV jsou zvláště konzervované. Tyto strukturální domény obsahují rozlišovací katalyzátor sekvence HxKxxxxD (HKD), kde H, K., a D jsou aminokyseliny histidin (H), lysin (K), kyselina asparagová (D), zatímco x představuje nekonzervativní aminokyseliny.[3][4] Tito dva HKD motivy svolávat hydrolytický aktivitu na PLD a jsou kritické pro jeho enzymatickou aktivitu in vitro a in vivo.[4][9] Hydrolýza z fosfodiesterová vazba nastane, když jsou tyto HKD sekvence správné blízkost.
Lidské proteiny obsahující tento motiv zahrnují:
PC -hydrolyzující PLD je a homolog z kardiolipin syntáza,[16][17] fosfatidylserin syntáza, bakteriální PLD a virové proteiny. Zdá se, že každý z nich má a duplikace domény což je patrné z přítomnosti dvou HKD motivy obsahující studnukonzervovaný histidin, lysin, a asparagin zbytky které mohou přispět k Aktivní stránky kyselina asparagová. An Escherichia coli endonukleáza (nuc) a podobné proteiny se zdají být PLD homology ale mají pouze jeden z těchto motivů.[18][19][20][21]
PLD geny navíc kódovat vysoce konzervované regulační domén: phox konsensuální sekvence (PX), pleckstrinová homologická doména (PH) a vazebné místo pro fosfatidylinositol 4,5-bisfosfát (PIP.)2).[2]
Mechanismus katalýzy
PLD-katalyzovaný hydrolýza bylo navrženo, aby probíhalo ve dvou fázích pomocí „ping-pong "mechanismus. V tomto schématu histidin zbytky každého motivu HKD postupně Záchvat the fosfolipid Podklad. Funguje jako nukleofily, složka imidazol skupiny z histidiny přechodná forma kovalentní vazby s fosfolipid, produkující krátkodobý středně pokročilí to může být snadno hydrolyzovaný vodou v následujícím krok.[3][11]
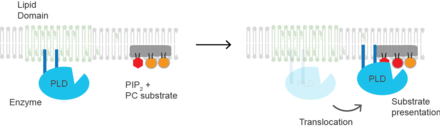
Mechanismus aktivace
Prezentace substrátu U savčích PLD2 je molekulárním základem aktivace prezentace substrátu. Enzym je neaktivní v lipidových mikrodoménách bohatých na sfingomyelin a zbavených PC substrátu.[22] Zvýšený PIP2 nebo pokles cholesterolu způsobí, že se enzym přemístí do PIP2 mikrodomén poblíž svého substrátu PC. PLD plechovka je tedy primárně aktivována spíše lokalizací v plazmatické membráně než změnou konformace proteinu. Narušení lipidových domén anestetiky.[23] nebo mechanická síla[22]. Protein může také projít konformační změnou po navázání PIP2, ale toto nebylo experimentálně prokázáno a představovalo by to mechanismus aktivace odlišný od prezentace substrátu.
Izoformy
Dva hlavní izoformy fosfolipázy D byla identifikována v savčí buňky: PLD1 a PLD2 (53% sekvenční homologie ),[24] každý kódován odlišně geny.[4] Zdá se, že aktivita PLD je přítomna ve většině typy buněk, s možnými výjimkami z periferní leukocyty a další lymfocyty.[9] Obě izoformy PLD vyžadují PIP2 jako kofaktor pro aktivita.[4] PLD1 a PLD2 vykazují různé subcelulární lokalizace které se v průběhu roku dynamicky mění signální transdukce. Aktivita PLD byla pozorována v rámci plazmatická membrána, cytosol, ER, a golgiho komplex.[9]
PLD1
PLD1 je 120 kDa protein, který se nachází hlavně na vnitřní membrány buněk. Je primárně přítomen na golgiho komplex, endozomy, lysozomy, a sekreční granule.[4] Na vazba z extracelulární podnět, PLD1 je přepravován do plazmatická membrána. Bazální aktivita PLD1 je však nízká a za účelem transduce extracelulární signál, musí to být nejprve aktivován podle bílkoviny jako Arf, Rho, Rac, a protein kináza C..[4][5][10]
PLD2Naproti tomu PLD2 je 106 kDa protein, který primárně lokalizuje do plazmatická membrána, sídlící ve světelné membráně lipidové rafty.[3][5] Má vysokou vnitřní katalytickou aktivitu a výše uvedenými molekulami je aktivován pouze slabě.[3] |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nařízení
Aktivita fosfolipázy D je značně rozšířena regulované podle hormony, neurotransmitery, lipidy, malé monomerní GTPázy a další malé molekuly svázat jejich odpovídajícím domén na enzymu.[3] Většinou, signální transdukce je zprostředkována produkcí kyselina fosfatidová, který funguje jako a sekundární posel.[3]
Charakteristický fosfolipidy jsou regulátory aktivity PLD v rostlinných a živočišných buňkách.[1][3] Většina PLD vyžaduje fosfatidylinositol 4,5-bisfosfát (PIP.)2), jako kofaktorů pro činnost.[2][3] PIP2 a další fosfoinositidy jsou důležitými modifikátory cytoskeletální dynamika a membránový transport a může přenášet PLD do svého substrátu PC.[25] PLD regulované těmito fosfolipidy jsou běžně zapojeni do intracelulární signální transdukce.[3] Jejich aktivita je závislá na jejich vazbě fosfoinositidy blízko Aktivní stránky.[3] U rostlin a zvířat je toto vazebné místo charakterizováno přítomností a konzervovaná sekvence z základní a aromatický aminokyseliny.[3][11] V rostlinách, jako je Arabidopsis thaliana, tento sekvence je tvořen a RxxxxxKxR motiv spolu s jeho obrácené opakování, kde R je arginin a K. je lysin. Své blízkost do Aktivní stránky zajišťuje vysokou úroveň PLD1 a PLD2 činnost a propaguje přemístění PLD1 až cílová membrány v reakci na extracelulární signály.[3]
Doména C2
Vápník působí jako kofaktor v PLD izoformy které obsahují Doména C2. Vazba Ca.2+ do Doména C2 vede k konformační změny v enzymu, který posiluje enzym-substrát vazba, zatímco oslabení sdružení s fosfoinositidy. V nějaké rostlině izoenzymy, jako PLDβ, Ca.2+ se mohou vázat přímo na Aktivní stránky, nepřímo zvyšuje jeho afinita pro Podklad posílením vazby aktivátoru PIP2.[3]
PX doména
The sekvence konsensu pbox (PX) Předpokládá se, že zprostředkovává vazbu dalších fosfatidylinositolfosfátů, zejména fosfatidylinositol 5-fosfát (PtdIns5P), což je lipid, o kterém se předpokládá, že je nezbytný endocytóza, může pomoci usnadnit reinternalizaci PLD1 z plazmatická membrána.[1]
Doména PH
Vysoce konzervativní Pleckstrinova homologická doména (PH) je strukturální doména přibližně 120 aminokyseliny v délce. To se váže fosfatidylinositidy jako fosfatidylinositol (3,4,5) -trifosfát (PIP.)3) a fosfatidylinositol (4,5) -bisfosfát (PIP.)2). Může se také vázat heterotrimerní G proteiny prostřednictvím jejich βγ-podjednotka. Vazba na to doména je také myšlenka usnadnit re-internalizace proteinu zvýšením jeho afinita na endocytotický lipidové rafty.[1]
Interakce s malými GTPázami
v zvíře buňky, malé bílkoviny faktory jsou důležité další regulátory aktivity PLD. Tyto malé monomerní GTPázy jsou členů z Rho a ARF rodiny Ras nadčeleď. Některé z těchto proteinů, jako např Rac1, Cdc42, a RhoA, alostericky aktivovat savčí PLD1, přímo zvyšuje svoji aktivitu. Zejména přemístění z cytosolický Faktor ribosylace ADP (ARF) do plazmatická membrána je nezbytný pro aktivaci PLD.[1][3]
Fyziologické a patofyziologické role
Intoxikace alkoholem
Fosfolipáza D metabolizuje ethanol na fosfatidyletanol (PEtOH) v procesu zvaném transposfatidylace. Použitím genetiky mušek bylo prokázáno, že PEtOH zprostředkovává hyperaktivní reakci alkoholu u ovocných mušek.[26] Ukázalo se, že ethanolová transfosfatidylace je nadměrně regulovaná u alkoholiků a členů rodiny alkoholiků[27] Tento mechanismus transfosfatidylace ethanolu se nedávno ukázal jako alternativní teorie pro účinek alkoholu na iontové kanály. Mnoho iontových kanálů je regulováno aniontovými lipidy.[28] a má se za to, že konkurence PEtOH s endogenními signálními lipidy v některých případech zprostředkovává účinek ethanolu na iontové kanály a ne přímou vazbu volného ethanolu na kanál.[26]
U rakoviny
Fosfolipáza D je regulátor několika důležitých buněčných procesů, včetně transport vezikul, endocytóza, exocytóza, migrace buněk, a mitóza.[5] Dysregulace z nich procesy je v karcinogeneze,[5] a zase abnormality v PLD výraz byly zapleteny do postup několika typy rakovina.[2][4] A mutace řidiče udělující zvýšenou aktivitu PLD2 bylo pozorováno u několika zhoubný rakoviny prsu.[4] Zvýšená PLD exprese také korelovala s velikost nádoru v kolorektální karcinom, karcinom žaludku, a rakovina ledvin.[4][5] Nicméně molekulární dráhy prostřednictvím kterého PLD řídí progresi rakoviny zůstávají nejasné.[4] Jeden potenciál hypotéza hraje při aktivaci fosfolipázy D rozhodující roli mTOR, potlačující rakovinná buňka apoptóza.[4] Schopnost PLD potlačit apoptóza v buňkách se zvýšenými tyrosinkináza aktivita z něj dělá kandidáta onkogen v rakoviny kde takové výraz je typické.[5]
U neurodegenerativních onemocnění
Fosfolipáza D může také hrát důležitou roli patofyziologické role v postup z neurodegenerativní onemocnění, zejména prostřednictvím své kapacity jako převodník signálu v nepostradatelném buněčné procesy jako cytoskeletální reorganizace a obchodování s vezikuly.[24] Dysregulace PLD proteinem a-synuklein Bylo prokázáno, že vede ke konkrétní ztrátě dopaminergní neurony v savci. a-synuklein je primární strukturální složkou Lewy těla, agregáty bílkovin to jsou charakteristické znaky Parkinsonova choroba.[4] Dezinhibice PLD od a-synuklein může přispět k Parkinsonova choroba škodlivé fenotyp.[4]
Abnormální aktivita PLD byla také podezřelá u Alzheimerova choroba, kde byla pozorována interakce s presenilin 1 (PS-1), hlavní složka y-sekretáza komplex odpovědný za enzymatické štěpení z amyloidový prekurzorový protein (APLIKACE). Mimobuněčný plakety produktu p-amyloid jsou určující Vlastnosti z Alzheimerova choroba mozky.[4] Akce PLD1 na PS-1 bylo prokázáno, že ovlivňuje intracelulární obchodování z prekurzor amyloidu k tomuto komplex.[4][24] Fosfolipáza D3 (PLD3), neklasický a špatně charakterizovaný člen PLD nadčeleď, byl také spojován s patogeneze této nemoci.[29]
Galerie
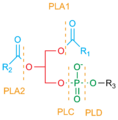
Místa štěpení fosfolipázou
Reference
- ^ A b C d E F G Jenkins GM, Frohman MA (říjen 2005). „Fosfolipáza D: recenze zaměřená na lipidy“. Buněčné a molekulární biologické vědy. 62 (19–20): 2305–16. doi:10.1007 / s00018-005-5195-z. PMID 16143829. S2CID 26447185.
- ^ A b C d Exton JH (2002). "Struktura, regulace a funkce fosfolipázy D". Recenze fyziologie, biochemie a farmakologie. 144: 1–94. doi:10.1007 / BFb0116585. ISBN 978-3-540-42814-5. PMID 11987824.
- ^ A b C d E F G h i j k l m n Ó p q r s Kolesnikov YS, Nokhrina KP, Kretynin SV, Volotovski ID, Martinec J, Romanov GA, Kravets VS (leden 2012). "Molekulární struktura fosfolipázy D a regulační mechanismy její aktivity v rostlinných a živočišných buňkách". Biochemie. Biokhimiia. 77 (1): 1–14. doi:10.1134 / S0006297912010014. PMID 22339628. S2CID 14815405.
- ^ A b C d E F G h i j k l m n Ó p q r s t Peng X, Frohman MA (únor 2012). "Fyziologické a patologické role savčí fosfolipázy D". Acta Physiologica. 204 (2): 219–26. doi:10.1111 / j.1748-1716.2011.02298.x. PMC 3137737. PMID 21447092.
- ^ A b C d E F G h i Foster DA, Xu L (září 2003). "Fosfolipáza D v buněčné proliferaci a rakovině". Výzkum molekulární rakoviny. 1 (11): 789–800. PMID 14517341.
- ^ Petersen EN, Gudheti M, Pavel MA, Murphy KR, Ja WW, Jorgensen EM, Hansen SB (5. září 2019). „Fosfolipáza D přenáší sílu na kanály TREK-1 v biologické membráně“. bioRxiv: 758896. doi:10.1101/758896.
- ^ Pavel MA, Petersen EN, Wang H, Lerner RA, Hansen SB (19. června 2019). „Studie mechanismu membránou zprostředkované celkové anestézie“. bioRxiv: 313973. doi:10.1101/313973.
- ^ A b C Banno Y (březen 2002). "Regulace a možná role savčí fosfolipázy D v buněčných funkcích". Journal of Biochemistry. 131 (3): 301–6. doi:10.1093 / oxfordjournals.jbchem.a003103. PMID 11872157. S2CID 24389113.
- ^ A b C d McDermott M, Wakelam MJ, Morris AJ (únor 2004). "Fosfolipáza D". Biochemie a buněčná biologie. 82 (1): 225–53. doi:10.1139 / o03-079. PMID 15052340.
- ^ A b Balboa MA, Firestein BL, Godson C, Bell KS, Insel PA (duben 1994). „Proteinkináza C alfa zprostředkovává aktivaci fosfolipázy D nukleotidy a forboesterem v psích ledvinových buňkách Madin-Darby. Stimulace fosfolipázy D je nezávislá na aktivaci fosfolipázy C specifické pro polyfosfolinositid a fosfolipázy A2.“ The Journal of Biological Chemistry. 269 (14): 10511–6. PMID 8144636.
- ^ A b C Leiros I, Secundo F, Zambonelli C, Servi S, Hough E (červen 2000). "První krystalová struktura fosfolipázy D". Struktura. 8 (6): 655–67. doi:10.1016 / S0969-2126 (00) 00150-7. PMID 10873862.
- ^ Paruch S, El-Benna J, Djerdjouri B, Marullo S, Périanin A (leden 2006). „Role p44 / 42 mitogenem aktivovaných proteinových kináz v aktivitě fosfolipázy D zprostředkované formyl-peptidovým receptorem a produkci oxidantu“. FASEB Journal. 20 (1): 142–4. doi:10.1096 / fj.05-3881fje. PMID 16253958. S2CID 28348537.
- ^ Bocckino SB, Blackmore PF, Wilson PB, Exton JH (listopad 1987). „Akumulace fosfatidátu v hepatocytech ošetřených hormony prostřednictvím mechanismu fosfolipázy D“. The Journal of Biological Chemistry. 262 (31): 15309–15. PMID 3117799.
- ^ Bocckino SB, Wilson PB, Exton JH (prosinec 1987). „Ca2 + -mobilizující hormony vyvolávají akumulaci fosfatidyletanolu aktivací fosfolipázy D“. FEBS Dopisy. 225 (1–2): 201–4. doi:10.1016/0014-5793(87)81157-2. PMID 3319693. S2CID 10674790.
- ^ Hodgkin MN, Pettitt TR, Martin A, Michell RH, Pemberton AJ, Wakelam MJ (červen 1998). „Diacylglyceroly a fosfatidáty: které molekulární druhy jsou intracelulárními posly?“. Trendy v biochemických vědách. 23 (6): 200–4. doi:10.1016 / S0968-0004 (98) 01200-6. PMID 9644971.
- ^ Nowicki M, Müller F, Frentzen M (duben 2005). "Cardiolipin syntáza z Arabidopsis thaliana". FEBS Dopisy. 579 (10): 2161–5. doi:10.1016 / j.febslet.2005.03.007. PMID 15811335. S2CID 21937549.
- ^ Nowicki M (2006). Charakterizace kardiolipin syntázy z Arabidopsis thaliana (Disertační práce). RWTH-Aachen University. Archivovány od originál dne 05.10.2011. Citováno 2011-07-11.
- ^ Ponting CP, Kerr ID (květen 1996). „Nová rodina homologů fosfolipázy D, která zahrnuje fosfolipidové syntázy a domnělé endonukleázy: identifikace duplikovaných opakování a potenciálních zbytků aktivního místa“. Věda o bílkovinách. 5 (5): 914–22. doi:10.1002 / pro.5560050513. PMC 2143407. PMID 8732763.
- ^ Koonin EV (červenec 1996). „Duplikovaný katalytický motiv v nové nadrodině fosfohydroláz a fosfolipidových syntáz, které zahrnují obalové proteiny poxviru“. Trendy v biochemických vědách. 21 (7): 242–3. doi:10.1016/0968-0004(96)30024-8. PMID 8755242.
- ^ Wang X, Xu L, Zheng L (srpen 1994). "Klonování a exprese fosfatidylcholinu hydrolyzující fosfolipázy D z Ricinus communis L". The Journal of Biological Chemistry. 269 (32): 20312–7. PMID 8051126.
- ^ Singer WD, Brown HA, Sternweis PC (1997). „Regulace eukaryotické fosfatidylinositol-specifické fosfolipázy C a fosfolipázy D“. Roční přehled biochemie. 66: 475–509. doi:10,1146 / annurev.biochem. 66.1.475. PMID 9242915.
- ^ A b Petersen EN, Chung HW, Nayebosadri A, Hansen SB (prosinec 2016). „Kinetické narušení lipidových vorů je mechanosenzorem pro fosfolipázu D“. Příroda komunikace. 7 (13873): 13873. Bibcode:2016NatCo ... 713873P. doi:10.1038 / ncomms13873. PMC 5171650. PMID 27976674.
- ^ Pavel MA, Petersen EN, Wang H, Lerner RA, Hansen SB (4. května 2018). „Studie mechanismu celkové anestezie“. bioRxiv: 313973. doi:10.1101/313973. PMID 32467161.
- ^ A b C Lindsley CW, Brown HA (leden 2012). „Fosfolipáza D jako terapeutický cíl při poruchách mozku“. Neuropsychofarmakologie. 37 (1): 301–2. doi:10.1038 / npp.2011.178. PMC 3238067. PMID 22157867.
- ^ Petersen EN, Chung HW, Nayebosadri A, Hansen SB (prosinec 2016). „Kinetické narušení lipidových vorů je mechanosenzorem pro fosfolipázu D“. Příroda komunikace. 7: 13873. Bibcode:2016NatCo ... 713873P. doi:10.1038 / ncomms13873. PMC 5171650. PMID 27976674.
- ^ A b Chung HW, Petersen EN, Cabanos C, Murphy KR, Pavel MA, Hansen AS a kol. (Leden 2019). „Molekulární cíl pro omezení alkoholu na délku řetězce“. Journal of Molecular Biology. 431 (2): 196–209. doi:10.1016 / j.jmb.2018.11.028. PMC 6360937. PMID 30529033.
- ^ Mueller GC, Fleming MF, LeMahieu MA, Lybrand GS, Barry KJ (prosinec 1988). „Syntéza fosfatidylethanolu - potenciální marker pro dospělé muže s rizikem alkoholismu“. Sborník Národní akademie věd Spojených států amerických. 85 (24): 9778–82. Bibcode:1988PNAS ... 85,9778M. doi:10.1073 / pnas.85.24.9778. PMC 282864. PMID 3200856.
- ^ Hansen SB (květen 2015). „Lipidový agonismus: PIP2 paradigma iontových kanálů řízených ligandem“. Biochimica et Biophysica Acta (BBA) - molekulární a buněčná biologie lipidů. 1851 (5): 620–8. doi:10.1016 / j.bbalip.2015.01.011. PMC 4540326. PMID 25633344.
- ^ Cruchaga C, Karch CM, Jin SC, Benitez BA, Cai Y, Guerreiro R a kol. (Leden 2014). „Vzácné kódující varianty v genu pro fosfolipázu D3 přinášejí riziko Alzheimerovy choroby“. Příroda. 505 (7484): 550–554. Bibcode:2014 Natur.505..550.. doi:10.1038 / příroda12825. PMC 4050701. PMID 24336208.
externí odkazy
- Fosfolipáza + D. v americké národní lékařské knihovně Lékařské předměty (Pletivo)



