Trirhenium nonachlorid - Trirhenium nonachloride
 | |
| Jména | |
|---|---|
| Název IUPAC Chlorid rhenitý | |
| Ostatní jména Chlorid rhenia | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.033.610 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| ReCl3 | |
| Molární hmotnost | 292,57 g / mol |
| Vzhled | červená, krystalická, netěkavá pevná látka |
| Hustota | 4800 kg / m3 |
| Bod tání | N / A |
| Bod varu | 500 ° C (932 ° F; 773 K) (rozkládá se) |
| hydrolyzuje za vzniku Re2Ó3.XH2Ó. | |
| Struktura | |
| Kosodélník, hR72 | |
| R-3m, č. 166 | |
| (trimerický pevné a v roztoku) (dimerní v kyselině octové) | |
| Nebezpečí | |
| Hlavní nebezpečí | Žíravý (C) |
| Bezpečnostní list | Externí bezpečnostní list |
| Související sloučeniny | |
jiný anionty | Tribromid rhenia Jodid rhenia |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Trirhenium nonachlorid je sloučenina se vzorcem ReCl3, někdy také psaný Re3Cl9. Je to tmavě červená hygroskopická pevná látka, která je nerozpustná v běžných rozpouštědlech. Sloučenina je důležitá v historii anorganická chemie jako časný příklad shlukové sloučeniny s vazbami kov-kov.[1] Používá se jako výchozí materiál pro syntézu dalších komplexů rhenia.
Struktura a fyzikální vlastnosti
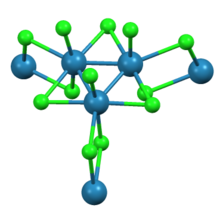
Jak ukazuje Rentgenová krystalografie trirhenium nonachlorid se skládá z Re3Cl12 podjednotky, které sdílejí tři chloridy mosty se sousedními klastry. Propojená síť klastrů tvoří listy. Kolem každého Re centra je sedm ligandů, čtyři přemosťující chloridy, jeden koncový chlorid a dvě Re-Re vazby.[2]
The oxidační teplo se hodnotí podle rovnice:
- 1/3 Re3Cl9 + 4 OH− + 2 OCl− → ReO4− + 2 H2O + 5Cl−
Entalpie pro tento proces je 190,7 ± 0,2 kcal / mol.[2]
Příprava a reakce
Sloučenina byla objevena v roce 1932, ačkoli tito pracovníci neurčili její strukturu, což je u chloridů kovů neobvyklé.[3] Trirhenium nonachlorid se účinně připravuje tepelným rozkladem chlorid rhenitý nebo kyselina hexachlororenová (IV):[4]
- 3 ReCl5 → Re3Cl9 + 3 Cl2
Pokud je vzorek vakuový sublimováno při 500 ° C je výsledný materiál poměrně nereaktivní, ale částečně hydratovaný materiál může být synteticky užitečnější. Jiné syntetické metody zahrnují ošetření rhenium s sulfurylchlorid. Tento proces se někdy provádí s přidáním chlorid hlinitý.[2] Získává se také zahříváním Re2(Ó2CCH3)4Cl2 pod HCl:
- 3/2 Re2(Ó2CCH3)4Cl2 + 6 HCl → Re3Cl9 + 6 HOD2CCH3
Reakce tri- a pentachloridů dává chlorid rhennatý:
- 3 ReCl5 + Re3Cl9 → 6 ReCl4
Reference
- ^ Cotton, F. A .; Walton, R. A. „Multiple Bonds Between Metal Atoms“ Oxford (Oxford): 1993. ISBN 0-19-855649-7.
- ^ A b C Colton, R. Chemie rhenia a technecia. 965.
- ^ Geilnann, W .; Wriuce, F. W .; Biltz. W.: Nachr. Ges. Wiss. Gottingen 1932, 579.
- ^ Lincoln, R .; Wilkinson, G. (1980). Trirhenium Nonachloride. Inorg. Synth. Anorganické syntézy. 20. str.44. doi:10.1002 / 9780470132517.ch12. ISBN 978-0-470-13251-7.
