Dichlorin heptoxid - Dichlorine heptoxide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Dichlorin heptoxid | |
| Ostatní jména Chlor (VII) oxid; Anhydrid chlornanu; (Perchloryloxy) chloran trioxid | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Cl2Ó7 | |
| Molární hmotnost | 182,901 g / mol |
| Vzhled | bezbarvá kapalina |
| Hustota | 1,9 g / cm3 |
| Bod tání | -91,57 ° C (-132,83 ° F; 181,58 K) |
| Bod varu | 82 ° C (180 ° F; 355 K) |
| hydrolyzuje za vzniku kyselina chloristá | |
| Nebezpečí | |
| Hlavní nebezpečí | oxidační činidlo, kontakt s výbušninou[1] |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
Související sloučeniny | Heptoxid manganatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Dichlorin heptoxid je chemická sloučenina s vzorec Cl2Ó7. Tento oxid chloričitý je anhydrid z kyselina chloristá. Vyrábí se opatrnou destilací kyseliny chloristé v přítomnosti dehydratačního činidla oxid fosforečný:[1]
- 2 HClO4 + P4Ó10 → Cl2Ó7 + H2P4Ó11
Oxid chloru (VII) lze ze směsi oddestilovat.
Může také vznikat osvětlením směsí chloru a ozón.[2] Pomalu hydrolyzuje zpět k kyselina chloristá, což je také nebezpečné, když bezvodý.
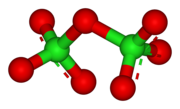
Struktura
Cl2Ó7 je endergonická molekula, což znamená, že je skutečně nestabilní a za uvolňování energie se rozkládá na své základní prvky:[3]
- 2 Cl2Ó7 → 2 Cl2 + 7 O.2 (ΔH ° = –132 kcal / mol)
Cl2Ó7 je ohnutá s úhlem Cl-O-Cl 118,6 °, což dává molekule C2 symetrie. Koncové vzdálenosti Cl-O jsou 1,709 Å a vzdálenosti Cl = O jsou 1,405 Å.[1] V této sloučenině existuje chlor v nejvyšší formální formě oxidační stav +7, i když vazba v této molekule je významně kovalentní.
Chemie
Dichlorid heptoxid reaguje s primárním a sekundárním aminy v chlorid uhličitý roztok k získání chloridových amidů:[4]
- 2 RNH
2 + Cl
2Ó
7 → 2 RNHClO
3 + H
2Ó - 2 R
2NH + Cl
2Ó
7 → 2 R
2NClO
3 + H
2Ó
Reaguje také s alkeny za vzniku alkylchloristanu. Například reaguje s propen v roztoku chloridu uhličitého, čímž se získá isopropylperchlorát a 1-chlor-2-propylchloristan.[5]
Dichlorid heptoxid je silně kyselý oxid a v roztoku vytváří rovnováhu s kyselinou chloristou.
Bezpečnost
I když se jedná o nejstabilnější oxid chloru, Cl2Ó7 je silný oxidant a výbušnina, kterou lze odpálit plamenem, mechanickým rázem nebo kontaktem s jód.[6] Přesto je méně silně oxidující než ostatní oxidy chloru a nenapadá síra, fosfor nebo papír když je zima.[1] Má na lidské tělo stejné účinky jako elementární chlór a vyžaduje stejná opatření.[7]
Reference
- ^ A b C d Holleman, Arnold F .; Wiberg, Egon (2001). Anorganická chemie. Přeložila Mary Eagleson; William Brewer. San Diego: Academic Press. p. 464. ISBN 0-12-352651-5.
- ^ Byrns, A. C .; Rollefson, G. K. (1934). „Tvorba chloridu penatoxidu při osvětlení směsí chloru a ozonu“. Journal of the American Chemical Society. 56 (5): 1250–1251. doi:10.1021 / ja01320a506.
- ^ Martin, Jan M. L (2006-10-12). „Tváře tvorby kyseliny chloristé, HClO4a anhydrid kyseliny chloristé, Cl2Ó7. Zkoumání mezí teorie W1 a W2 ". Journal of Molecular Structure: THEOCHEM. Modelovací struktura a reaktivita: 7. tříletá konference Světové asociace teoretických a výpočetních chemiků (WATOC 2005). 771 (1): 19–26. arXiv:fyzika / 0508076. doi:10.1016 / j.theochem.2006.03.035. ISSN 0166-1280.
- ^ Beard, C. D .; Baum, K. (1974). "Reakce dichlorheptoxidu s aminy". Journal of the American Chemical Society. 96 (10): 3237–3239. doi:10.1021 / ja00817a034.
- ^ Baum, K. (1976). "Reakce dichlordeptoxidu s olefiny". The Journal of Organic Chemistry. 41 (9): 1663–1665. doi:10.1021 / jo00871a048.
- ^ Lewis, Robert Alan (1998). Lewisův slovník toxikologie. CRC Press. p.260. ISBN 1-56670-223-2.
- ^ Jeanne Mager Stellman, vyd. (1998). „Halogeny a jejich sloučeniny“. Encyklopedie bezpečnosti a ochrany zdraví při práci (4. vydání). Mezinárodní organizace práce. p.104.210. ISBN 92-2-109817-6.

