Anorganická chemie - Inorganic chemistry - Wikipedia

A: Diborane funkce neobvyklé lepení
B: Chlorid cesný má archetypální Krystalická struktura
C: Fp2 je organokovový komplex
D: Silikon rozsah použití se pohybuje od prsní implantáty na Hloupý tmel
E: Grubbsův katalyzátor vyhrál Nobelova cena za rok 2005 pro jeho objevitel
F: Zeolity najít rozsáhlé použití jako molekulární síta
G: Octan měďnatý překvapený teoretici s jeho diamagnetismus
Anorganická chemie vypořádat se syntéza a chování anorganické a organokovový sloučeniny. Toto pole pokrývá chemické sloučeniny které nejsou na bázi uhlíku a jsou předmětem organická chemie. Rozdíl mezi těmito dvěma disciplínami zdaleka není absolutní, protože v subdisciplíně je mnoho překrývání organokovová chemie. Má aplikace ve všech aspektech chemického průmyslu, včetně katalýza, věda o materiálech, pigmenty, povrchově aktivní látky, nátěry, léky, paliva, a zemědělství.[1]
Klíčové koncepty

Mnoho anorganické sloučeniny jsou iontové sloučeniny, skládající se z kationty a anionty připojil se iontová vazba. Příklady solí (což jsou iontové sloučeniny) jsou chlorid hořečnatý MgCl2, který se skládá z hořčík kationty Mg2+ a chlorid anionty Cl−; nebo oxid sodný Na2O, který se skládá z sodík kationty Na+ a kysličník anionty O2−. V jakékoli soli jsou podíly iontů takové, že se elektrické náboje ruší, takže sypká směs je elektricky neutrální. Ionty jsou popsány jejich oxidační stav a jejich snadnou tvorbu lze odvodit z ionizační potenciál (pro kationty) nebo z elektronová afinita (anionty) nadřazených prvků.
Důležité třídy anorganických sloučenin jsou oxidy, uhličitany, sulfáty a halogenidy. Mnoho anorganických sloučenin se vyznačuje vysokou body tání. Anorganické soli jsou obvykle chudé vodiče v pevném stavu. Mezi další důležité vlastnosti patří jejich vysoká teplota tání a snadnost krystalizace. Kde jsou některé soli (např. NaCl ) jsou velmi rozpustné ve vodě, jiné (např. FeS ) nejsou.
Nejjednodušší anorganická reakce je dvojité posunutí při smíchání dvou solí jsou ionty vyměněny bez změny v oxidačním stavu. v redoxní reakce jeden reaktant, oxidant, snižuje svůj oxidační stav a další reaktant, redukční činidlo, má zvýšený oxidační stav. Čistým výsledkem je výměna elektrony. Výměna elektronů může nastat také nepřímo, např. V baterie, klíčový koncept v elektrochemie.
Když jeden reaktant obsahuje atomy vodíku, může reakce probíhat záměnou protonů acidobazická chemie. V obecnější definici se jakékoli chemické druhy schopné vázat na elektronové páry nazývají a Lewisova kyselina; naopak jakákoli molekula, která má tendenci darovat elektronový pár, se označuje jako a Lewisova základna. Jako vylepšení acidobazických interakcí se Teorie HSAB bere v úvahu polarizovatelnost a velikost iontů.
Anorganické sloučeniny se v přírodě vyskytují jako minerály. Půda může obsahovat sulfid železitý jako pyrit nebo síran vápenatý jako sádra. Anorganické sloučeniny se také považují za multitasking jako biomolekuly: jako elektrolyty (chlorid sodný ), při skladování energie (ATP ) nebo ve výstavbě ( polyfosfát páteř dovnitř DNA ).
První důležitá umělá anorganická sloučenina byla dusičnan amonný pro hnojení půdy prostřednictvím Haberův proces. Anorganické sloučeniny jsou syntetizovány pro použití jako katalyzátory jako oxid vanaditý (V) a chlorid titaničitý, nebo jako činidla v organická chemie jako lithiumaluminiumhydrid.
Pododdělení anorganické chemie jsou organokovová chemie, shluková chemie a bioanorganická chemie. Tato pole jsou aktivními oblastmi výzkumu v anorganické chemii zaměřenými na nové katalyzátory, supravodiče, a terapie.
Průmyslová anorganická chemie
Anorganická chemie je vysoce praktická oblast vědy. Rozsah národního hospodářství lze tradičně hodnotit podle jejich produktivity kyseliny sírové. Výroba hnojiv je další praktickou aplikací průmyslové anorganické chemie.
Popisná anorganická chemie
Deskriptivní anorganická chemie se zaměřuje na klasifikaci sloučenin na základě jejich vlastností. Klasifikace se částečně zaměřuje na polohu nejtěžšího prvku (prvku s nejvyšší atomovou hmotností) v periodické tabulce ve sloučenině, částečně seskupením sloučenin podle jejich strukturních podobností.
Klasifikace anorganické chemie:
Koordinační sloučeniny
Klasické koordinační sloučeniny obsahují kovy vázané na "osamělé páry "elektronů nacházejících se na atomech hlavní skupiny ligandů, jako je H2O, NH3, Cl−, a CN−. V moderních koordinačních sloučeninách lze jako ligandy použít téměř všechny organické a anorganické sloučeniny. „Kovem“ je obvykle kov ze skupin 3-13, stejně jako trans-lanthanoidy a trans-aktinidy, ale z určité perspektivy lze všechny chemické sloučeniny popsat jako koordinační komplexy.
Stereochemie koordinačních komplexů může být docela bohatá, jak naznačuje Wernerovo oddělení dvou enantiomery z [Co ((OH)2Co (NH3)4)3]6+, časná ukázka, že chiralita není vlastní organickým sloučeninám. Tématem této specializace je supramolekulární koordinační chemie.[2]
- Příklady: [Co (EDTA )]−, [Co (NH3)6]3+, TiCl4 (THF )2.
Sloučeniny hlavní skupiny

Tyto druhy mají prvky z skupiny I, II, III, IV, V, VI, VII, 0 (kromě vodíku) periodické tabulky. Díky své často podobné reaktivitě byly prvky ve skupině 3 (Sc, Y, a Los Angeles ) a skupina 12 (Zn, CD, a Hg ) jsou také obecně zahrnuty a lanthanoidy a aktinidy jsou někdy také zahrnuty.[3]
Sloučeniny hlavní skupiny jsou známé od počátků chemie, např. Elementární síra a destilovatelná bílá fosfor. Experimenty s kyslíkem, Ó2 tím, že Lavoisier a Priestley nejen identifikoval důležitý křemelina plyn, ale otevřel cestu pro popis sloučenin a reakcí podle stechiometrický poměry. Objev praktické syntézy amoniak pomocí železných katalyzátorů do Carl Bosch a Fritz Haber na počátku 20. století hluboce zasažený lidstvo, což dokazuje význam anorganické chemické syntézy. Typickými sloučeninami hlavní skupiny jsou SiO2, SnCl4a N.2O. Mnoho sloučenin hlavní skupiny lze také klasifikovat jako „organokovové“, protože obsahují organické skupiny, např. B (CH3 )3). Sloučeniny hlavní skupiny se také vyskytují v přírodě, např. fosfát v DNA, a proto mohou být klasifikovány jako bioanorganické. Naopak, organické sloučeniny, kterým chybí (mnoho) vodíkových ligandů, lze klasifikovat jako „anorganické“, jako jsou fullereny, buckytubes a binární oxidy uhlíku.
- Příklady: tetranitrid tetrasulfur S4N4, diboran B2H6, silikony, buckminsterfullerene C60.
Sloučeniny přechodných kovů
Sloučeniny obsahující kovy ze skupin 4 až 11 se považují za sloučeniny přechodných kovů. Sloučeniny s kovem ze skupiny 3 nebo 12 jsou někdy také začleněny do této skupiny, ale také jsou často klasifikovány jako sloučeniny hlavní skupiny.
Sloučeniny přechodných kovů vykazují bohatou koordinační chemii, která se liší od čtyřboké pro titan (např. TiCl4) do čtvercového rovinného u některých komplexů niklu do osmistěnného u koordinačních komplexů kobaltu. Řadu přechodných kovů lze nalézt v biologicky důležitých sloučeninách, jako je železo v hemoglobinu.
- Příklady: pentakarbonyl železa, chlorid titaničitý, cisplatina
Organokovové sloučeniny

Organokovové sloučeniny se obvykle považují za skupiny obsahující M-C-H.[4] Kov (M) u těchto druhů může být buď prvkem hlavní skupiny, nebo přechodným kovem. Provozně je definice organokovové sloučeniny uvolněnější, aby zahrnovala také vysoce lipofilní komplexy jako např kovové karbonyly a dokonce i kov alkoxidy.
Organokovové sloučeniny jsou považovány hlavně za zvláštní kategorii, protože organické ligandy jsou často citlivé na hydrolýzu nebo oxidaci, což vyžaduje, aby organokovová chemie využívala více specializovaných přípravných metod, než bylo obvyklé v komplexech Wernerova typu. Syntetická metodologie, zejména schopnost manipulovat s komplexy v rozpouštědlech s nízkou koordinační silou, umožnila průzkum velmi slabě koordinujících ligandů, jako jsou uhlovodíky, H2a N.2. Protože ligandy jsou v určitém smyslu petrochemické látky, oblast organokovové chemie velmi těžila z jejich významu pro průmysl.
- Příklady: Cyklopentadienyliron dikarbonyl dimer (C5H5) Fe (CO)2CH3, Ferrocen Fe (C.5H5)2, Hexakarbonyl molybdenu Mo (CO)6, Diborane B2H6, Tetrakis (trifenylfosfin) palladium (0) Pd [P (C.6H5)3]4
Klastrové sloučeniny
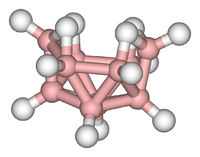

Klastry lze nalézt ve všech třídách chemické sloučeniny. Podle obecně přijímané definice se shluk skládá minimálně z trojúhelníkové sady atomů, které jsou navzájem přímo spojeny. Ale dimetalické komplexy vázané na kov a kov jsou pro tuto oblast vysoce relevantní. Klastry se vyskytují v „čistých“ anorganických systémech, organokovové chemii, chemii hlavních skupin a bioanorganické chemii. Rozdíl mezi velmi velkými shluky a sypkými látkami je stále nejasnější. Toto rozhraní je chemickým základem nanověd nebo nanotechnologie a konkrétně vyplývají ze studia efekty kvantové velikosti v selenid kademnatý shluky. Velké shluky lze tedy popsat jako pole vázaných atomů, jejichž charakter je mezi molekulou a pevnou látkou.
- Příklady: Fe3(CO)12, B10H14, [Mo6Cl14]2−, 4Fe-4S
Bioanorganické sloučeniny

Podle definice se tyto sloučeniny vyskytují v přírodě, ale podpole zahrnuje antropogenní druhy, jako jsou znečišťující látky (např. metylortuť ) a léky (např. Cisplatina ).[5] Pole, které zahrnuje mnoho aspektů biochemie, zahrnuje mnoho druhů sloučenin, např. Fosfáty v DNA, a také kovové komplexy obsahující ligandy, které se pohybují od biologických makromolekul, obvykle peptidy, na nedefinované druhy, jako je huminová kyselina a do voda (např. koordinováno do gadolinium komplexy používané pro MRI ). Tradičně se bioanorganická chemie zaměřuje na přenos elektronů a energie v proteinech souvisejících s dýcháním. Léčivá anorganická chemie zahrnuje studium jak nepodstatných, tak i nepodstatných základní prvky s aplikacemi pro diagnostiku a terapie.
- Příklady: hemoglobin, metylortuť, karboxypeptidáza
Sloučeniny v pevné fázi
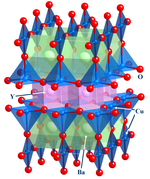
Tato důležitá oblast se zaměřuje na struktura,[6] lepení a fyzikální vlastnosti materiálů. V praxi používá anorganická chemie v pevném stavu techniky, jako je krystalografie získat porozumění vlastnostem, které jsou výsledkem kolektivních interakcí mezi podjednotkami tělesa. V chemii pevných látek jsou zahrnuty kovy a jejich slitiny nebo intermetalické deriváty. Související pole jsou fyzika kondenzovaných látek, mineralogie, a věda o materiálech.
- Příklady: křemíkové čipy, zeolity, YBa2Cu3Ó7
Teoretická anorganická chemie
Alternativní pohled na oblast anorganické chemie začíná u Bohrův model atomu a pomocí nástrojů a modelů z teoretická chemie a výpočetní chemie, expanduje do vazby v jednoduchých a pak složitějších molekulách. Přesné kvantově mechanické popisy multielektronových druhů, provincie anorganické chemie, jsou obtížné. Tato výzva přinesla mnoho semikvantitativních nebo semiempirických přístupů včetně molekulární orbitální teorie a teorie pole ligandů „Souběžně s těmito teoretickými popisy se používají přibližné metodiky, včetně hustota funkční teorie.
Při rozvoji oboru jsou mimořádně důležité kvalitativní a kvantitativní výjimky z teorií. Například, CuII2(OAc)4(H2Ó)2 je téměř diamagnetický pod teplotou místnosti, zatímco teorie krystalového pole předpovídá, že molekula bude mít dva nepárové elektrony. Neshoda mezi kvalitativní teorií (paramagnetická) a pozorováním (diamagnetická) vedla k vývoji modelů pro „magnetickou vazbu“. Tyto vylepšené modely vedly k vývoji nových magnetických materiálů a nových technologií.
Kvalitativní teorie

Anorganická chemie velmi těží z kvalitativních teorií. Takové teorie se dají snáze naučit, protože v kvantové teorii vyžadují malé zázemí. V rámci sloučenin hlavní skupiny VSEPR teorie mocně předpovídá nebo alespoň racionalizuje struktur sloučenin hlavní skupiny, například vysvětlení, proč NH3 je pyramidální, zatímco ClF3 je ve tvaru písmene T. U přechodných kovů teorie krystalového pole umožňuje pochopit magnetismus mnoha jednoduchých komplexů, například proč [FeIII(CN)6]3− má pouze jeden nepárový elektron, zatímco [FeIII(H2Ó)6]3+ má pět. Obzvláště silný kvalitativní přístup k hodnocení struktury a reaktivity začíná klasifikací molekul podle počítání elektronů, se zaměřením na počet valenční elektrony, obvykle na centrálním atomu v molekule.
Teorie grupy molekulární symetrie
Ústředním konstruktem v anorganické chemii je teorie molekulární symetrie.[7] Matematický teorie skupin poskytuje jazyk k popisu tvarů molekul podle jejich symetrie skupiny bodů. Skupinová teorie také umožňuje factoring a zjednodušení teoretických výpočtů.
Spektroskopické prvky jsou analyzovány a popsány s ohledem na vlastnosti symetrie, mimo jiné, vibrační nebo elektronické stavy. Znalost symetrických vlastností země a excitovaných stavů umožňuje předvídat počty a intenzity absorpcí ve vibračních a elektronických spektrech. Klasickou aplikací teorie skupin je předpověď počtu vibrací CO v substituovaných karbonylových komplexech kovů. Nejběžnější aplikace symetrie ke spektroskopii zahrnují vibrační a elektronová spektra.
Teorie skupiny zdůrazňuje společné rysy a rozdíly ve vazbě jinak odlišných druhů. Například orbitaly na bázi kovů se transformují stejně WF6 a W (CO)6, ale energie a populace těchto orbitalů se významně liší. Podobný vztah existuje CO2 a molekulární difluorid berylnatý.
Termodynamika a anorganická chemie
Alternativní kvantitativní přístup k anorganické chemii se zaměřuje na energie reakcí. Tento přístup je vysoce tradiční a empirický, ale je to také užitečné. Zahrnují široké pojmy, které jsou formulovány termodynamicky redoxní potenciál, kyselost, fáze Změny. Klasickým konceptem v anorganické termodynamice je Born-Haberův cyklus, který se používá pro hodnocení energií elementárních procesů, jako jsou elektronová afinita, z nichž některé nelze přímo pozorovat.
Mechanická anorganická chemie
Důležitý aspekt anorganické chemie se zaměřuje na reakční dráhy, tj. reakční mechanismy.
Prvky hlavní skupiny a lanthanoidy
Mechanismy sloučenin hlavní skupiny skupin 13-18 jsou obvykle diskutovány v kontextu organické chemie (organické sloučeniny jsou koneckonců sloučeniny hlavní skupiny). Prvky těžší než C, N, O a F často tvoří sloučeniny s více elektrony, než předpovídal oktetové pravidlo, jak je vysvětleno v článku o hypervalentní molekuly. Mechanismy jejich reakcí se z tohoto důvodu liší od organických sloučenin. Prvky lehčí než uhlík (B, Být, Li ) stejně jako Al a Mg často tvoří elektronově deficitní struktury, které jsou elektronicky podobné karbokationty. Takové druhy s nedostatkem elektronů mají tendenci reagovat asociativními cestami. Chemie lanthanoidů odráží mnoho aspektů chemie pozorovaných pro hliník.
Komplexy přechodných kovů
Přechodný kov a sloučeniny hlavní skupiny často reagují odlišně.[8] Důležitá role d-orbitalů ve vazbě silně ovlivňuje dráhy a rychlosti substituce a disociace ligandu. Těmto tématům se věnují články na téma koordinační chemie a ligand. Jsou pozorovány asociativní i disociativní dráhy.
Zastřešujícím aspektem mechanistické chemie přechodových kovů je kinetická labilita komplexu ilustrovaná výměnou volné a vázané vody v prototypových komplexech [M (H2Ó)6]n +:
- [M (H2Ó)6]n + + 6 hodin2O * → [M (H2Ó*)6]n + + 6 hodin2Ó
- kde H2O * označuje izotopově obohacená voda, např. H217Ó
Rychlost výměny vody se v periodické tabulce liší o 20 řádů, přičemž lanthanidové komplexy jsou v jednom extrému a Ir (III) druhy jsou nejpomalejší.
Redoxní reakce
Redoxní reakce převládají u přechodových prvků. Uvažují se dvě třídy redoxní reakce: reakce přenosu atomů, jako je oxidační adice / redukční eliminace, a elektronový přenos. Zásadní redoxní reakcí je „sebe-výměna“, která zahrnuje degenerovat reakce mezi oxidačním činidlem a redukčním činidlem. Například, manganistan a jeho relativní redukovaný jeden elektron manganičitan vyměňte jeden elektron:
- [MnO4]− + [Mn * O4]2− → [MnO4]2− + [Mn * O4]−
Reakce na ligandech
Koordinované ligandy vykazují reaktivitu odlišnou od volných ligandů. Například kyselost amoniakálních ligandů [Co (NH3)6]3+ je zvýšený vzhledem k NH3 sám. Alkeny vázané na kovové kationty jsou reaktivní vůči nukleofilům, zatímco alkeny normálně nejsou. Velká a průmyslově důležitá oblast katalýza závisí na schopnosti kovů modifikovat reaktivitu organických ligandů. Homogenní katalýza se vyskytuje v roztoku a heterogenní katalýza nastane, když plynný nebo rozpuštěn substráty interagují s povrchy pevných látek. Tradičně homogenní katalýza je považován za součást organokovové chemie a heterogenní katalýza je diskutována v kontextu věda o povrchu, podpole chemie pevných látek. Ale základní anorganické chemické principy jsou stejné. Přechodné kovy téměř jedinečně reagují s malými molekulami, jako jsou CO, H2, O2a C.2H4. Průmyslový význam těchto surovin řídí aktivní oblast katalýzy. Ligandy mohou také podléhat reakcím přenosu ligandů, jako jsou transmetalace.
Charakterizace anorganických sloučenin
Vzhledem k rozmanité škále prvků a odpovídajícím různorodým vlastnostem výsledných derivátů je anorganická chemie úzce spojena s mnoha analytickými metodami. Starší metody měly tendenci zkoumat objemové vlastnosti, jako je elektrická vodivost roztoků, body tání, rozpustnost, a kyselost. S příchodem kvantová teorie a odpovídající expanzi elektronických přístrojů byly zavedeny nové nástroje pro zkoumání elektronických vlastností anorganických molekul a pevných látek. Tato měření často poskytují poznatky relevantní pro teoretické modely. Například měření na fotoelektronové spektrum z metan prokázali, že popis vazby pomocí dvou středových dvouelektronových vazeb předpovězených mezi použitím uhlíku a vodíku Teorie Valence Bond není vhodné pro jednoduchý popis ionizačních procesů. Tyto poznatky vedly k popularizaci molekulární orbitální teorie protože plně delokalizované orbitaly jsou vhodnějším jednoduchým popisem odstraňování a excitace elektronů.
Běžně se vyskytující techniky jsou:
- Rentgenová krystalografie: Tato technika umožňuje 3D stanovení molekulární struktury.
- Duální polarizační interferometr: Tato technika měří konformace a konformační změna molekul.
- Různé formy spektroskopie
- Ultrafialově viditelná spektroskopie: Historicky to byl důležitý nástroj, protože mnoho anorganických sloučenin je silně zbarveno
- NMR spektroskopie: Kromě 1H a 13C mnoho dalších „dobrých“ NMR jader (např. 11B, 19F, 31P, a 195Pt ) poskytují důležité informace o vlastnostech a struktuře sloučeniny. Také NMR paramagnetických druhů může vést k důležité strukturní informaci. Protonová NMR je také důležitá, protože jádro lehkého vodíku není snadno detekováno rentgenovou krystalografií.
- Infračervená spektroskopie: Většinou pro absorpce z karbonylové ligandy
- Elektronová jaderná dvojitá rezonance (ENDOR) spektroskopie
- Mössbauerova spektroskopie
- Elektronová spinová rezonance: ESR (nebo EPR) umožňuje měření prostředí prostředí paramagnetické kovová centra.
- Elektrochemie: Cyklická voltametrie a související techniky zkoumají redoxní charakteristiky sloučenin.
Syntetická anorganická chemie
Ačkoli některé anorganické druhy lze získat v čisté formě z přírody, většina se syntetizuje v chemických závodech a v laboratoři.
Anorganické syntetické metody lze klasifikovat zhruba podle těkavosti nebo rozpustnosti reaktantů složek.[9] Rozpustné anorganické sloučeniny se připravují za použití metod podle organická syntéza. U sloučenin obsahujících kovy, které jsou reaktivní vůči vzduchu, Schlenkova linka a odkládací schránka techniky jsou dodržovány. S těkavými sloučeninami a plyny se manipuluje ve „vakuových rozdělovačích“ skládajících se ze skleněného potrubí propojeného ventily, které lze evakuovat na 0,001 mm Hg nebo méně. Sloučeniny se kondenzují za použití tekutý dusík (b.p. 78K) nebo jiné kryogeny. Pevné látky se obvykle připravují pomocí trubkových pecí, reaktanty a produkty se uzavírají v nádobách, často vyrobených z taveného oxidu křemičitého (amorfní SiO2), ale někdy i více specializované materiály, jako jsou svařované Ta trubky nebo Pt „čluny“. Produkty a reaktanty jsou transportovány mezi teplotními zónami za účelem podpory reakcí.
Viz také
Reference
- ^ „Kariéra v chemii: anorganická chemie“. Americká chemická společnost. Archivovány od originál dne 29. 10. 2012.
- ^ Lehn, J. M. (1995). Supramolekulární chemie: koncepty a perspektivy. Weinheim: VCH. ISBN 978-3-527-29311-7.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Elschenbroich, C .; Salzer, A. (1992). Organometallics: Stručný úvod (2. vyd.). Weinheim: Wiley-VCH. ISBN 978-3-527-28164-0.
- ^ S.J. Lippard; J.M. Berg (1994). Principy bioanorganické chemie. Mill Valley, CA: University Science Books. ISBN 978-0-935702-73-6.
- ^ Wells, A.F. (1984). Strukturní anorganická chemie. Oxford: Clarendon Press.
- ^ Cotton, F.A. (1990). Chemické aplikace teorie skupin (3. vyd.). New York: John Wiley & Sons. ISBN 978-0-471-51094-9.
- ^ R.G. Wilkins (1991). Kinetika a mechanismus reakcí komplexů přechodových kovů (2. vyd.). Wiley-VCH. ISBN 978-3-527-28389-7.
- ^ Girolami, G.S .; Rauchfuss, T.B .; Angelici, R.J. (1999). Syntéza a technika v anorganické chemii (3. vyd.). Mill Valley, CA: University Science Books. ISBN 978-0-935702-48-4.

