Chlorid vizmutitý - Bismuth chloride
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Chlorid vizmutitý | |
| Ostatní jména Chlorid vizmutitý, trichlorbismut, trichlorbismuthin, chlorid vizmutitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.203 |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| BiCl3 | |
| Molární hmotnost | 315,34 g / mol |
| Vzhled | hygroskopický bílé až žluté krystaly |
| Hustota | 4,75 g / cm3 |
| Bod tání | 227 ° C (441 ° F; 500 K) |
| Bod varu | 447 ° C (837 ° F; 720 K) |
| Rozpustný, hydrolyzuje | |
| Rozpustnost | rozpustný v methanolu, diethylether, aceton |
| -26.5·10−6 cm3/ mol | |
| Termochemie | |
Tepelná kapacita (C) | 0,333 J / (g K) |
Std entalpie of formace (ΔFH⦵298) | -1,202 kJ / g |
| Nebezpečí | |
| Bezpečnostní list | JT Baker |
| NFPA 704 (ohnivý diamant) | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 3324 mg / kg, orálně (potkan) |
| Související sloučeniny | |
jiný anionty | fluorid bismutitý, subsalicylát bismutu, oxid bismutitý |
jiný kationty | chlorid železitý, chlorid manganatý, chlorid kobaltnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Chlorid vizmutitý (nebo máslo vizmutu) je anorganická sloučenina s chemickým vzorcem BiCl3. Je to kovalentní sloučenina a je běžným zdrojem Bi3+ ion. V plynné fázi a v krystalu druh přijímá pyramidovou strukturu, v souladu s Teorie VSEPR.
Příprava
Chlorid vizmutu lze syntetizovat přímo průchodem chlór přes vizmut.
- 2 Bi + 3 Cl2 → 2 BiCl3
nebo rozpuštěním kovu vizmutu v Lučavka královská, odpařením směsi se získá BiCl3· 2H2O, který může být destilován za vzniku bezvodého trichloridu.[1]
Alternativně může být připraven přidáním kyselina chlorovodíková na oxid vizmutitý a odpaření roztoku.
- Bi2Ó3 + 6 HCl → 2 BiCl3 + 3 H2Ó
Sloučeninu lze také připravit rozpuštěním vizmutu v koncentrované formě kyselina dusičná a poté přidáním pevné látky chlorid sodný do tohoto řešení.[2]
- Bi + 6 HNO3 → Bi (č3)3 + 3 H2O + 3 NE2
- Bi (č3)3 + 3 NaCl → BiCl3 + 3 NaNO3
Struktura
V plynné fázi BiCl3 je pyramidální s úhlem Cl-Bi-Cl 97,5 ° a délkou vazby 242 pm.[3] V pevném stavu má každý atom Bi tři blízké sousedy ve 250 hodin, dva ve 324 hodin a tři průměrně 336 hodin,[4] obrázek nahoře zdůrazňuje tři nejbližší sousedy. Tato struktura je podobná struktuře AsCl3, AsBr3, SbCl3 a SbBr3.
Chemie
Chlorid bismutitý je hydrolyzovaný snadno oxychlorid bismutitý, BiOCl:[5]
- Bi3+
(aq) + Cl−
(aq) + H
2Ó(l) ⇌ BiOCl (s) + 2 H+
(aq)
Tuto reakci lze zvrátit přidáním kyseliny, jako je kyselina chlorovodíková.[6]
Reakce pevného BiCl3 Bylo prokázáno, že s vodní párou pod 50 ° C vzniká meziprodukt monohydrát, BiCl3.H2Ó.[7]
Chlorid vizmutu je oxidační činidlo, které se snadno redukuje na kovový vizmut redukčními činidly.
Chloro komplexy
Na rozdíl od obvyklého očekávání v souladu s periodickými trendy, BiCl3 je Lewisova kyselina, tvořící řadu chlorových komplexů, jako je [BiCl6]3− který silně porušuje oktetové pravidlo. Kromě toho oktaedrická struktura tohoto koordinační komplex nenásleduje předpovědi teorie VSEPR, protože osamělý pár na vizmutu je nečekaně stereochemicky neaktivní. Dianiontový komplex [BiCl5]2− přijímá však očekávanou čtvercovou pyramidovou strukturu.[8]
 |  | 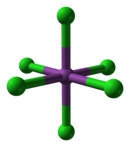 |
Organická katalýza
Chlorid bismutitý se používá jako a katalyzátor v organická syntéza. Zejména katalyzuje Michaelova reakce a Mukaiyama aldolová reakce. Přidání dalšího kovu jodidy zvyšuje jeho katalytickou aktivitu.[9]
Bezpečnost
Chlorid bismutitý je toxický. Způsobuje podráždění gastrointestinálního a dýchacího traktu. Kontakt s pokožkou může způsobit popáleniny.
Reference
- ^ Godfrey, S. M .; McAuliffe, C. A .; Mackie, A. G .; Pritchard, R. G. (1998). Nicholas C. Norman (ed.). Chemie arsenu, antimonu a vizmutu. Springer. p. 90. ISBN 0-7514-0389-X.
- ^ Pradyot Patnaik. Handbook of Anorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Töke, Orsolya a Magdolna Hargittai. „Molekulární struktura chloridu bismutitého z kombinované elektronové difrakce a vibrační spektroskopické studie.“ Strukturální chemie 6.2 (1995): 127-130.
- ^ Wells A.F. (1984) Strukturní anorganická chemie 5. vydání, str. 879 - 884, Oxford Science Publications, ISBN 0-19-855370-6
- ^ Joel Henry Hildebrand (2008). Principy chemie. BiblioBazaar, LLC. p. 191. ISBN 978-0-559-31877-1.
- ^ Frank Welcher (2008). Chemická řešení. ČÍST KNIHY. p. 48. ISBN 978-1-4437-2907-9.
- ^ Wosylus, Aron; Hoffmann, Stefan; Schmidt, Marcus; Ruck, Michael (2010). "Studie in situ reakce tuhého plynu BiCl3 na BiOCl prostřednictvím meziproduktového hydrátu BiCl3 · H20". European Journal of Anorganic Chemistry. 2010 (10): 1469–1471. doi:10.1002 / ejic.201000032. ISSN 1434-1948.
- ^ Holleman, A. F .; Wiberg, E. "Anorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Hitomi Suzuki; Yoshihiro Matano (2001). Organobismutová chemie. Elsevier. str.403 –404. ISBN 0-444-20528-4.

