Sulfurylchlorid - Sulfuryl chloride
 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Sulfurylchlorid | |
| Ostatní jména Sulfonylchlorid Chlorid sírový Oxid siřičitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.029.314 |
| Číslo ES |
|
| 2256 | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 1834 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| TAK2Cl2 | |
| Molární hmotnost | 134,9698 g mol−1 |
| Vzhled | Bezbarvá kapalina s pronikavým zápachem. Žluté při stání. |
| Hustota | 1,67 g cm−3 (20 ° C) |
| Bod tání | -54,1 ° C (-65,4 ° F; 219,1 K) |
| Bod varu | 69,4 ° C (156,9 ° F; 342,5 K) |
| hydrolyzuje | |
| Rozpustnost | mísitelný s benzen, toluen, chloroform, CCl4, ledová octová kyselina |
Index lomu (nD) | 1,4437 (20 ° C)[1] |
| Nebezpečí | |
| Piktogramy GHS |   |
| Signální slovo GHS | Nebezpečí |
| H314, H335 | |
| P260, P261, P264, P271, P280, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P312, P321, P363, P403 + 233, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavý |
| Související sloučeniny | |
Související sulfurylhalogenidy | Sulfurylfluorid |
Související sloučeniny | Thionylchlorid Kyselina chlorsulfonová Kyselina sírová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Sulfurylchlorid je anorganická sloučenina vzorce SO2Cl2. Na pokojová teplota, je to bezbarvá kapalina s pronikavým zápachem. Sulfurylchlorid se v přírodě nenachází, jak lze odvodit z jeho rychlosti hydrolýza.
Sulfurylchlorid je obvykle zaměňován s thionylchlorid, SOCl2. Vlastnosti těchto dvou oxychloridů síry jsou zcela odlišné: sulfurylchlorid je zdrojem chlór zatímco thionylchlorid je zdrojem chlorid ionty. Alternativní název IUPAC je sulfuroyl dichlorid.
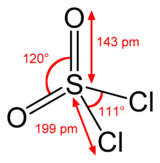
Struktura
Síra je v SO čtyřboká2Cl2 a oxidační stav atomu síry je +6, jako v kyselina sírová.
Syntéza
TAK2Cl2 se připravuje reakcí oxid siřičitý a chlór v přítomnosti a katalyzátor, jako aktivní uhlí.[2]
- TAK2 + Cl2 → SO2Cl2
Produkt lze čistit pomocí frakční destilace.
Starší trasy
Sulfurylchlorid byl poprvé připraven v roce 1838 francouzským chemikem Henri Victor Regnault.[3]
Starší cesty zahrnují oxidaci thionylchloridu:
- SOCl2 + HgO → ClSSCl + HgCl2 + SO2Cl2
- 2 SOCl2 + MnO2 → SO2 + MnCl2 + SO2Cl2
Reakce
Sulfurylchlorid reaguje s voda uvolňující chlorovodík plyn a kyselina sírová:
- 2 H2O + SO2Cl2 → 2 HCl + H2TAK4
TAK2Cl2 bude také rozložit při zahřátí na nebo nad 100 ° C asi 30 ° C nad jeho teplotou varu.
Když vstal, SO2Cl2 rozkládá se na oxid siřičitý a chlór, což dává starším vzorkům mírně nažloutlou barvu.[2]
Použití
Sulfurylchlorid se používá jako zdroj Cl2. Protože se jedná o tekutou tekutinu, je považována za pohodlnější než Cl2 vydat. Používá se jako činidlo při přeměně C-H na C-Cl sousedící s aktivačními substituenty, jako jsou karbonyly a sulfoxidy. Rovněž chloruje alkany, alkeny, alkyny, aromatické látky, ethery (např tetrahydrofuran ) a epoxidy. Takové reakce probíhají pod volné radikály podmínky pomocí iniciátoru, jako je AIBN. Lze jej také použít k převodu thioly nebo disulfidy do jejich odpovídajících sulfenylchloridy, ačkoli sulfinylchloridy výsledkem jsou v některých případech thioly.[4] TAK2Cl2 lze také převést alkoholy na alkylchloridy. V průmyslu se sulfurylchlorid nejvíce používá při výrobě pesticidů.
Sulfurylchlorid lze také použít k ošetření vlny, aby se zabránilo smršťování.
Opatření
Sulfurylchlorid je toxický, korozivní a působí jako slzotvorce. Uvolňuje chlorovodík při kontaktu s vodou, stejně jako donorová rozpouštědla, jako je dimethylsulfoxid a dimethylformamid.
Reference
- ^ Patnaik, P. (2002). Handbook of Anorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.[stránka potřebná ]
- ^ A b F. Fehér (1963). „Sulfurylchlorid“. V G. Brauer (ed.). Handbook of Preparative Anorganic Chemistry, 2. vyd. 1. NY, NY: Academic Press. 382–384.
- ^ Regnault, Victor (1838). „Sur l'acide chlorosulfurique et la sulfamide“ [Na sulfurylchloridu a sulfamidu]. Annales de Chimie et de Physique. Série 2 (ve francouzštině). 69: 170–184.
- Přetištěno jako: Regnault, Victor (1839). „Ueber die Chlorschwefelsäure und das Sulfamid“ [Na sulfurylchloridu a sulfamidu]. Journal für Praktische Chemie (v němčině). 18: 93–104. doi:10.1002 / prac.18390180104.
- ^ Page, P. C. B .; Wilkes, R. D .; Reynolds, D. (1995). „Alkylchalkogenidy: funkční skupiny na bázi síry“. v Ley, Steven V. (vyd.). Syntéza: Uhlík s jedním heteroatomem připojeným jednoduchou vazbou. Komplexní transformace organických funkčních skupin. Elsevier. str.113–276. ISBN 9780080423234.
- „Sulfurylchlorid Číslo CAS: 7791-25-5“ (PDF). OECD SIDS. Publikace UNEP. 2004. Archivovány od originál (PDF) dne 2007-02-28.
- Maynard, G. D. (2001). „Sulfurylchlorid“. Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyklopedie činidel pro organickou syntézu. John Wiley & Sons. doi:10.1002 / 047084289X.rs140. ISBN 978-0471936237.
Další čtení
- Lautens, M .; Bouchain, G. (2002). „[4 + 3] Cykloadice ve vodě. Syntéza 2,4-endo,endo-Dimethyl-8-oxabicyklo [3.2.1] okt-6-en-3-on ". Organické syntézy. 79: 251. doi:10.15227 / orgsyn.079.0251.
- McKee, R. H .; Salls, C. M. (1924). „Sulfurylchlorid“. Průmyslová a inženýrská chemie. 16 (4): 351–353. doi:10.1021 / ie50172a008.
- Moussa, V. N. (2012). „Sulfurylchlorid: univerzální alternativa k chloru“. Australian Journal of Chemistry. 65 (1): 95–96. doi:10.1071 / CH11367.
- North, H. B. (1910). „Působení thionyl a sulfurylchloridů na rtuť a oxid rtuťnatý“. Journal of the American Chemical Society. 32 (2): 184–187. doi:10.1021 / ja01920a004.
- North, H. B .; Hageman, A. G. (1913). "Některé nové reakce s thionylchloridem". Journal of the American Chemical Society. 35 (5): 543–546. doi:10.1021 / ja02194a004.

