Chlorid seleničitý - Selenium tetrachloride
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Chlorid seleničitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.030.036 |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| SeCl4 | |
| Molární hmotnost | 220,771 g / mol |
| Vzhled | bílé až žluté krystaly |
| Hustota | 2,6 g / cm3, pevný |
| Bod tání | vznešené při 191,4 ° C[1] |
| rozkládá se ve vodě | |
| Struktura | |
| Monoklinický, mS80 | |
| C12 / c1, č. 15 | |
| Houpačka (plynná fáze)[Citace je zapotřebí ] | |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | |
| R-věty (zastaralý) | R23 / 25, R33, R50 / 53 |
| S-věty (zastaralý) | S20 / 21, S28, S45, S60, S61[2] |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | nehořlavé |
| Související sloučeniny | |
jiný anionty | Tetrafluorid seleničitý Tetrabromid seleničitý Oxid seleničitý |
jiný kationty | Oxid dichlornatý Chlorid sírový Chlorid teluritý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Chlorid seleničitý je anorganická sloučenina složený s vzorec SeCl4. Tato sloučenina existuje ve formě žluté až bílé těkavé pevné látky. Je to jeden ze dvou běžně dostupných chloridy selenu, dalším příkladem je chlorid seleničitý, Se2Cl2. SeCl4 se používá při syntéze jiných selen sloučeniny.
Syntéza a struktura
Sloučenina se připraví zpracováním selen s chlór.[3] Když se reakční selen zahřeje, produkt vznešené z reakční baňky. Těkavost chloridu seleničitého lze využít k čištění selenu.
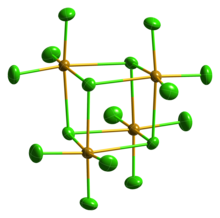
Pevný SeCl4 je ve skutečnosti tetramerní shluk kubánského typu, pro které je Se atom SeCl6 osmistěn sedí na čtyřech rozích krychle a přemosťující atomy Cl sedí na dalších čtyřech rozích. Překlenovací vzdálenosti Se-Cl jsou delší než vzdálenosti terminálu Se-Cl, ale všechny úhly Cl-Se-Cl jsou přibližně 90 °.[4]
SeCl4 se často používá jako příklad pro výuku VSEPR pravidla hypervalentní molekuly. Jako takový by člověk předpovídal čtyři vazby, ale pět elektronových skupin, které by vedly k a geometrie houpačky. To zjevně neplatí v případě Krystalická struktura. Jiní navrhli, že krystalovou strukturu lze reprezentovat jako SeCl3+ a Cl−. Tato formulace předpovídá a pyramidová geometrie pro SeCl3+ kation s úhlem vazby Cl-Se-Cl přibližně 109 °. Tato molekula je však vynikajícím příkladem situace, kdy maximální vazby nelze dosáhnout pomocí nejjednoduššího molekulárního vzorce. Tvorba tetrameru (SeCl4)4,[5] s delokalizovanou sigma vazbou přemosťujícího chloridu je jasně upřednostňována před „hypervalentní“ malou molekulou. plynný SeCl4 obsahuje SeCl2 a chlor, který se po kondenzaci rekombinuje.
Reakce
Chlorid seleničitý lze in situ redukovat na dichlorid trifenylstibin:
- SeCl4 + SbPh3 → SeCl2 + Cl2SbPh3
Chlorid seleničitý reaguje s vodou za vzniku osamělý a chlorovodíková kyseliny:[6][stránka potřebná ]
- SeCl4 + 3 H2O → H2Seo3 + 4 HCl
Po léčbě oxid seleničitý, to dává oxychlorid seleničitý:[6][stránka potřebná ]
- SeCl4 + SeO2 → 2SeOCl2
Reference
- ^ Lide, David R. (1998). Příručka chemie a fyziky (87 ed.). Boca Raton, Florida: CRC Press. p. 487. ISBN 0-8493-0594-2. Citováno 2008-07-02.
- ^ "323527 chlorid seleničitý". Sigma-Aldrich. Citováno 2008-07-02.
- ^ Nowak, H. G .; Suttle, J. F .; Parker, W. E .; Kleinberg, J. (1957). "Chlorid seleničitý". Anorganické syntézy. Anorganické syntézy. 5. p. 125. doi:10.1002 / 9780470132364.ch33. ISBN 9780470132364.
- ^ Kristallstruktur der stabilen Modifikation von SeCl4, Zeitschrift fur Naturforschung, 36b, 1660, 1981
- ^ Wells, Strukturní anorganická chemie, páté vydání, Oxford, s. 709, ISBN 0-19-855370-6
- ^ A b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.

