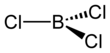
Chlorid boritý - Boron trichloride
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Chlorid boritý | |||
| Ostatní jména Chlorid boritý Trichlorboran | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.030.586 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| BCl3 | |||
| Molární hmotnost | 117,17 g / mol | ||
| Vzhled | Bezbarvý plyn, výpary ve vzduchu | ||
| Hustota | 1,326 g / cm3 | ||
| Bod tání | -107,3 ° C (-161,1 ° F; 165,8 K) | ||
| Bod varu | 12,6 ° C (54,7 ° F; 285,8 K)[1] | ||
| hydrolýza | |||
| Rozpustnost | rozpustný v CCl4, ethanol | ||
| -59.9·10−6 cm3/ mol | |||
Index lomu (nD) | 1.00139 | ||
| Struktura | |||
| Trigonální rovinná (D3h) | |||
| nula | |||
| Termochemie | |||
Tepelná kapacita (C) | 107 J / mol K. | ||
Std molární entropie (S | 206 J / mol K. | ||
Std entalpie of formace (ΔFH⦵298) | -427 kJ / mol | ||
Gibbsova volná energie (ΔFG˚) | -387,2 kJ / mol | ||
| Nebezpečí[2] | |||
| Hlavní nebezpečí | Při požití nebo vdechnutí může být smrtelné Způsobuje vážné popáleniny očí, kůže, úst, plic atd. Kontakt s vodou dává HCl | ||
| Bezpečnostní list | ICSC | ||
| Piktogramy GHS |    | ||
| Signální slovo GHS | Nebezpečí | ||
| H330, H300, H314[poznámka 1] | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | Nehořlavé | ||
| Související sloučeniny | |||
jiný anionty | Fluorid boritý Tribromid boritý Jodid boritý | ||
jiný kationty | Chlorid hlinitý Chlorid gallium | ||
Související sloučeniny | Oxid boritý Chlorid uhličitý | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Chlorid boritý je anorganická sloučenina se vzorcem BCl3. Tento bezbarvý plyn je reagentem organická syntéza. Je vysoce reaktivní vůči vodě.
Výroba a struktura
Bor reaguje s halogeny aby se získaly odpovídající trihalogenidy. Chlorid boritý se však průmyslově vyrábí přímým způsobem chlorování z oxid boritý a uhlík při 500 ° C.
- B2Ó3 + 3 C + 3 Cl2 → 2 př3 + 3 CO
The karbotermická reakce je analogický s Krollov proces pro přeměnu oxidu titaničitého na chlorid titaničitý. V laboratoři BF3 reagoval s AlCl3 dává BCl3 prostřednictvím výměny halogenů.[3] BCl3 je trigonální planární molekula jako ostatní halogenidy boru a má délku vazby 175 ppm.
Pro vysvětlení krátké vzdálenosti B-Cl byla navržena určitá míra π-vazby, i když o její míře existují určité debaty.[3] Nedimeruje, i když NMR studie směsí halogenidů boru ukazují na přítomnost směsných halogenidů. Absence dimerizace kontrastuje s tendencemi AlCl3 a GaCl3, které tvoří dimery nebo polymery se 4 nebo 6 souřadnicemi kovových center.
Reakce
BCl3 snadno hydrolyzuje za vzniku kyseliny chlorovodíkové a kyselina boritá:
- BCl3 + 3 H2O → B (OH)3 + 3 HCl
Alkoholy se chovají analogicky a dávají estery boritanu, např. trimethylborát.
Jako silný Lewisova kyselina, BCl3 formuláře adukty s terciárním aminy, fosfiny, ethery, thioethery, a halogenid ionty.[4] Tvorba aduktu je často doprovázena zvýšením délky vazby B-Cl. BCl3• S (CH3)2 (CAS # 5523-19-3) se často používá jako pohodlně zpracovávaný zdroj BCl3 protože tato pevná látka (t.t. 88-90 ° C) uvolňuje BCI3:
- (CH3)2S · BCl3 ⇌ (CH3)2S + BCl3
Smíšené aryl a alkyl chloridy boru jsou také známé. Fenylboron dichlorid je komerčně dostupný. Tyto druhy může připravit redistribuční reakce BCl3 s organocínovými činidly:
- 2 př3 + R.4Sn → 2 RBCl2 + R.2SnCl2
Snížení
Snížení BCl3 na elementární bór se provádí komerčně (viz níže). V laboratoři, kdy lze chlorid boritý převést na chlorid diboritý zahříváním kovovým mědí:[5]
- 2 př3 + 2 Cu → B2Cl4 + 2 CuCl
B4Cl4 lze také připravit tímto způsobem. Bezbarvý chlorid diboronitý (t.t. -93 ° C) je planární molekula v pevné látce (podobná oxid dusný, ale v plynné fázi je struktura rozložená.[3] Rozkládá se při pokojové teplotě za vzniku řady monochloridů obecného vzorce (BCl)n, ve kterém n může být 8, 9, 10 nebo 11. Sloučeniny vzorce B8Cl8 a B9Cl9 je známo, že obsahují uzavřené klece atomů boru.
Použití
Chlorid boritý je výchozí surovinou pro výrobu elementárního boru. Používá se také v rafinace z hliník, hořčík, zinek a měď slitiny k odstranění nitridy, karbidy, a oxidy z roztaveného kovu. Používá se jako pájecí tavidlo pro slitiny hliníku, žehlička, zinek, wolfram, a monel. Hliníkové odlitky lze zlepšit zpracováním taveniny parami chloridu boritého. Při výrobě elektrických rezistorů jednotné a trvalé lepidlo uhlíkový film lze dát přes a keramický základna pomocí BCl3. Používá se v oblasti vysokoenergetických paliv a raketových pohonných hmot jako zdroje boru ke zvýšení hodnoty BTU. BCl3 se také používá v plazmové leptání v polovodič výrobní. Tento plyn leptá oxidy kovů tvorbou těkavého BOClX sloučeniny.
BCl3 se používá jako činidlo při syntéze organických sloučenin. Stejně jako odpovídající bromid štěpí vazby CO ethery.[1][6]
Bezpečnost
BCl3 je agresivní činidlo, které se může tvořit chlorovodík při vystavení vlhkosti nebo alkoholy. The dimethylsulfid adukt (BCl3SMe2), což je pevná látka, je mnohem bezpečnější,[7] pokud je to možné, ale H2O zničí BCl3 část, přičemž se ponechá dimethylsulfid v roztoku.
Viz také
Reference
- ^ A b Yamamoto, Y .; Miyaura, N. (2004). „Chlorid boritý“. V Paquette, L. (ed.). Encyklopedie činidel pro organickou syntézu. Encyklopedie činidel pro organickou syntézu. New York: J. Wiley & Sons. doi:10.1002 / 047084289X.rb245.pub2. ISBN 0471936235.
- ^ Rejstřík č. 005-002-00-5 přílohy VI části 3 až Nařízení Evropského parlamentu a Rady (ES) č. 1272/2008 ze dne 16. prosince 2008 o klasifikaci, označování a balení látek a směsí, o změně a zrušení směrnic 67/548 / EHS a 1999/45 / ES a o změně nařízení (ES) č. 1907/2006. Úř. Věst L353, 31.12.2008, s. 1–1355, s. 341.
- ^ A b C Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Gerrard, W .; Lappert, M. F. (1958). "Reakce chloridu boritého s organickými sloučeninami". Chemické recenze. 58 (6): 1081–1111. doi:10.1021 / cr50024a003.
- ^ Wartik, T .; Rosenberg, R .; Fox, W. B. (1967). "Diboron Tetrachloride". Anorganické syntézy. 10. str. 118–125. doi:10.1002 / 9780470132418.ch18. ISBN 9780470132418.
- ^ Shun Okaya, Keiichiro Okuyama, Kentaro Okano, Hidetoshi Tokuyama (2016). „Deprotekce fenolového benzyletheru podporovaného trichlorboronem pomocí pentametylbenzenu jako lapače kationtů jiných než Lewis“. Org. Synth. 93: 63–74. doi:10.15227 / orgsyn.093.0063.CS1 maint: používá parametr autoři (odkaz)
- ^ Williard, Paul G .; Fryhle, Craig B. (1980). „Komplexy halogenidu boritého s methylsulfidem jako vhodná činidla pro dealkylaci aryletherů“. Čtyřstěn dopisy. 21 (39): 3731. doi:10.1016 / 0040-4039 (80) 80164-X.
Poznámky
- ^ V Evropské unii musí být na etiketě uvedeno také následující upozornění na nebezpečí (EUH014): Prudce reaguje s vodou.
Další čtení
- Martin, D. R. (1944). „Koordinační sloučeniny chloridu boritého. I. - Přehled“. Chemické recenze. 34 (3): 461–473. doi:10.1021 / cr60109a005.
- Kabalka, G. W .; Wu, Z. Z .; Ju, Y. H. (2003). „Využití chloridů a bromidů organoboritých v organické syntéze“. Journal of Organometallic Chemistry. 680 (1–2): 12–22. doi:10.1016 / S0022-328X (03) 00209-2.