Perrhenát amonný - Ammonium perrhenate
 | |
 | |
| Jména | |
|---|---|
| Ostatní jména Perrhenát amonný, Perhenát amonný (VII) | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.033.690 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| NH4ReO4 | |
| Molární hmotnost | 268,2359 g / mol |
| Hustota | 3,97 g / cm3, pevný |
| Bod tání | ° C |
| 2,8 g / 100 ml (0 ° C), 6,2 g / 100 ml (20 ° C), 12,0 g / 100 ml (40 ° C), 20,7 g / 100 ml (60 ° C), 32,3 g / 100 ml ( 80 ° C), 39,1 g / 100 ml (90 ° C) | |
| Struktura | |
| scheelit | |
| N / A | |
| Nebezpečí | |
| Bod vzplanutí | Nehořlavé |
| Související sloučeniny | |
jiný anionty | Manganistan amonný; technecistan amonný |
jiný kationty | Perrhenát sodný; kyselina perrhenová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Perrhenát amonný (APR) je amonný sůl kyselina perrhenová, NH4ReO4. Je to nejběžnější forma, ve které rhenium se obchoduje. Je to bílá ve vodě rozpustná sůl. Poprvé to bylo popsáno krátce po objevu rhenia.[1]
Struktura
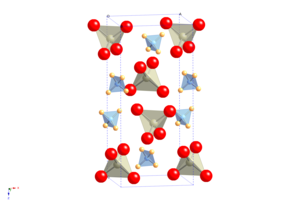
Krystalová struktura APR je ta scheelit, ve kterém je atomový kation nahrazen amonným molekulárním kationtem.[2] Podstupuje přechod molekulárně orientačního uspořádání při chlazení beze změny vesmírné skupiny, ale s vysoce anizotropní změnou tvaru jednotková buňka, což má za následek neobvyklou vlastnost kladné teploty a tlaku Re NQR součinitel.[3]
NH4ReO4 lze považovat za prototypovou strukturu rodiny amonných scheelitů, mezi něž patří i technecistan (NH4TcO4), jodistan (NH4IO4), tetrachlorothalát (NH4TlCl4) a tetrachlorindát (NH4InCl4).[2]
Příprava
Perrhenát amonný lze připravit prakticky ze všech běžných zdrojů rhenia. Kov, oxidy a sulfidy lze oxidovat kyselina dusičná a výsledný roztok se zpracuje vodným amoniakem. Alternativně vodný roztok Re2Ó7 může být zpracován amoniakem s následnou krystalizací.[4][5]
Reakce
Čistý rhenium prášek lze vyrobit z APR zahřátím za přítomnosti vodík:[4]
- 2 NH4ReO4 + 7 hodin2 → 2 Re + 8 H2O + 2 NH3
Zahřívání musí být prováděno pomalu, protože perrhenát amonný se rozkládá na těkavý Re2Ó7 začínající na 250 ° C. Při zahřívání v uzavřené zkumavce na 500 ° C se APR rozkládá na oxid rheničitý:[4]
- 2NH4ReO4 → 2ReO2 + N2 + 4 H2Ó
Reference
- ^ Noddack, J .; Noddack, W. (1929). „Die Sauerstoffverbindungen des Rheniums“. Zeitschrift für anorganische und allgemeine Chemie. 181 (6): 1–37. Bibcode:1929NW ..... 17 ... 93N. doi:10.1002 / zaac.19291810102.
- ^ A b I. P. Swainson a R. J. C. Brown (1997). "Zpřesnění struktury perrhenátu amonného pomocí modelu pseudo-spin pro orientaci amonných iontů". Acta Crystallographica. B53: 76–81. doi:10.1107 / S0108768196011160.
- ^ R. J. C. Brown a S. L. Segel (1977). "187Re, 14N a 2H jaderné kvadrupólové vazby v NH4ReO4: Důkaz možného fázového přechodu “. Journal of Chemical Physics. 67 (7): 3163–7. Bibcode:1977JChPh..67,3163B. doi:10.1063/1.435229.
- ^ A b C O. Glemser "Permonát amonný" v Příručka preparativní anorganické chemie, 2. vyd. Edited by G. Brauer, Academic Press, 1963, New York. sv. 1. str. 1476–85.
- ^ Richard J. Thompson (1966). „Perrhenát amonný“. Anorganické syntézy. 8: 171–173. doi:10.1002 / 9780470132395.ch44. ISBN 9780470132395.
- Wm. T. Smith, S. Harmon Long (1948). „Soli kyseliny perrhenové. I. Alkalické kovy a amonium“. Journal of the American Chemical Society. 70 (1): 354–356. doi:10.1021 / ja01181a110.
