Chlorid americký (III) - Americium(III) chloride
 | |
| Jména | |
|---|---|
| Název IUPAC Chlorid americký (III) | |
| Systematický název IUPAC Americium (3+) chlorid | |
| Ostatní jména Chlorid americium Chlorid americium | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| DopoledneCl3 | |
| Molární hmotnost | 349 g · mol−1 |
| Vzhled | Světle červené neprůhledné krystaly |
| Hustota | 5,87 g cm−3[1] |
| Bod tání | 715 ° C (1319 ° F; 988 K)[2] |
| Bod varu | 850 ° C (1560 ° F; 1120 K)[1] |
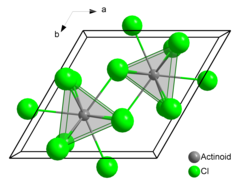
| Struktura | |
| šestihranný (UCl3 typ ), hP8 | |
| P63/ m, č. 176 | |
| Trikovaný trigonální hranolový (devět souřadnic) | |
| Související sloučeniny | |
jiný kationty | Chlorid evropský (III) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Chlorid americký (III) nebo chlorid americký je chemická sloučenina složen z americium a chlór s vzorec AmCl3. Tvoří se růžově šestihranný krystaly. V pevném stavu má každý atom americiia devět atomů chloru jako blízké sousedy, přibližně ve stejné vzdálenosti, v tricapped trigonální prizmatické konfiguraci.[3][4]
Hexahydrát má monoklinovou krystalovou strukturu s: a = 970,2 pm, b = 656,7 pm a c = 800,9 pm; p = 93 ° 37 '; vesmírná skupina: P2/n.[5]
Reakce
Chlorid americký (III) elektroenergetika metoda byla zkoumána k oddělení směsí aktinidy, protože standardní Gibbsova volná energie formace chloridu američitého (III) se hodně liší od zbytku chloridů aktinidů.[6]To lze použít k odstranění americium z plutonium roztavením surové směsi spolu se solemi, jako je chlorid sodný.[7]
Reference
- ^ A b "Chemistry: Periodic Table: americium: compound data (americium (III) chloride)". Webové prvky. Citováno 2008-06-24.
- ^ Perry, Dale L .; Phillips, Sidney L. (1995), Příručka anorganických sloučenin, CRC Press, str. 15, ISBN 0-8493-8671-3, vyvoláno 2008-06-25
- ^ L. B. Asprey, T. K. Keenan, F. H. Kruse: „Krystalové struktury trifluoridů, trichloridů, tribromidů a trijodidů Ameriky a kuria“, Inorg. Chem. 1965, 4 (7), 985–986; doi:10.1021 / ic50029a013.
- ^ A. F. Wells: Strukturní anorganická chemie 5. vydání (1984) Oxford Science Publications, ISBN 0-19-855370-6.
- ^ John H. Burns, Joseph Richard Peterson: „Krystalové struktury hexahydrátu chloridu američitého a hexahydrátu chloridu berkelia“, Inorg. Chem. 1971, 10 (1), 147–151; doi:10.1021 / ic50095a029.
- ^ Agentura pro jadernou energii (2001), Sborník workshopů o pyrochemických separacích, Avignon, Francie: OECD Publishing, s. 276–277, ISBN 92-64-18443-0, vyvoláno 2008-06-24
- ^ Zpracování plutonia v komplexu jaderných zbraní, Diane Publishing, 1992, s. 21, ISBN 1-56806-568-X, vyvoláno 2008-06-24
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
