Chlorid antimonitý - Antimony pentachloride
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Názvy IUPAC Chlorid antimonitý Antimon (V) chlorid | |||
| Ostatní jména Antimonový chlorid Chlorid antimonitý | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.028.729 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| Cl5Sb | |||
| Molární hmotnost | 299.01 g · mol−1 | ||
| Vzhled | bezbarvá nebo červenožlutá (dýmavá) kapalina, olejovitá | ||
| Zápach | štiplavý, urážlivý | ||
| Hustota | 2,336 g / cm3 (20 ° C)[1] 2,36 g / cm3 (25 ° C)[2] | ||
| Bod tání | 2,8 ° C (37,0 ° F; 275,9 K) | ||
| Bod varu | 140 ° C (284 ° F; 413 K) rozkládá se od 106 ° C[3] 79 ° C (174 ° F; 352 K) při 22 mmHg[1] 92 ° C (198 ° F; 365 K) při 30 mmHg[2] | ||
| reaguje | |||
| Rozpustnost | rozpustný v alkohol, HCl, kyselina vinná, CHCI3, CS2, CCl4 | ||
| Rozpustnost v oxychlorid seleničitý | 62,97 g / 100 g (25 ° C) | ||
| Tlak páry | 0,16 kPa (25 ° C) 4 kPa (40 ° C) 7,7 kPa (100 ° C)[4] | ||
| -120.0·10−6 cm3/ mol | |||
Index lomu (nD) | 1.59255 | ||
| Viskozita | 2,034 cP (29,4 ° C)[1] 1,91 cP (35 ° C) | ||
| Struktura | |||
| Trigonální bipyramidální | |||
| 0 D | |||
| Termochemie | |||
Tepelná kapacita (C) | 120,9 J / mol · K (plyn)[3] | ||
Std molární entropie (S | 295 J / mol · K.[3] | ||
Std entalpie of formace (ΔFH⦵298) | -437,2 kJ / mol[3] | ||
Gibbsova volná energie (ΔFG˚) | -345,35 kJ / mol[3] | ||
| Nebezpečí | |||
| Piktogramy GHS |   [2] [2] | ||
| Signální slovo GHS | Nebezpečí | ||
| H314, H411[2] | |||
| P273, P280, P305 + 351 + 338, P310[2] | |||
| Inhalace nebezpečí | Toxický | ||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 77 ° C (171 ° F; 350 K) | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 1115 mg / kg (potkan, orálně)[3] | ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | PEL 0,5 mg / m3 (jako Sb)[5] | ||
REL (Doporučeno) | PEL 0,5 mg / m3 (jako Sb)[5] | ||
| Související sloučeniny | |||
jiný anionty | Antimonový pentafluorid | ||
jiný kationty | Chlorid fosforečný | ||
Související sloučeniny | Chlorid antimonitý | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Chlorid antimonitý je chemická sloučenina vzorce SbCl5. Je to bezbarvý olej, ale typické vzorky jsou nažloutlé kvůli nečistotám. Vzhledem ke své tendenci k hydrolyzovat na kyselina chlorovodíková, SbCl5 je vysoce korozivní látka a musí být skladována ve skle nebo PTFE kontejnery.
Příprava a struktura
Chlorid antimonitý se připravuje průchodem plynný chlór do roztaveného chlorid antimonitý:
- SbCl3 + Cl2 → SbCl5
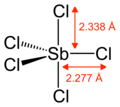
Plynný SbCl5 má trigonální bipyramidovou strukturu.[6]
Reakce
Chlorid antimonitý hydrolyzuje kyselina chlorovodíková a antimon oxychloridy. Tato reakce je potlačena v přítomnosti velkého přebytku chloridu v důsledku tvorby hexachlorantimonátu komplexní ion:
- SbCl5 + Cl− → [SbCl6]−
Mono- a tetrahydráty jsou známé, SbCl5· H2O a SbCl5· 4H2Ó.
Tato sloučenina tvoří adukty s mnoha Lewisovými bázemi. SbCl5 je měkká Lewisova kyselina a jeho ECW model parametry jsou E.A = 3,64 a CA = 10,42. Používá se jako standardní Lewisova kyselina v Gutmannova stupnice Lewisovy bazicity.[7] Nicméně, Cramer-Boppovy zápletky ukazují, že jednoparametrická bazická stupnice je neúplná a že neexistuje jednotné pořadí základní síly. Tyto grafy ukazují, že k definování pořadí síly Lewisovy báze (nebo síly Lewisovy kyseliny) je třeba vzít v úvahu alespoň dvě vlastnosti.[8][9]
Je to také silné oxidační činidlo.[10]
Aplikace
Chlorid antimonitý se používá jako a polymerizace katalyzátor a pro chlorování organických sloučenin.
Opatření
Chlorid antimonitý je vysoce korozivní látka, kterou je třeba skladovat mimo dosah tepla a vlhkosti. Je to chlorační činidlo a za přítomnosti vlhkosti uvolňuje plynný chlorovodík. Z tohoto důvodu může leptat i nerezové nástroje (například jehly), pokud se s nimi zachází ve vlhké atmosféře. Nemělo by se s ním zacházet s nefluorovanými plasty (jako jsou plastové injekční stříkačky, plastové přepážky nebo jehly s plastovým příslušenstvím), protože taje a karbonizuje plastové materiály.[11]
Reference
- ^ A b C „Antimon pentachloride (UK PID)“.
- ^ A b C d E Sigma-Aldrich Co., Antimon (V) chlorid. Citováno 2014-05-29.
- ^ A b C d E F „Antimon (V) chlorid“.
- ^ Chlorid antimonitý v Linstrom, Peter J .; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, Národní institut pro standardy a technologii, Gaithersburg (MD), http://webbook.nist.gov (vyvoláno 2014-05-29)
- ^ A b NIOSH Kapesní průvodce chemickými nebezpečími. "#0036". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ V. Gutmann (1976). "Účinky rozpouštědel na reaktivitu organokovových sloučenin". Coord. Chem. Rev. 18 (2): 225–255. doi:10.1016 / S0010-8545 (00) 82045-7.
- ^ Laurence, C. a Gal, J.-F. Lewisovy stupnice bazicity a afinity, data a měření, (Wiley 2010), str. 50-51 IBSN 978-0-470-74957-9
- ^ Cramer, R.E .; Bopp, T. T. (1977). "Grafické zobrazení entalpií tvorby aduktu pro Lewisovy kyseliny a zásady". Journal of Chemical Education. 54: 612–613. doi:10.1021 / ed054p612. Grafy uvedené v tomto článku používaly starší parametry. Vylepšené parametry E&C jsou uvedeny v ECW model.
- ^ Connelly, N. G .; Geiger, W. E. (1996). "Chemické redoxní látky pro organokovovou chemii". Chem. Rev. 96 (2): 877–922. doi:10.1021 / cr940053x. PMID 11848774.
- ^ Shekarchi, M .; Behbahani, F. K. Catal. Lett. 2017 147 2950. doi: 10,1007 / s10562-017-2194-2
externí odkazy
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |