Dirhenium dekarbonyl - Dirhenium decacarbonyl
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC bis (pentacarbonylrhenium) (Re—Re) | |
| Ostatní jména Rhenium karbonyl; rhenium pentacarbonyl | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.034.714 |
PubChem CID | |
| |
| |
| Vlastnosti | |
| Re2(CO)10 | |
| Molární hmotnost | 652,52 g / mol |
| Bod tání | 170 ° C (rozkládá se) |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | Škodlivé (Xn) |
| R-věty (zastaralý) | R20 |
| S-věty (zastaralý) | S36 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
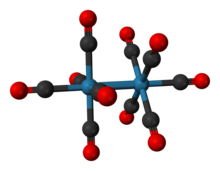
Dirhenium dekarbonyl je anorganická sloučenina s chemickým vzorcem Re2(CO)10 . Komerčně dostupný je používán jako výchozí bod pro syntézu mnoha rhenia karbonyl komplexy. Poprvé to bylo oznámeno v roce 1941 Walter Hieber, který jej připravil redukční karbonylací rhenia.[1] Sloučenina se skládá z dvojice čtvercový pyramidální Re (CO)5 jednotky spojené prostřednictvím vazby Re-Re, která produkuje homoleptický karbonylový komplex.[2]
Dějiny
Ve 30. letech Robert Mond vyvinula metody, které používaly zvýšený tlak a teplotu k výrobě různých forem kovový karbonyl . Významný vědec dvacátého století, Walter Hieber byl rozhodující pro další vývoj konkrétně dirhenium dekarbonyl. Počáteční snahy vyprodukovaly komplexy mononukleárních kovů, ale při dalším hodnocení Hieber zjistil, že použitím Re2Ó7 jako výchozí materiál bez rozpouštědla bylo možné dosáhnout dirheniového komplexu produkujícího interakci Re-Re.[3]
Struktura a vlastnosti
Krystalová struktura Re2(CO)10 je poměrně dobře známý. Sloučenina se skládá z dvojice čtvercový pyramidální Re (CO)5 jednotky spojené vazbou Re-Re. Mohou nastat dvě různé konformace: střídavé a zatměné. The zatměná konformace nastává asi 30% času, produkující D4h bodová skupina, ale střídavý tvar s bodovou skupinou D4d, je stabilnější. Experimentálně bylo zjištěno, že délka vazby Re-Re je 3,04 Á.[4]
Atom Re existuje v mírně zkreslené oktaedrické konfiguraci s rovinným úhlem C axial-Re-C rovným 88 °. Průměrná délka vazby Re-C 2,01 A je stejná pro axiální a rovníkový pozic. Průměrná vzdálenost C-O je 1,16 Å.[1][5]
Tato sloučenina má široké IR absorpční pásmo na 1 800 cm−1 region lze přiřadit dvěma komponentám se středem 1780 a 1830 cm−1, který je výsledkem adsorpce CO. Zbývajících devět skupin CO v Re2(CO)10 dát komplexní absorpci IR v letech 1950–2150 cm−1 kraj. Zdarma Re2(CO)10 (bodová symetrie D4d ) má CO úsekovou reprezentaci 2A1+ E.2 + E.3+ 2B2 + E.1, kde 2B2 + E.1 jsou IR aktivní. Pro axiálně narušené (C4v) Re2(CO)10 molekuly, bylo zjištěno, že reprezentace protažení CO je 2E + B1+ B2+ 3A1, kde IR aktivní režimy jsou 2E + 3A1.[6]
Jeho identitu lze potvrdit také hmotnostní spektrometrií pomocí izotopového vzoru rhenia (185Re a 187Re).[7]
Syntéza
Dirhenium dekarbonyl lze získat redukční karbonylací oxid rhenium (VII) (Re2Ó7) při 350 atm a 250 ° C.[3]
- Re2Ó7 + 17 CO → Re2(CO)10 + 7 CO2
Reakce
Karbonylové ligandy mohou být nahrazeny jinými ligandy, jako jsou fosfiny a fosfity (označeno L).[7][8]
- Re2(CO)10 + 2 L → Re2(CO)8L2
Tuto sloučeninu lze také „krakovat“ na mononukleární karbonylové komplexy Re (I) halogenace:[9]
- Re2(CO)10 + X2 → 2 Re (CO)5X (X = Cl, Br, I)
Při použití bromu brompentakarbonylrhenium (I) se tvoří, což je meziprodukt pro mnoho dalších komplexů rhenia.[7]Tato sloučenina může být také hydrogenována za vzniku různých polyrheniových komplexů, případně za vzniku elementárního rhenia.[10]
- Re2(CO)10 → H3Re3(CO)12 → H5Re4(CO)12 → Re (kov)
V přítomnosti vody byla fotolýza Re2(CO)10 poskytuje hydroxidový komplex:[11]
- Re2(CO)10 → HRe (CO)5 + Re4(CO)12(ACH)4
Tato reakce zahrnuje štěpení Re-Re vazby a syntézu HRe (CO)5, které lze použít k přípravě povrchových struktur určených k zabudování izolovaných povrchově vázaných komplexů Re karbonylu.[12]
Ztráta karbonylového ligandu fotolýzou generuje a koordinačně nenasycené komplex, který prochází oxidační přísada vazeb Si-H, například:
- Re2(CO)10 + HSiCl3* → (CO)5ReHRe (CO)4SiCl3 + CO
Aplikace
Katalýza na bázi rhenia byla použita v metateze, reformování, hydrogenace a různé procesy hydrogenačního zpracování, jako je hydrodesulfurizace.[13] Re2(CO)10 lze použít k podpoře silace alkoholů a k přípravě alkoholu silyl ethery a jeho reakce:[14]
- RSiH3 + R’OH → RH2SiOR ‘+ H2
Viz také
Reference
- ^ A b W. Hieber; H. Fuchs (1941). „Über Metallcarbonyle. XXXVIII. Über Rheniumpentacarbonyl“. Zeitschrift für anorganische und allgemeine Chemie (v němčině). 248 (3): 256–268. doi:10.1002 / zaac.19412480304.
- ^ F. Armstrong; J. Rourke; M. Hagerman; M. Weller; P. Atkins; T. Overton (2010). „Shiver and Atkins 'Anorganic Chemistry 5. vydání“: 555. Citovat deník vyžaduje
| deník =(Pomoc) - ^ A b H. Werner (2009). „Organo-Transition Metal Chemistry: a Personal View“: 93. Citovat deník vyžaduje
| deník =(Pomoc) - ^ M. Churchill; K. Amoh; H. Wasserman (1981). "Nové určení krystalové struktury dimanganekakarbonylu a stanovení krystalové struktury dirhenium dekarbonyl. Upravené hodnoty délek vazeb mangan-mangan a rhenium-rhenium v dimangan dekakarbonyl a dirhenium dekarbonyl". Anorganická chemie. 20 (3): 1609–1612. doi:10.1021 / ic50219a056.
- ^ N.IGapotchenko; et al. (1972). "Molekulární struktura dirhenium dekarbonyl". Journal of Organometallic Chemistry. 35 (2): 319–320. doi:10.1016 / S0022-328X (00) 89806-X.
- ^ E. Escalona Platero; F.R. Peralta; C. Otero Areán (1995). "Depozice v parní fázi a tepelná dekarbonylace Re2(CO)10 o gama-oxidu hlinitém: infračervené studie “. Katalýza dopisy. 34 (1): 65–73. doi:10.1007 / BF00808323. S2CID 101025211.
- ^ A b C DOPOLEDNE. Stolzenberg; E.L. Muetterties (1983). „Mechanismy substitučních reakcí dirhenium dekarbonyl: křížové experimenty s dirhenium-185 dekarbonylem a dirhenium-187 dekarbonylem“. Journal of the American Chemical Society. 105 (4): 822–827. doi:10.1021 / ja00342a029.
- ^ K.S. Suslick; P.F. Schubert (1983). "Sonochemie dimangan dekakarbonylu (Mn2(CO)10) a dirhenium dekarbonyl (Re2(CO)10)". Journal of the American Chemical Society. 105 (19): 6042–6044. doi:10.1021 / ja00357a014.
- ^ Steven P. Schmidt; William C. Trogler; Fred Basolo (2007). Pentakarbonylrheniumhalogenidy. Anorganické syntézy. 28. str. 154–159. doi:10.1002 / 9780470132593.ch42. ISBN 9780470132593.
- ^ C. Dossi, J. Schaefer, W. M. H. Sachtler (1989). „Mechanismus tvorby částic při rozkladu Re2(CO)10 na zeolity NaY a NaHY: účinek předredukovaných shluků Pt v superklecích ". Journal of Molecular Catalysis. 52 (1): 193–209. doi:10.1016/0304-5102(89)80089-6.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ D. R. Gard; T. L. Brown (1982). "Fotochemické reakce dirhenium dekarbonyl s vodou". Journal of the American Chemical Society. 104 (23): 6340–6347. doi:10.1021 / ja00387a031.
- ^ P. S. Kirlin; et al. (1990). „Povrchová katalytická místa připravená z [HRe (CO)5] a [H3Re3(CO)12]: mononukleární, trinukleární a kovové rheniové katalyzátory podporované na hořčíku ". Journal of Physical Chemistry. 94 (92): 8439–8450. doi:10.1021 / j100385a017. hdl:1874/5964.
- ^ R. Jarkko; AP Tapani (2000). „Řízená příprava v plynné fázi a HDS aktivita Re2(CO)10 katalyzátory na bázi oxidu hlinitého ". Katalýza dopisy. 65 (4): 175–180. doi:10.1023 / A: 1019006413873. S2CID 96952765.
- ^ D.H.R.Barton, M.J. Kelly (1992). "Mechanismus a užitečnost dirhenium dekarbonyl katalyzované tvorby silyletherů". Čtyřstěn dopisy. 33 (35): 5041–5044. doi:10.1002 / brada.199302225.
