Chlorid uranu - Uranium hexachloride
 | |
| Jména | |
|---|---|
| Název IUPAC Chlorid uraničitý | |
| Ostatní jména Chlorid uranu Peruranic chlorid | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Vlastnosti | |
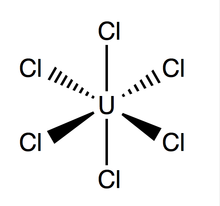
| UCl6 | |
| Molární hmotnost | 450 745 g / mol |
| Vzhled | tmavě zelená krystalická pevná látka |
| Hustota | 3600 kg / m3 |
| Bod tání | 177 ° C (351 ° F; 450 K) |
| Bod varu | 75 ° C (167 ° F; 348 K) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Chlorid uranu (UCl6) je anorganické chemická sloučenina z uran v +6 oxidační stav.[1][2] UCl6 je halogenid kovu složený z uran a chlór. Je to multiluminiscenční tmavě zelená krystalická pevná látka s tlakem par mezi 1-3 mmHg při 373,15 K.[3] UCl6 je stabilní v a vakuum, Suchý vzduch, dusík a hélium na pokojová teplota. Je rozpustný v chlorid uhličitý (CCl4). Ve srovnání s jinými halogenidy uranu je o UCl známo jen málo6.
Struktura a lepení
Chlorid uranový má osmistěn geometrie, s bodová skupina Óh. Své mříž (rozměry: 10,95 ± 0,02 Á x 6,03 ± 0,01 Á) je hexagonálního tvaru se třemi molekulami na buňku; průměrná teoretická vazba U-Cl je 2,472 Å dlouhá (experimentální délka U-Cl zjištěná Rentgenová difrakce je 2,42 Å),[4] a vzdálenost mezi dvěma sousedními atomy chloru je 3,65 Á.
Chemické vlastnosti
Hexachlorid uranu je vysoce hygroskopický sloučenina a snadno se rozkládá při vystavení běžným atmosférickým podmínkám.[5] proto by se s ním mělo zacházet buď ve vakuovém přístroji, nebo v suché krabici.
Tepelný rozklad
UCl6 je stabilní až do teplot mezi 120 ° C a 150 ° C. The rozklad UCl6 vede k přechodu na pevnou fázi z jedné krystalické formy UCl6 do jiné stabilnější formy.[6] Nicméně rozklad z plynný UCl6 produkuje UCl5. The aktivační energie pro tuto reakci je asi 40 kcal na krtek.
- 2 UCl6 (g) → 2 UCl5 (s) + Cl2 (G)
Rozpustnost
UCl6 není moc rozpustný sloučenina. Rozpouští se v CCl4 čímž se získá hnědý roztok. Je mírně rozpustný v isobutylbromidu a ve fluorouhlíku (C.7F16).[7]
| Rozpouštědla | Teplota (° C) | Gramy UCl6/ 100 g roztoku |
|---|---|---|
| CCl4 | −18 | 2.64 |
| CCl4 | 0 | 4.9 |
| CCl4 | 20 | 7.8 |
| 6.6% Cl2 : 93.4% CCl4 | −20 | 2.4 |
| 12.5% Cl2 : 87.5% CCl4 | −20 | 2.23 |
| 12.5% Cl2 : 87.5% CCl4 | 0 | 3.98 |
| Kapalný Cl2 | −33 | 2.20 |
| CH3Cl | −24 | 1.16 |
| Benzen | 80 | Nerozpustný |
| Freon 113 | 45 | 1.83 |
Reakce s fluorovodíkem
Když UCl6 reaguje s čištěnou bezvodou kapalinou fluorovodík (HF) při pokojové teplotě UF5.[8]
- 2 UCl6+ 10 HF → 2 UF5 + 10 HCl + Cl2
Syntéza
Hexachlorid uranu lze syntetizovat z reakce oxid uranový (UO3) se směsí kapalného CCI4 a horký chlór (Cl2). Výtěžek se může zvýšit, pokud se reakce provádí v přítomnosti UCI5.[9] UO3 se převádí na UCl5, který zase reaguje s přebytkem Cl2 za vzniku UCl6. Vyžaduje značné množství tepla pro reakce se bude konat; teplotní rozsah je od 65 ° C do 170 ° C v závislosti na množství reaktant (ideální teplota 100 ° C - 125 ° C). Reakce se provádí v uzavřené plynotěsné nádobě (například a schránka v palubní desce ), které vydrží tlak, který se vytváří.
Krok 1: 2 UO3 + 5 Cl2 → 2 UCl5 + 3 O.2
Krok 2: 2 UCI5 + Cl2 → 2 UCl6
Celková reakce: 2 UO3 + 6 Cl2 → 2 UCl6 + 3 O.2
Tento hexahalid kovu lze také syntetizovat foukáním Cl2 plyn nad sublimovaným UCl4 při 350 ° C.[10]
Krok 1: 2 UCI4 + Cl2 → 2 UCl5
Krok 2: 2 UCI5 + Cl2 → 2 UCl6
Celková reakce: UCl4 + Cl2 → UCl6
Reference
- ^ Zachariasen, W. H. (1948). „Krystalové chemické studie řady 5f prvků. V. Krystalová struktura hexachloridu uranu“. Acta Crystallographica. 1 (6): 285–287. doi:10.1107 / S0365110X48000788.
- ^ Taylor, J. C .; Wilson, P. W. (1974). „Neutronové a rentgenové práškové difrakční studie struktury hexachloridu uranu“. Acta Crystallographica oddíl B. 30 (6): 1481. doi:10.1107 / S0567740874005115.
- ^ Van Dyke, R.E .; Evers, E. C. (1955). "Příprava hexachloridu uranu". Patenty Google: 2.
- ^ Batista, E. R .; Martin, R.L .; Hay, P. J. (2004). "Hustotní funkční zkoumání vlastností a termodynamiky UFn a UCln (n = 1, ..., 6) ". J. Chem. Phys. 121 (22): 11104–11. doi:10.1063/1.1811607. PMID 15634063.
- ^ Lipkin, D .; Wessman, S. (1955). "Proces a zařízení na ochranu hexachloridu uranu před poškozením a kontaminací". Patenty Google: 2.
- ^ Katz, J.J .; Rabinowitch, E. (1951). Chemie uranu. Ann Arbor: McGraw-Hill Book Company.
- ^ Katz, J. J.; Rabinowitch, E. (1951). Chemie uranu. Ann Arbor: McGraw-Hill Book Company.
- ^ Katz, J. J.; Rabinowitch, E. (1951). Chemie uranu. Ann Arbor: McGraw-Hill Book Company.
- ^ Van Dyke, R.E .; Evers, E. C. (1955). "Příprava hexachloridu uranu". Patenty Google: 2.
- ^ Thornton, G .; Edelstein, N .; Rösch, N .; Woodwark, D.R .; Edgell, R.G. (1979). „Elektronická struktura UCl6: Photoelectron Spectra and Scattered Wave Xα Výpočty ". J. Chem. Phys. 70 (11): 6. Bibcode:1979JChPh..70.5218T. doi:10.1063/1.437313.
