Chlorid tantalitý - Tantalum(V) chloride
 | |
| Jména | |
|---|---|
| Názvy IUPAC Chlorid tantalitý Chlorid tantalitý | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| Informační karta ECHA | 100.028.869 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| TaCl5 | |
| Molární hmotnost | 358,213 g / mol |
| Vzhled | bílý monoklinický krystaly[1] |
| Hustota | 3,68 g / cm3 |
| Bod tání | 216 ° C (421 ° F; 489 K) |
| Bod varu | 239,4 ° C (462,9 ° F; 512,5 K) (rozkládá se) |
| reaguje | |
| Rozpustnost | chloroform, CCl4 |
| +140.0×10−6 cm3/ mol | |
| Struktura | |
| Monoklinický, mS72 | |
| C2 / m, č. 12 | |
| Termochemie | |
Std molární entropie (S | 221,75 J K.−1 mol−1 |
Std entalpie of formace (ΔFH⦵298) | -858,98 kJ / mol |
| Nebezpečí | |
| Bod vzplanutí | Nehořlavé |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 1900 mg / kg (orálně, potkan) |
| Související sloučeniny | |
jiný anionty | Tantal (V) fluorid Tantal (V) bromid Jodid tantaličitý |
jiný kationty | Chlorid vanaditý Chlorid niobičitý |
Související sloučeniny | Chlorid tantalitý, Chlorid tantalitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Chlorid tantalitý, také známý jako chlorid tantalitý, je anorganická sloučenina se vzorcem TaCl5. Má formu bílého prášku a běžně se používá jako výchozí materiál v tantal chemie. Snadno hydrolyzuje za vzniku tantalu (V) oxychlorid (TaOCl3) a nakonec oxid tantalitý (Ta2Ó5); to vyžaduje, aby to bylo syntetizováno a manipulováno pod ním bezvodý podmínek, pomocí bezvzduchové techniky.
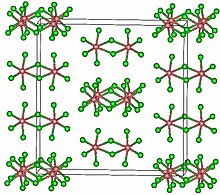
Struktura
TaCl5 krystalizuje v monoklinický vesmírná skupina C2/m.[2] Deset atomů chloru definuje dvojici oktaedrů, které mají společnou hranu. Atomy tantalu zabírají středy oktaedru a jsou spojeny dvěma chlory přemosťující ligandy. Dimerní struktura je zachována v nekomplexních rozpouštědlech a do značné míry v roztaveném stavu. Ve stavu páry však TaCl5 je monomerní. Tento monomer přijímá a trigonální bipyramidová struktura, jako to PCl5.[3]
Fyzikální vlastnosti
Rozpustnost chloridu tantaličitého se u následujících sérií mírně zvyšuje aromatické uhlovodíky:
To se odráží v prohlubování barvy roztoků od světle žluté po oranžovou. Chlorid tantalový je méně rozpustný v cyklohexan a chlorid uhličitý než v aromatických uhlovodících. O takových řešeních chloridu tantalitého je také známo, že jsou špatnými vodiči elektřiny, což naznačuje malou ionizaci. TaCl5 je čištěn sublimace dát bílé jehly.
Syntéza
Chlorid tantalitý lze připravit reakcí práškového kovu tantal s chlór plyn při teplotě mezi 170 a 250 ° C. Tuto reakci lze také provést za použití HCl při 400 ° C.[4]
- 2 Ta + 5 Cl2 → 2 TaCl5
- 2 Ta + 10 HCl → 2 TaCl5 + 5 hodin2
Může být také připraven reakcí mezi oxid tantalitý a thionylchlorid při 240 ° C
- Ta2Ó5 + 5 SOCl2 → 2 TaCl5 + 5 TAK2
Chlorid tantalitý je komerčně dostupný, vzorky však mohou být kontaminovány tantalem (V) oxychlorid (TaOCl3), vzniklý hydrolýzou.
Reakce
TaCl5 je elektrofilní a chová se jako Friedel – Craftsův katalyzátor, podobný AlCl3. Tvoří se adukty s řadou Lewisovy základny.[5]
Jednoduché addukty
TaCl5 tvoří stabilní komplexy s ethery:
- TaCl5 + R.2O → TaCl5(NEBO2) (R = já, Et)
TaCl5 také reaguje s chlorid fosforečný a oxychlorid fosforitý, první jako donor chloridu a druhý slouží jako ligand vázající se přes kyslík:
- TaCl5 + PCl5 → [PCl+
4][TaCl−
6] - TaCl5 + OPCl3 → [TaCl5(OPCl3)]
Chlorid tantalový reaguje s terciární aminy za vzniku krystalických aduktů.
- TaCl5 + 2 R.3N → [TaCl5(NR3)]
Reakce vytěsnění chloridů
Chlorid tantalový reaguje při teplotě místnosti s přebytkem trifenylfosfin oxid dát oxychloridy:
- TaCl5 + 3 OPPh3 → [TaOCl3(OPPh3)]X ...
Předpokládaná počáteční tvorba aduktů mezi TaCl5 a hydroxylové sloučeniny, jako je alkoholy, fenoly a karboxylové kyseliny okamžitě následuje eliminace chlorovodíku a tvorba vazeb Ta – O:
- TaCl5 + 3 HODINY → TaCl2(OEt)3 + 3 HCl
V přítomnosti amoniak jako HCl akceptoru, všech pět chloridových ligandů je vytěsněno za vzniku Ta (OEt)5. Podobně TaCl5 reaguje s methoxid lithný v bezvodém stavu methanolu za vzniku souvisejících methoxyderivátů:
- TaCl5 + 4 LiOMe → Ta (OMe)4Cl + 4 LiCl
Amoniak vytěsní většinu chloridových ligandů z TaCl5 dát shluk. Chlorid je vytlačován pomaleji hlavní nebo sekundární aminy ale nahrazení všech pěti chloridových center amidoskupinami bylo dosaženo použitím lithium dialkylamidů, jak je ilustrováno syntézou pentakis (dimethylamido) tantal:
- TaCl5 + 5 LiNMe2 → Ta (NMe2)5
S alkoholy reaguje pentachlorid za vzniku alkoxidy. Jak je ukázáno pro přípravu tantal (V) ethoxid, takové reakce se často provádějí v přítomnosti báze:
- 10 EtOH + Ta2Cl10 + 10 NH3 → Ta2(OEt)10 + 10 NH4Cl
Chlorid tantalitý je redukován dusíkatými heterocykly, jako je pyridin.
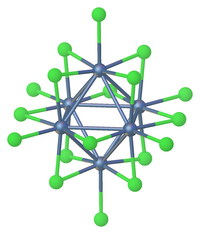
Snížení
Redukce chloridu tantaličitého dává aniontové a neutrální klastry včetně [Ta6Cl18]4− a [Ta6Cl14] (H2Ó)4.[6]
Reference
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87. vydání). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ Rabe, Susanne; Müller, Ulrich (2000). "Krystalová struktura chloridu tantalitého (TaCl5)2". Z. Kristallogr. - New Cryst. Struct. 215 (1): 1–2. doi:10.1515 / ncrs-2000-0102.
- ^ F. Fairbrother (1967). Chemie niobu a tantalu. Elsevier.
- ^ Young, Ralph C .; Brubaker, Carl H. (1952). „Reakce tantalu s chlorovodíkem, bromovodíkem a chloridem tantalitým; působení vodíku na chlorid tantalitý“. Journal of the American Chemical Society. 74 (19): 4967. doi:10.1021 / ja01139a524.
- ^ F. A. Bavlna, G. Wilkinson, Pokročilá anorganická chemie (4. vydání), Wiley, New York, 1980.
- ^ Duraisamy, Thirumalai; Hay, Daniel N. T .; Messerle, Louis (2014). "Octahedral Hexatantalum Halide Clusters". Anorganické syntézy: Svazek 36. Anorganické syntézy. 36. s. 1–8. doi:10.1002 / 9781118744994.ch1. ISBN 9781118744994.
- ^ Thaxton, C. B .; Jacobson, R. A. (1971). „Krystalová struktura H2(Ta6Cl18) (H2Ó)6". Anorganická chemie. 10: 1460–1463. doi:10.1021 / ic50101a029.CS1 maint: používá parametr autoři (odkaz)
Další čtení
- Ozin, G. A .; Walton, R. A. (1970). „Vibrační spektra a struktury komplexů niobu a tantalu, pentachloridů a pentabromidu tantalu v poměru 1: 1 s aceto-, perdeuterioaceto- a propionitrilem v pevném stavu a v roztoku a vibrační analýzou druhu MX5, NC · CY3 (Y = H nebo D) ". J. Chem. Soc. A: 2236–2239. doi:10.1039 / j19700002236.
- Bullock, J. I .; Parrett, F. W .; Taylor, N. J. (1973). „Některé komplexy halogenidů kovů a halogenidů fosforu a alkylhalogenidů. Část II. Reakce s chloridy niobu a pentachloridu tantaličitého a chloridem wolframovým.“ J. Chem. Soc., Dalton Trans. (5): 522–524. doi:10.1039 / DT9730000522.
- Đorđević, C .; Katović, V. (1970). "Koordinační komplexy niobu a tantalu. Část VIII. Komplexy niobu (IV), niobu (V) a tantalu (V) se směsnými oxo, halogeny, alkoxy a 2,2'-bipyridylovými ligandy." J. Chem. Soc. A: 3382–3386. doi:10.1039 / j19700003382.
- Cowley, A .; Fairbrother, F .; Scott, N. (1958). "Halogenidy niobu (columbium) a tantalu. Část V. Diethyletherové komplexy pentachloridů a pentabromidů; rozpustnost pentajodidu tantalu v etheru." J. Chem. Soc.: 3133–3137. doi:10.1039 / JR9580003133.
