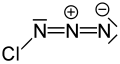Azid chloru - Chlorine azide
| |||
| Jména | |||
|---|---|---|---|
| Ostatní jména Nitrid chloru; Chlorid dusičitý | |||
| Identifikátory | |||
3D model (JSmol ) | |||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| Vlastnosti | |||
| ClN3 | |||
| Molární hmotnost | 77,4731 g / mol | ||
| Vzhled | Žlutá oranžová kapalina; bezbarvý plyn | ||
| Bod tání | −100 ° C (−148 ° F; 173 K) | ||
| Bod varu | -15 ° C (5 ° F; 258 K) | ||
| Rozpustnost | Rozpustný[vágní ] v butan, pentan, benzen, methanolu, ethanol, diethylether, aceton, chloroform, chlorid uhličitý, a sirouhlík; málo rozpustný ve vodě | ||
| Struktura | |||
| ortorombický | |||
| Cmc 21, Č. 36[1] | |||
| Výbušná data | |||
| Citlivost na nárazy | Extrémní | ||
| Citlivost na tření | Extrémní | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Extrémně citlivá výbušnina | ||
| NFPA 704 (ohnivý diamant) | |||
| Související sloučeniny | |||
Související sloučeniny | Azid fluoru Azid bromu Kyselina hydrazoová | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Azid chloru (ClN3) je anorganická sloučenina který objevil v roce 1908 Friedrich Raschig.[2] Koncentrovaný ClN
3 je notoricky nestabilní a může se spontánně odpálit při jakékoli teplotě.[3]
Příprava a manipulace
Azid chloru se připraví průchodem plynný chlór přes azid stříbrný, nebo přidáním octová kyselina k řešení chlornan sodný a azid sodný.[4]
Při léčbě amoniak je možné, že jeden nebo více ze tří možných azinaminy, NH2N3, NH (N3)2a N (N3)3 mohou být vytvořeny.[Citace je zapotřebí ]
Výbušné vlastnosti
Chlorazid je extrémně citlivý. Může explodovat, někdy i bez zjevné provokace; je tedy příliš citlivý na to, aby byl používán komerčně, pokud nebyl nejprve zředěn v roztoku. Chlorazid reaguje s 1,3-butadien, etan, eten, metan, propan, fosfor, azid stříbrný, a sodík. Při kontaktu s kyselina, chlorid azid se rozkládá, vyvíjí toxický a korozivní chlorovodík plyn.[5]
Informace o předpisech
Jeho zásilka podléhá přísným požadavkům na podávání zpráv a předpisům Americké ministerstvo dopravy.
Reference
- ^ Lyhs, Benjamin; Bläser, Dieter; Wölper, Christoph; Schulz, Stephan; Jansen, Georg (2012). „Srovnání struktur v pevné fázi halogenidů azidů XN3 (X = Cl, Br, I) ". Angewandte Chemie International Edition. 51 (51): 12859–12863. doi:10,1002 / anie.201206028.
- ^ Frierson, W. J .; Browne, A. W. (1943). „Azid chloru. II. Interakce chloridu azidu a azidu stříbra. Azino Silver Chloride, N3AgCl ". Journal of the American Chemical Society. 65 (9): 1698–1700. doi:10.1021 / ja01249a013.
- ^ Frierson, W. J .; Kronrad, J .; Browne, A. W. (1943). „Chlorchlorid, ClN3. I. ". Journal of the American Chemical Society. 65 (9): 1696–1698. doi:10.1021 / ja01249a012.
- ^ Raschig, F. (1908). „Über Chlorazid N3Cl ". Berichte der Deutschen Chemischen Gesellschaft. 41 (3): 4194–4195. doi:10,1002 / cber.190804103130.
- ^ CID 61708 z PubChem
externí odkazy
 Média související s Azid chloru na Wikimedia Commons
Média související s Azid chloru na Wikimedia Commons
Soli a kovalentní deriváty azid ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | On | ||||||||||||||||||
| LiN3 | Buďte (N3)2 | B (č3)3 | CH3N3, C (č3)4 | N (N3)3, H2N — N3 | Ó | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Hřích3)4 | P | TAK2(N3)2 | ClN3 | Ar | ||||||||||||
| KN3 | Umět3)2 | Sc (č3)3 | Cín3)4 | VO (č3)3 | Cr (č3)3, CrO2(N3)2 | Mn (č3)2 | Fe (N3)2, Fe (N3)3 | Ošidit3)2, Ošidit3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | Tak jako | Se (N3)4 | BrN3 | Kr | ||
| RbN3 | Sr (N3)2 | Y | Zr (N3)4 | Pozn | Mo | Tc | Běh3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (č3)2 | v | Sn | Sb | Te | V3 | Xe (č3)2 | ||
| Čs3 | Zákaz3)2 | Hf | Ta | Ž | Re | Os | Ir (č3)63− | Pt (č3)62− | Au (N3)4− | Hg2(N3)2, Hg (č3)2 | TlN3 | Pb (č3)2 | Zásobník3)3 | Po | Na | Rn | |||
| Fr. | Běžel3)2 | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Los Angeles | Ce (N3)3, Ce (N3)4 | Pr | Nd | Odpoledne | Sm | Eu | Gd (N3)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Čt | Pa | UO2(N3)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||