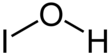
Kyselina hypojoditá - Hypoiodous acid
| |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Kyselina hypojoditá | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| HIO | |||
| Molární hmotnost | 143,89 g / mol | ||
| Kyselost (strK.A) | 10,5 (ve vodě, odhad) | ||
| Konjugovaná základna | Hypoiodit | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina hypojoditá je anorganická sloučenina s chemický vzorec HIO. Tvoří se, když je vodný roztok jód je ošetřena solemi rtuti nebo stříbra. Rychle se rozkládá nepřiměřenost:[1]
- 5 HIO → HIO3 + 2 já2 + 2 H2Ó
Hypojoditany alkalických kovů a kovů alkalických zemin lze připravovat ve studených zředěných roztocích, pokud se k jejich příslušným hydroxidům přidává jod. Kyselina jodovodíková je slabá kyselina s pK.A asi 11. Konjugovaná báze je hypojodit (IO−). Soli tohoto aniontu lze připravit zpracováním I2 s alkalickými hydroxidy. Rychle se nepřiměřeně tvoří jodidy a jodičnany.[1]
Reference
- ^ A b Holleman, A.F. (2001). Wiberg, Nils (ed.). Anorganická chemie (1. anglické vydání). San Diego, Kalifornie: Berlin: Academic Press, W. de Gruyter. ISBN 0-12-352651-5.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |