Kyselina chloroplatičitá - Chloroplatinic acid
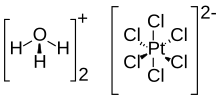 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Dihydronium hexachloroplatinate (2–) | |
| Ostatní jména Kyselina hexachloroplatinová | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.037.267 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 2507 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| H6Cl6Ó2Pt | |
| Molární hmotnost | 409,81 g / mol |
| Vzhled | Červenohnědá pevná látka |
| Hustota | 2,431 g / cm3 |
| Bod tání | 60 ° C (140 ° F; 333 K) |
| Bod varu | rozkládá se |
| vysoce rozpustný | |
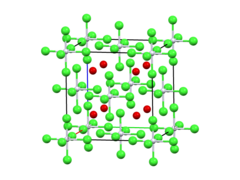
| Struktura | |
| Antifluorit. | |
| osmistěn | |
| 0 D | |
| Nebezpečí | |
| Bezpečnostní list | Externí bezpečnostní list |
| Piktogramy GHS |     |
| Signální slovo GHS | Nebezpečí |
| H301, H314, H317, H334 | |
| P260, P261, P264, P270, P272, P280, P285, P301 + 310, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 340, P304 + 341, P305 + 351 + 338, P310, P321, P330, P333 + 313, P342 + 311, P363, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
jiný anionty | Kyselina hexachloropalladová |
jiný kationty | Hexachloroplatinát draselný, Hexachloroplatinát amonný, Rubidium hexachloroplatinate, Hexachloroplatinát cesný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyselina chloroplatičitá (také známý jako kyselina hexachloroplatinová) je anorganická sloučenina se vzorcem [H3Ó]2[PtCl6] (H2Ó)X (0 ≤ X ≤ 6). Červená pevná látka je důležitým komerčním zdrojem Platina, obvykle jako vodný roztok. Ačkoli je často psán zkratkou jako H2PtCl6, to je hydronium (H3Ó+) sůl hexachloroplatinátového aniontu (PtCl2−
6).[1][2][3] Kyselina hexachloroplatičitá je vysoce hygroskopický.
Výroba

Kyselinu hexachloroplatinovou lze vyrábět různými způsoby. Nejběžnější z těchto metod zahrnuje rozpuštění platiny v Lučavka královská. Další způsoby zahrnují vystavení vodné suspenze platinových částic plynnému chloru nebo elektrolýzou.
Pokud se vyrábí cestou aqua regia, předpokládá se, že kyselina hexachlorplatinová vzniká následující rovnicí: [4][5]
- Pt + 4 HNO3 + 6 HCl → H2PtCl6 + 4 NO2 + 4 H2Ó
Výsledný oranžovo-červený roztok lze odpařit za vzniku hnědavě červených krystalů. Někteří autoři naznačují, že kyselina hexachloroplatičitá vyrobená touto metodou je kontaminována nitrosonium hexachloroplatinátem. Novější literatura naznačuje, že tomu tak není, a že jakmile byla odstraněna kyselina dusičná, vzorky připravené touto metodou neobsahují detekovatelný dusík.
Byly prozkoumány a popsány alternativní metody, často motivované zamezením kontaminace dusíkem.[6]
Reakce
Při zahřátí se kyselina hexachloroplatičná rozkládá na chlorid platičitý.[1]
- (H3Ó)2PtCl6·nH2O → PtCl4 + 2 HCl + (n + 2) H2Ó
Aplikace
Stanovení draslíku
Kyselina chloroplatičitá byla popularizována pro kvantitativní analýza draslíku. Draslík se selektivně vysráží z řešení jako hexachloroplatinát draselný. Stanovení byla provedena v 85% (v / v) alkoholových roztocích s přebytkem platinových iontů a vysrážený produkt byl zvážen. Draslík mohl být detekován pro roztoky zředěné jako 0,02 až 0,2% (m / v).[7]
Tato metoda pro stanovení draslíku byla výhodná ve srovnání s metodou kobaltitan sodný dříve použitá metoda, protože vyžadovala jedinou srážky reakce.[7] Gravimetrické analýza vysrážených produktů byla nahrazena moderní instrumentální analýza metody jako iontově selektivní elektrody, plamenová fotometrie, ICP-AES nebo ICP-MS.
Čištění platiny
Po zpracování amonnou solí, jako je např chlorid amonný se kyselina chloroplatičitá převádí na hexachloroplatinát amonný, která se vysráží jako pevná látka.[4] Po zahřátí v atmosféře vodík se amonná sůl převádí na elementární platinu. Platina se často izoluje z rud nebo se recykluje ze zbytků.[8]
Katalýza
Stejně jako mnoho sloučenin platiny je kyselina chloroplatičitá katalyzátorem (nebo prekatalyzátorem) hydrogenace a související reakce. Jak poprvé uvedl John Speier a kolegové z Dow Corning, katalyzuje přidání hydrosilanů k olefinům, tj. hydrosilylace. Včasné demonstrační reakce používaly roztoky isopropanolu z trichlorsilan (SiHCl3) s penteny. Předchozí práce na přidání silanů do alkenů vyžadovaly neúčinné radikální reakce.[9][10] Stejně jako s Karstedtův katalyzátor „Speierův katalyzátor má široké využití pro hydrosilylaci, hlavní nevýhodou jsou rozplývavé vlastnosti katalyzátoru.[11]
Obecně se souhlasí s tím, že kyselina chloroplatičitá je prekurzorem skutečného katalyzátoru. Možná role koloidní platiny nebo nulová valence zváženy byly také komplexy.[12]
Související sloučeniny
Kyselina chloroplatičitá připravená z Lučavka královská navrhuje se, aby obsahoval nitrosonium hexachloroplatinát, (NO)2PtCl6. Nitrosonium hexachloroplatinát se získá reakcí nitrosylchlorid (NOCl) a platinový kov.[13] Bylo zjištěno, že nitrosonium hexachloroplatinát intenzivně reaguje s vodou a kyselinou chlorovodíkovou, takže je nepravděpodobná kontaminace kyseliny chloroplatinové připravené pomocí aqua regia nitrosonium hexachloroplatinátem.
Reference
- ^ A b Schweizer, A.E .; Kerr, G. T. (1978). "Tepelný rozklad kyseliny hexachloroplatinové". Inorg. Chem. 17 (8): 2326–2327. doi:10.1021 / ic50186a067.
- ^ Holleman; Wiberg (2001). Anorganická chemie (První vydání). New York: Academic Press. ISBN 0-12-352651-5.
- ^ Greenwood, N. N .; Earnshaw, A. (1997). Chemie prvků (Druhé vydání.). New York: Elsevier Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ A b Kauffman, George B. (1967). "Hexachloroplatinát amonný (IV)". Anorganické syntézy. 9: 182–185. doi:10.1002 / 9780470132401.ch51. ISBN 9780470132401.
- ^ Grube, H. (1963). "Kyselina hexachloroplatinová (IV)". V Brauer, G. (ed.). Příručka preparativní anorganické chemie. 2 (2. vyd.). New York: Academic Press. p. 1569.
- ^ Rudnick, Paul; Cooke, R. D. (1917). „Příprava kyseliny chlorovodíkové pomocí peroxidu vodíku“. J. Am. Chem. Soc. 39 (4): 633–635. doi:10.1021 / ja02249a011.
- ^ A b Smith, G. Frederick; Gring, J.L. (1933). „Separace a stanovení alkalických kovů s použitím kyseliny chloristé. V. Kyselina chloristá a kyselina chloroplatičitá při stanovení malého množství draslíku v přítomnosti velkého množství sodíku“. J. Am. Chem. Soc. 55 (10): 3957–3961. doi:10.1021 / ja01337a007.
- ^ Cotton, S.A. (1997). Chemie drahých kovů. London: Chapman and Hall. ISBN 0-7514-0413-6.
- ^ Speier, J.L .; Webster, J. A .; Barnes, G. H. (1957). „Přidání hydridů křemíku k olefinickým dvojným vazbám. Část II. Použití kovových katalyzátorů skupiny VIII“. J. Am. Chem. Soc. 79 (4): 974–979. doi:10.1021 / ja01561a054.
- ^ Saam, John C .; Speier, John L. (1958). „Přidání hydridů křemíku k olefinickým dvojným vazbám. Část III. Přidání ne-terminálních olefinů v přítomnosti kyseliny chloroplatinové“. J. Am. Chem. Soc. 80 (15): 4104–4106. doi:10.1021 / ja01548a073.
- ^ Sibi, Mukund P. (2001). "Hexachloroplatinát vodíku (IV)". Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyklopedie činidel pro organickou syntézu. John Wiley & Sons. doi:10.1002 / 047084289X.rh038. ISBN 0471936235.
- ^ Lewis, L. N .; Sy, K. G .; Bryant, G. L .; Donahue, P. E. (1991). „Hydrosilylace alkynů katalyzovaná platinou“. Organometallics. 10 (10): 3750–3759. doi:10.1021 / om00056a055.
- ^ Moravek, R. T .; Kauffman, G. B .; Mahmood, T. (1967). "Nitrosyl Hexachloroplatinate (IV)". Anorganické syntézy. 9: 217–220. doi:10.1002 / 9780470132555.ch63. ISBN 9780470132555.

