Sulfid boritý - Boron sulfide - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC Sulfid boritý | |
| Ostatní jména Sesquisulfid boritý, trisulfid diboron | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.031.355 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| B2S3 | |
| Molární hmotnost | 117,80 g / mol |
| Vzhled | bezbarvé krystaly |
| Hustota | 1,55 g / cm3, pevný |
| Bod tání | 563 ° C (1045 ° F; 836 K) |
| Bod varu | se rozkládá při vysoké T |
| rozkládá se | |
| Rozpustnost | rozpustný v amoniak |
| Struktura | |
| monoklinický, mP40, SpaceGroup = P21/ c, č. 14 | |
| B: planární, sp2 | |
| Termochemie | |
Tepelná kapacita (C) | 111,7 J / mol K. |
Std molární entropie (S | 327 J / mol K. |
Std entalpie of formace (ΔFH⦵298) | -240,6 kJ / mol |
| Nebezpečí | |
| Hlavní nebezpečí | zdroj H.2S |
| Související sloučeniny | |
Související sloučeniny | BCl3 Lawessonovo činidlo |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Sulfid boritý je chemická sloučenina s vzorec B2S3. Tento polymerní materiál, který byl zajímavý jako součást „high-tech“ skel a jako činidlo pro přípravu organosírových sloučenin. Stejně jako sulfidy křemíku a fosforu, B2S3 reaguje s vodou, včetně atmosférické vlhkosti, aby se uvolnil H2S. Se vzorky tedy musí být zacházeno za bezvodých podmínek.
Stejně jako oxidy boru, B2S3 snadno se tvoří brýle ve směsi s jinými sulfidy, jako je P4S10. Taková skla pohlcují nižší frekvence Infračervený energie ve srovnání s konvenční borosilikát brýle.
B2S3 převádí ketony do odpovídající thionové. Například převod benzofenon k jeho thione postupuje následovně:
- B
2S
3 + 3 (C
6H
5)
2C = O → B
2Ó
3 + 3 (C
6H
5)
2C = S
V praxi B2S3 bude použit nadměrně.[1]
Syntéza
Mezi další způsoby lze diboron trisulfid získat reakcí železa nebo manganu boride s sirovodík při teplotách 300 ° C.[2]
- 2 FeB + 4 H2S → B2S3 + FeS + 4 H2
První syntéza byla provedena Jöns Jakob Berzelius v roce 1824 přímou amorfní reakcí bór s síra pára.[3]
- 2 B + 3 S → B2S3
Další syntéza byla zvýhodněna Friedrich Wöhler a Henri Etienne Sainte-Claire Deville poprvé publikováno v roce 1858, počínaje bórem a bórem sirovodík.[4][5]
- 2 B + 3 H2S → B2S3 + 3 H2
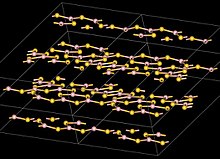
Struktura
Atomy boru v B2S3 jsou trigonální rovinné a jsou uspořádány v B3S3 a B2S2 kruhy s přemosťujícími atomy S tvořící vrstevnatou strukturu se vzdáleností mezivrstvy 355 pm. To se liší od oxid boritý který má trojrozměrnou strukturu.[6]
Molekulární, monomerní forma B2S3 má rovinný tvar V se středním úhlem B-S-B přibližně 120 °.[6]
Reference
- ^ Sato, R. (2004). „Trisulfid boru“. V L. Paquette (ed.). Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyklopedie činidel pro organickou syntézu. New York: J. Wiley & Sons. doi:10.1002 / 047084289X.rb255. ISBN 0471936235.
- ^ Hoffmann, J. (1908). „Synthese von Borsulfid aus Ferro- und Manganbor“. Zeitschrift für anorganische Chemie. 59 (1): 127–135. doi:10.1002 / zaac.19080590116.
- ^ Berzelius, J. (1824). „Undersökning af flusspatssyran och dess märkvärdigaste föreningar“ Výzkum kyseliny fluorovodíkové a jejích nejvýznamnějších sloučenin. Kongliga Vetenskaps-Academiens Handlingar [Sborník Královské akademie věd]. 12: 46–98.
Přetištěno v němčině jako:
Berzelius, J. J. (1824). „Untersuchungen über die Flußspathsäure und deren merkwürdigsten Verbindungen“. Annalen der Physik und Chemie. 78 (10): 113–150. doi:10.1002 / andp.18240781002. viz zejména strany 145–147. - ^ Wöhler, F.; Deville, H. E. S.-C. (1858). „Neue Beobachtungen über das Bor und einige seiner Verbindungen“ [Nová pozorování týkající se boru a některých jeho sloučenin]. Liebigs Annalen der Chemie und Pharmacie. 105 (1): 67–73. doi:10,1002 / jlac.18581050109.
- ^ Wöhler, F.; Deville, H. E. S.-C. (1858). „Du Bore“. Annales de Chimie et de Physique. 52: 62–93.
- ^ A b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
