Kyselina chlorovodíková - Chlorous acid
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Kyselina chlorovodíková | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
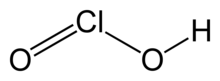
| HClÓ2 | |
| Molární hmotnost | 68,46 g / mol |
| Kyselost (strK.A) | 1.96 |
| Konjugovaná základna | Chloritany |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyselina chlorovodíková je anorganická sloučenina se vzorcem HClO2. Je to slabá kyselina. Chlór má oxidační stav +3 v této kyselině. Čistá látka je nestabilní, nepřiměřené na kyselina chlorná (Cl oxidační stav +1) a kyselina chlorovodíková (Cl oxidační stav +5):
- 2 HClO2 → HClO + HClO3
I když je obtížné získat kyselinu v čisté látce, konjugovaná báze, chloritan odvozený od této kyseliny je stabilní. Jedním příkladem soli tohoto aniontu je dobře známý chloritan sodný. Tato a související soli se někdy používají při výrobě chlordioxid.
Příprava
HClO2 lze připravit reakcí s barnatem nebo chloritanem olovnatým a zředit kyselina sírová:
- Ba (ClO2)2 + H2TAK4 → BaSO4 + 2 HClO2
- Pb (ClO2)2 + H2TAK4 → PbSO4 + 2 HClO2
Stabilita
Kyselina chlorovodíková je silné oxidační činidlo, i když její sklon k disproporcionaci působí proti jejímu oxidačnímu potenciálu.
Chlór je jediný halogen za vzniku izolovatelné kyseliny vzorce HXO2.[1] Ani kyselina bromitá ani kyselina jodičná kdy byla izolována. Několik solí kyselina bromitá, bromitany, jsou známé, ale ne jodity.[1]
Reference
![]() Média související s Kyselina chlorovodíková na Wikimedia Commons
Média související s Kyselina chlorovodíková na Wikimedia Commons
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
