Kyselina fosforečná - Phosphorous acid
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC kyselina fosfonová | |||
| Ostatní jména Dihydroxyfosfin oxid Dihydroxy (oxo) -λ5-fosfan | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.033.682 | ||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| H3PO3 | |||
| Molární hmotnost | 81,99 g / mol | ||
| Vzhled | bílá pevná látka rozmělněný | ||
| Hustota | 1,651 g / cm3 (21 ° C) | ||
| Bod tání | 73,6 ° C (164,5 ° F; 346,8 K) | ||
| Bod varu | 200 ° C (392 ° F; 473 K) (rozkládá se) | ||
| 310 g / 100 ml | |||
| Rozpustnost | rozpustný v ethanol | ||
| Kyselost (strK.A) | 1.1, 6.7 | ||
| −42.5·10−6 cm3/ mol | |||
| Struktura | |||
| pseudotetraedrální | |||
| Nebezpečí | |||
| Hlavní nebezpečí | dráždí pokožku | ||
| Bezpečnostní list | http://www.sigmaaldrich.com/MSDS/[1] | ||
| R-věty (zastaralý) | 22-35 | ||
| S-věty (zastaralý) | 26-36/37/39-45 | ||
| NFPA 704 (ohnivý diamant) | |||
| Související sloučeniny | |||
Související sloučeniny | H3PO4 (tj. PO (OH)3) H3PO2 (tj. H2PO (OH)) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina fosforečná je sloučenina popsal vzorec H3PO3. Tento kyselina je diprotický (snadno ionizuje dva protony), ne triprotický jak by mohl naznačovat tento vzorec. Kyselina fosforečná je meziproduktem při přípravě dalších sloučenin fosforu. Organické deriváty kyseliny fosforečné, sloučeniny vzorce RPO3H2, jsou nazývány fosfonové kyseliny.
Nomenklatura a tautomerismus
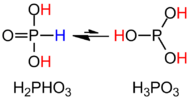
H3PO3 je jasněji popsán strukturním vzorcem HPO (OH)2. V pevném stavu, HP (O) (OH)2 je čtyřboká s vazbou P – H 13,32 hodin, jednou kratší vazbou P = O 148odpoledne a dvě delší vazby P – O (H) o 154 hod. Tento druh existuje v rovnováze s extrémně malou tautomer P (OH)3. IUPAC doporučuje, aby se tato kyselina nazývala kyselina fosforitá, zatímco dihydroxyforma se nazývá kyselina fosfonová.[2] Pouze sloučeniny se sníženým obsahem fosforu jsou hláskovány s koncovkou „ous“.
Další důležité oxykyseliny z fosfor jsou kyselina fosforečná (H3PO4) a kyselina fosforná (H3PO2). Snížené kyseliny fosforové podléhají podobné tautomerii zahrnující posuny H mezi O a P.
Příprava
HPO (OH)2 je produktem hydrolýzy jeho anhydrid kyseliny:
- P4Ó6 + 6 hodin2O → 4 HPO (OH)2
(Analogický vztah spojuje H3PO4 a P4Ó10).
V průmyslovém měřítku se kyselina připravuje hydrolýza z chlorid fosforitý vodou nebo párou:[3]
- PCl3 + 3 H2O → HPO (OH)2 + 3 HCl
Reakce
Acidobazické vlastnosti
Kyselina fosforitá má pK.A v rozsahu 1.26–1.3.[4][5]
- HP (O) (OH)2 → HP (O)2(ACH)− + H+ strK.A = 1.3
Je to kyselina diprotová, hydrogenfosforitanový ion, HP (O)2(ACH)− je slabá kyselina:
- HP (O)2(ACH)− → HPO2−
3 + H+ strK.A = 6.7
Konjugovaná báze HP (O)2(ACH)− se nazývá hydrogenfosforitan a druhá konjugovaná báze, HPO2−
3, je fosfit ion.[6] (Všimněte si, že Doporučení IUPAC jsou hydrogenfosfonát a fosfonát).
Atom vodíku navázaný přímo na atom fosforu není snadno ionizovatelný. Chemické zkoušky často testují, jak si studenti uvědomují, že to ne všechny tři atomy vodíku jsou kyselé za vodných podmínek, na rozdíl od H3PO4.
Redoxní vlastnosti
Při zahřívání na 200 ° C se kyselina fosforitá neúměrně zvyšuje na kyselina fosforečná a fosfin:[7]
- 4 H3PO3 → 3 H3PO4 + PH3
Tato reakce se používá pro laboratorní přípravu PH3.
Kyselina fosforečná pomalu oxiduje na vzduchu na kyselinu fosforečnou.[3]
Kyselina fosforitá i její deprotonované formy jsou dobré redukční činidla, i když ne nutně rychle reagovat. Jsou oxidovány na kyselina fosforečná nebo jeho soli. Snižuje roztoky kationů ušlechtilých kovů na kovy. Když se na kyselinu fosforečnou působí studeným roztokem chlorid rtuťnatý se tvoří bílá sraženina chloridu rtuťnatého:
- H3PO3 + 2 HgCl2 + H2O → Hg2Cl2 + H3PO4 + 2 HCl
Chlorid rtuťnatý se dále redukuje kyselinou fosforitou na rtuť při vytápění nebo při stání:
- H3PO3 + Hg2Cl2 + H2O → 2 Hg + H3PO4 + 2 HCl
Jako ligand
Po zpracování kovy konfigurace d6 je známo, že kyselina fosforitá se koordinuje jako jinak vzácný P (OH)3 tautomer. Mezi příklady patří Mo (CO)5(P (OH)3) a [Ru (NH3)4(H2O) (P (OH)3)]2+.[8][9]

Použití
Nejdůležitějším použitím kyseliny fosforečné (kyselina fosfonová) je výroba základní olovnatý fosfit, což je stabilizátor v PVC a příbuzné chlorované polymery.[3]
Používá se při výrobě základního stabilizátoru fosforečnanu olovnatého z PVC, kyseliny aminomethylenfosfonové a kyseliny hydroxyethan difosfonové. Používá se také jako silné redukční činidlo a při výrobě kyseliny fosforité, syntetických vláken, pesticidů organických fosforů a vysoce účinné úpravy vody činidlo ATMP.
Železný materiály, včetně oceli, lze poněkud chránit podporou oxidace („rzi“) a následným převedením oxidace na metalofosfát pomocí kyselina fosforečná a dále chráněna povrchovou úpravou. (Vidět: Pasivace (chemie) ).
Organické deriváty
The IUPAC (většinou organické) Jmenuje se kyselina fosfonová. Tato nomenklatura je běžně vyhrazena pro nahrazeno deriváty, to znamená organická skupina vázaná na fosfor, nejen ester. Například (CH3) PO (OH)2 je „kyselina methylfosfonová", která samozřejmě může tvořit „methyl."fosfonát " estery.
Reference
- ^ „BL - 215112“. www.sigmaaldrich.com. Citováno 12. dubna 2018.
- ^ Mezinárodní unie pro čistou a aplikovanou chemii (2005). Nomenklatura anorganické chemie (Doporučení IUPAC 2005). Cambridge (Velká Británie): RSC –IUPAC. ISBN 0-85404-438-8. Elektronická verze..
- ^ A b C Bettermann, Gerhard; Krause, Werner; Riess, Gerhard; Hofmann, Thomas (2000). "Sloučeniny fosforu, anorganické". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a19_527..
- ^ Larson, John W .; Pippin, Margaret (1989). „Termodynamika ionizace kyselin fosforných a fosforitých. Substituční účinky na kyslík druhé řady“. Mnohostěn. 8 (4): 527–530. doi:10.1016 / S0277-5387 (00) 80751-2.
- ^ CRC Handbook of Chemistry and Physics (87. vydání). p. 8–42.
- ^ Novosad, Josef (1994). Encyclopedia of Anorganic Chemistry. John Wiley and Sons. ISBN 0-471-93620-0.
- ^ Gokhale, S. D .; Jolly, W. L. (1967). "Fosfin". Anorganické syntézy. 9: 56–58. doi:10.1002 / 9780470132401.ch17.
- ^ Sernaglia, R.L .; Franco, D. W. (2005). „Centrum ruthenia (II) a tautomerní rovnováha fosfit-fosfonátu“. Inorg. Chem. 28 (18): 3485–3489. doi:10.1021 / ic00317a018.CS1 maint: používá parametr autoři (odkaz)
- ^ Xi, Chanjuan; Liu, Yuzhou; Lai, Chunbo; Zhou, Lishan (2004). „Syntéza komplexu molybdenu s novým P (OH)3 ligand založený na reakci Mo (CO) v jedné nádobě6 s HP (O) (OEt)2 a voda “. Komunikace anorganické chemie. 7 (11): 1202. doi:10.1016 / j.inoche.2004.09.012.
- ^ Xi, Chanjuan; Liu, Yuzhou; Lai, Chunbo; Zhou, Lishan (2004). „Syntéza komplexu molybdenu s novým P (OH)3 Ligand založený na reakci One-Pot Mo (CO)6 s HP (O) (OEt)2 a voda “. Komunikace anorganické chemie. 7 (11): 1202–1204. doi:10.1016 / j.inoche.2004.09.012.
Další čtení
- Holleman, A. F .; Wiberg, E. (2001). Anorganická chemie. San Diego: Academic Press. ISBN 0-12-352651-5.
- Corbridge., D. E. C. (1995). Fosfor: Nástin jeho chemie, biochemie a technologie (5. vydání). Amsterdam: Elsevier. ISBN 0-444-89307-5.
- Lee, J.D. (3. ledna 2008). Stručná anorganická chemie. Oxford University Press. ISBN 978-81-265-1554-7.



