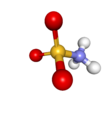
Kyselina sulfamová - Sulfamic acid
 | |||
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Kyselina sulfamová | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.023.835 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 2967 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| H3NSO3 | |||
| Molární hmotnost | 97,10 g / mol | ||
| Vzhled | bílé krystaly | ||
| Hustota | 2,15 g / cm3 | ||
| Bod tání | 205 ° C (401 ° F; 478 K) se rozkládá | ||
| Mírné, s pomalou hydrolýzou | |||
| Rozpustnost | |||
| Kyselost (strK.A) | 1.0[1] | ||
| Nebezpečí | |||
| Bezpečnostní list | ICSC 0328 | ||
Klasifikace EU (DSD) (zastaralý) | Dráždivý (Xi) | ||
| R-věty (zastaralý) | R36 / 38 R52 / 53 | ||
| S-věty (zastaralý) | (S2) S26 S28 S61 | ||
| Související sloučeniny | |||
jiný kationty | Síran amonný | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina sulfamová, také známý jako kyselina amidosulfonová, kyselina amidosírová, kyselina aminosulfonová, a kyselina sulfamidová, je molekulární sloučenina vzorce H3NSO3. Tato bezbarvá, ve vodě rozpustná sloučenina nachází mnoho aplikací. Kyselina sulfamová se taví při 205 ° C a poté se při vyšších teplotách rozloží na voda, oxid sírový, oxid siřičitý a dusík.[2]
Kyselina sulfamová (H3NSO3) lze považovat za meziprodukt mezi kyselina sírová (H2TAK4), a sulfamid (H4N2TAK2), účinně nahrazující a hydroxyl (–OH) skupina s amin (–NH2) skupina v každém kroku. Tento vzor se nemůže dále rozšiřovat v obou směrech, aniž by se rozbil sulfonyl (-TAK2-) skupina. Sulfamáty jsou deriváty kyseliny sulfamové.
Výroba
Kyselina sulfamová se průmyslově vyrábí zpracováním močovina se směsí oxid sírový a kyselina sírová (nebo oleum ). Převod se provádí ve dvou fázích:
- OC (NH2)2 + SO3 → OC (NH2) (NHSO3H)
- OC (NH2) (NHSO3H) + H2TAK4 → CO2 + 2 H3NSO3
Tímto způsobem bylo v roce 1995 vyrobeno přibližně 96 000 tun.[3]
Struktura a reaktivita
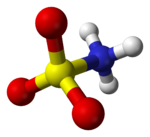
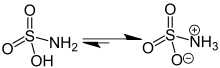
Sloučenina je dobře popsána vzorcem H3NSO3, ne tautomer H2NSO2(ACH). Příslušné vzdálenosti dluhopisů jsou 1,44A pro S = O a 1,77 Å pro S – N. Větší délka S – N odpovídá jediné vazbě.[5] Dále, a neutronová difrakce Studie lokalizovala atomy vodíku, z nichž všechny tři jsou 1,03A vzdálený od dusíku.[4] V pevném stavu je molekula kyseliny sulfamové dobře popsána a zwitterionický formulář.
Vodné roztoky kyseliny sulfamové jsou nestabilní a pomalu se hydrolyzují na hydrogensíran amonný, ale krystalická pevná látka je za běžných skladovacích podmínek neomezeně stabilní. Jeho chování se podobá chování močovina, (H2N)2CO. Obě funkce aminoskupiny spojené s centry pro výběr elektronů, které se mohou účastnit delokalizované lepení. Oba osvobozují amoniak při ohřevu ve vodě; kyselina sulfamová se však vrátí zpět na kyselina sírová , místo CO2 že by se močovina uvolnila podle následující reakce:
- H3NSO3 + H2O → H2TAK4 + NH3
Acidobazické reakce
Kyselina sulfamová je mírně silná kyselina, K.A = 0,101 (strK.A = 0,995). Protože pevná látka není hygroskopický, je používán jako standard v acidimetrie (kvantitativní stanovení obsahu kyselin).
- H3NSO3 + NaOH → NaH2NSO3 + H2Ó
Dvojitá deprotonace může být provedena v amoniak řešení pro získání aniontu HNSO2−
3.[6]
- H3NSO3 + 2 NH3 → HNSO2−
3 + 2 NH+
4
Reakce s kyselinami dusičnými a dusitými
S kyselina dusitá, kyselina sulfamová reaguje za vzniku dusík:
- HNO2 + H3NSO3 → H2TAK4 + N2 + H2Ó
zatímco s kyselina dusičná, to dovoluje oxid dusičitý:[7]
- HNO3 + H3NSO3 → H2TAK4 + N2O + H2Ó
Reakce s chlornanem
Reakce přebytku chlornan ionty s kyselinou sulfamovou nebo sulfamátovou solí způsobují reverzibilní vznik obou N-chlorsulfamát a N,N-dichlorsulfamátové ionty.[8][9][10]
- HClO + H2NSO3H → ClNHSO3H + H2Ó
- HClO + ClNHSO3H ⇌ Cl2NSO3H + H2Ó
V důsledku toho se kyselina sulfamová používá jako chlornan mrchožrout při oxidaci aldehydy s chloritan tak jako Pinnickova oxidace.
Reakce s alkoholem
Po zahřátí bude kyselina sulfamová reagovat s alkoholy za vzniku odpovídajícího organosírany. Je to dražší než jiné reagencie, například kyselina chlorsulfonová nebo oleum, ale je také výrazně mírnější a nebude sulfonovat aromatické kruhy. Výrobky jsou vyráběny jako jejich amonný soli. Takové reakce mohou být katalyzovány přítomností močovina.[10]
- ROH + H2NSO3H → ROS (O)2Ó− + NH+
4
Bez přítomnosti jakýchkoli katalyzátorů nebude kyselina sulfamová reagovat s ethanolem při teplotách pod 100 ° C.
Aplikace
Kyselina sulfamová je hlavně předchůdcem sloučenin sladké chuti. Reakce s cyklohexylamin následuje přidání NaOH dává C.6H11NHSO3Na, cyklamát sodný. Příbuzné sloučeniny jsou také sladidla, jako acesulfam draselný.
Sulfamáty se používají při konstrukci mnoha typů terapeutických látek, jako jsou antibiotika, nukleosid / nukleotid virus lidské imunodeficience (HIV) inhibitory reverzní transkriptázy, Inhibitory HIV proteázy (PI), protinádorové léky (steroidní sulfatáza a uhličitá anhydráza inhibitory), antiepileptický drogy a léky na hubnutí.[11]
Čisticí prostředek
Kyselina sulfamová se používá jako kyselá čisticí prostředek, někdy čisté nebo jako součást patentovaných směsí, obvykle pro kovy a keramika. Často se používá k odstraňování rez a vodní kámen, nahrazující těkavější a dráždivější kyselina chlorovodíková, což je levnější. Často je součástí domácnosti odvápňovací prostředky například Lime-A-Way Thick Gel obsahuje až 8% kyseliny sulfamové a má pH 2,0–2,2,[12] nebo čistící prostředky slouží k odstranění vodní kámen. Ve srovnání s většinou běžných silných minerálních kyselin má kyselina sulfamová žádoucí vlastnosti pro odstraňování vodního kamene, nízkou těkavost a nízkou toxicitu. Tvoří ve vodě rozpustné soli vápníku a železitého železa.
Kyselina sulfamová je výhodnější než kyselina chlorovodíková pro použití v domácnosti, kvůli své vnitřní bezpečnosti. Pokud je omylem smíchán s produkty na bázi chlornanu, jako je bělidlo, netvoří se chlór plyn, zatímco nejběžnější kyseliny by; reakce (neutralizace ) s amoniak, produkuje sůl, jak je znázorněno v části výše.
Rovněž nachází uplatnění v průmyslovém čištění mléčných a varných zařízení. I když je považován za méně korozivní než kyselina chlorovodíková, inhibitory koroze se často přidávají do komerčních čisticích prostředků, jejichž je součástí. Lze jej použít k odvápnění domácí kávovary a kávovary na espresso a do čističů zubních protéz.
Jiná použití
- Katalyzátor pro esterifikace proces
- Barvivo a pigment výrobní
- Herbicid
- Koagulátor pro močovino-formaldehydové pryskyřice
- Složka v hasicí média. Kyselina sulfamová je hlavní surovinou pro síran amonný což je široce používaný herbicid a materiál zpomalující hoření pro výrobky pro domácnost.
- Průmysl papíru a celulózy jako stabilizátor chloridů
- Syntéza oxid dusičitý reakcí s kyselinou dusičnou
- Deprotonovaná forma (sulfamát) je běžným protiiontem pro nikl (II) v galvanické pokovování.
- Používá se k oddělení dusitanových iontů ze směsi dusitanových a dusičnanových iontů (NO3−+ NE2−) při kvalitativní analýze dusičnanů testem Brown Ring.
Leštění stříbrem
Podle štítku na spotřebním výrobku obsahuje tekutý stříbrný čisticí přípravek TarnX thiomočovina, a čisticí prostředek a kyselina sulfamová.
Reference
- ^ Candlin, J. P .; Wilkins, R. G. (1960). "828. Sloučeniny síry a dusíku. Část I. Hydrolýza sulfamátového iontu v kyselině chloristé". Journal of the Chemical Society (obnoveno): 4236–4241. doi:10.1039 / JR9600004236.
- ^ Yoshikubo, K .; Suzuki, M. (2000). "Kyselina sulfamová a sulfamáty". Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002 / 0471238961.1921120625151908.a01. ISBN 0471238961.
- ^ Metzger, A. "Kyselina sulfamová". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a25_439.
- ^ A b Sass, R.L. (1960). „Studie neutronové difrakce na krystalové struktuře kyseliny sulfamové“. Acta Crystallographica. 13 (4): 320–324. doi:10.1107 / S0365110X60000789.
- ^ Bats, J. W .; Coppens, P .; Koetzle, T. F. (1977). "Experimentální hustota náboje v molekulách obsahujících síru. Studie deformační elektronové hustoty v kyselině sulfamové při 78 K pomocí rentgenového záření a neutronové difrakce". Acta Crystallographica oddíl B. 33: 37–45. doi:10.1107 / S0567740877002568.
- ^ Clapp, L. B. (1943). "Kyselina sulfamová a její použití". Journal of Chemical Education. 20 (4): 189–346. doi:10.1021 / ed020p189.
- ^ Dzelzkalns, Laila; Bonner, Francis (1978). "Reakce mezi kyselinou dusičnou a sulfamovou ve vodném roztoku". Anorganická chemie. 17 (12): 3710–3711. doi:10.1021 / ic50190a080.
- ^ USA 3328294
- ^ FR 2087248
- ^ A b Benson, G. Anthony; Spillane, William J. (1980). „Kyselina sulfamová a její N-substituované deriváty ". Chemické recenze. 80 (2): 151–186. doi:10.1021 / cr60324a002. ISSN 0009-2665.
- ^ Winum, J. Y .; Scozzafava, A .; Montero, J. L .; Supuran, C. T. (2005). "Sulfamáty a jejich terapeutický potenciál". Recenze lékařského výzkumu. 25 (2): 186–228. doi:10.1002 / med.20021. PMID 15478125.
- ^ Benckiser, Reckitt. "Bezpečnostní list materiálu - vápno, vápník a rez (čisticí sprej)" (PDF). hardwarestore.com. Archivovány od originál (PDF) dne 17. července 2011. Citováno 17. listopadu 2011.
Další čtení
- "Informace o chemickém odběru vzorků - kyselina sulfamová". Správa bezpečnosti a ochrany zdraví při práci. 6. května 1997. Citováno 17. listopadu 2011.
- Cremlyn, R. J. (1996). Úvod do chemie organosíry. Chichester: John Wiley and Sons. ISBN 978-0-471-95512-2.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.