Hexafluorid seleničitý - Selenium hexafluoride
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Hexafluorid seleničitý | |||
| Ostatní jména Fluorid seleničitý, fluorid seleničitý | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.149.506 | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| SeF6 | |||
| Molární hmotnost | 192,9534 g / mol | ||
| Vzhled | bezbarvý plyn | ||
| Hustota | 0,007887 g / cm3[1] | ||
| Bod tání | -39 ° C (-38 ° F; 234 K) | ||
| Bod varu | -34,5 ° C (-30,1 ° F; 238,7 K) sublimuje | ||
| nerozpustný | |||
| Tlak páry | > 1 atm (20 ° C)[2] | ||
| −51.0·10−6 cm3/ mol | |||
Index lomu (nD) | 1.895 | ||
| Struktura | |||
| Ortorombický, oP28 | |||
| Pnma, č. 62 | |||
| osmistěn (Óh) | |||
| 0 | |||
| Termochemie | |||
Std entalpie of formace (ΔFH⦵298) | 1030 kJ / mol[3] | ||
| Nebezpečí | |||
| Hlavní nebezpečí | toxický, žíravý | ||
| NFPA 704 (ohnivý diamant) | |||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LChle (nejnižší publikováno ) | 10 ppm (krysa, 1 hod) 10 ppm (myš, 1 hod) 10 ppm (morče, 1 hod)[4] | ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | PEL 0,05 ppm (0,4 mg / m3)[2] | ||
REL (Doporučeno) | TWA 0,05 ppm[2] | ||
IDLH (Okamžité nebezpečí) | 2 ppm[2] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Hexafluorid seleničitý je anorganická sloučenina s vzorec SeF6. Jedná se o velmi toxický bezbarvý plyn, který má „odpudivý“ zápach.[5] Není příliš rozšířený a nemá žádné komerční aplikace.[6]
Struktura, příprava a reakce
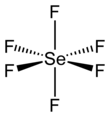
Jako mnoho sloučenin selenu, SeF6 je hypervalentní. Sloučenina má oktaedrická molekulární geometrie s délkou vazby Se-F 168,8 odpoledne.
SeF6 lze připravit z prvků[7] nebo reakcí bromtrifluorid (BrF3) s oxid seleničitý. Surový produkt se čistí sublimací.
Relativní reaktivita hexafluoridů S, Se a Te se řídí pořadí TeF6 > SeF6 > SF6 přičemž druhý je zcela inertní vůči hydrolýze až do vysokých teplot. SeF6 také odolává hydrolýze.[3] Plyn může procházet 10% NaOH nebo KOH beze změny, ale reaguje s plynnými amoniak při 200 ° C.[8]
Bezpečnost
Ačkoli je hexafluorid seleničitý poměrně inertní a pomalu hydrolyzuje, je toxický i při nízkých koncentracích,[9] zejména delší expozicí. Ve Spojených státech., OSHA a ACGIH standardy pro expozici hexafluoridu seleničitému je horní hranice 0,05 ppm ve vzduchu v průměru za osm hodinovou směnu. Dále je hexafluorid seleničitý označen jako IDLH chemická látka s maximálním povoleným limitem expozice 2 ppm.[10]
Reference
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86. vydání). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ A b C d NIOSH Kapesní průvodce chemickými nebezpečími. "#0551". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b Wiberg, E .; Holleman, A. F. (2001). Anorganická chemie. Elsevier. ISBN 0-12-352651-5.
- ^ "Hexafluorid seleničitý". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ "Bezpečnost materiálu" (PDF). Citováno 2010-07-24.
- ^ Langner, B. E. "Selen and Selenium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a23_525.
- ^ Yost, D. M .; Simons, J. H. (1939). „Síra, selen a hexafluoridy teluru“. Anorganické syntézy. 1: 121–122. doi:10.1002 / 9780470132326.ch44.
- ^ Krebs, B .; Bonmann, S .; Eidenschink, I. (1994). "Selen-Anorganic Chemistry". V King, R. B. (ed.). Encyclopedia of Anorganic Chemistry. John Wiley & Sons. ISBN 0-471-93620-0.
- ^ "Pokyny pro lékařskou péči o hexafluorid seleničitý (SeF6)". CDC ATSDR. Citováno 2010-07-24.
- ^ Dokumentace pro bezprostředně nebezpečné pro život nebo koncentraci zdraví (IDLHs)