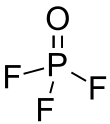
Fosforylfluorid - Phosphoryl fluoride
| |||
| Jména | |||
|---|---|---|---|
| Názvy IUPAC Fosforyltrifluorid Oxid trifluorid fosforečný | |||
| Ostatní jména Oxyfluorid fosforečný Fluorid fosforečný | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.033.419 | ||
| Číslo ES |
| ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| POF3 | |||
| Molární hmotnost | 103,9684 g / mol | ||
| Vzhled | Čirý, bezbarvý plyn | ||
| Bod varu | -39,7 ° C (-39,5 ° F; 233,5 K) | ||
| Reaguje | |||
| Rozpustnost | Reaguje s alkoholem a kyselinou rozpustný v etheru a uhlovodících | ||
| Struktura | |||
| čtyřboká | |||
| D | |||
| Nebezpečí | |||
| Hlavní nebezpečí | Může se tvořit jed, žíravý HF při kontaktu s H2Ó | ||
| Bezpečnostní list | ICSC 0190 | ||
Klasifikace EU (DSD) (zastaralý) | |||
| R-věty (zastaralý) | R14, R34, R36 / 37/38[1] | ||
| S-věty (zastaralý) | (S1 / 2), S7 / 9, S26, S36 / 37/39, S45 | ||
| NFPA 704 (ohnivý diamant) | |||
| Související sloučeniny | |||
Související sloučeniny | Thiofosforylfluorid Fosforylchlorid Oxidbromid fosforečný Fluorid fosforečný Pentafluorid fosforečný | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Fosforylfluorid (běžně se nazývá fosforoxyfluorid) je sloučenina s chemickým vzorcem PÓF3. Je to bezbarvý plyn, který rychle hydrolyzuje.
Syntéza a reakce
Oxyfluorid fosforečný se připravuje částečnou hydrolýzou pentafluoridu fosforečného.
Oxyfluorid fosforečný je předkem jednoduchých kyselin fluorofosforečných hydrolýzou. Sekvence začíná na kyselina difluorfosforečná:
- POF3 + H2O → HPO2F2 + HF
Další kroky dávají kyselina monofluorfosforečná a kyselina fosforečná:
- HPO2F2 + H2O → H2PO3F + HF
- HPO3F + H2O → H3PO4 + HF
Fosforylfluorid se kombinuje s dimethylamin za vzniku dimethylaminofosforyldifluoridu (CH3)2NPOF2 a difluorfosfát a hexafluorfosfát ionty.[2]
Reference
- ^ http://www.chemicalbook.com/ProductChemicalPropertiesCB3329830_EN.htm
- ^ Cavell, R. G. (1968). "Chemie fluoridů fosforu. Část III. Reakce thiofosforylfluoridu s dimethylaminem a některé vlastnosti dimethylaminothiofosforylfluoridů". Canadian Journal of Chemistry. 46 (4): 613. doi:10.1139 / v68-100.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |