Hexafluorid rhodia - Rhodium hexafluoride - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC rhodium (VI) fluorid | |
| Ostatní jména hexafluorid rhodia | |
| Identifikátory | |
3D model (JSmol ) | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| F6Rh | |
| Molární hmotnost | 216,91 g / mol |
| Vzhled | černá krystalická pevná látka[1] |
| Hustota | 3,71 g / ml[2] |
| Bod tání | ≈ 70 ° C (158 ° F; 343 K)[1] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
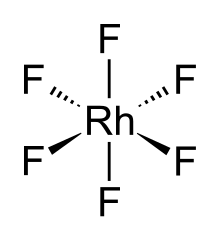
Hexafluorid rhodia, taky rhodium (VI) fluorid, (RhF6) je anorganická sloučenina z rhodium a fluor. Černá těkavá pevná látka,[1] je to vysoce reaktivní materiál a vzácný příklad sloučeniny rhodia (VI). Je to jeden ze sedmnácti známých binárních souborů hexafluorid.
Syntéza, struktura, vlastnosti
Hexafluorid rhodia se připravuje reakcí kovového rhodia s přebytkem elementárního fluor:[3]
- Rh + 3 F.2 → RhF6
RhF6 molekula má oktaedrická molekulární geometrie. V souladu s jeho d3 konfigurace, šest Rh – F délky vazby jsou ekvivalentní, jsou 1,824 Å.[2] Krystalizuje v ortorombický vesmírná skupina Pnma s mřížové parametry z A = 9.323 A, b = 8,474 Å a C = 4 910 Å.
Stejně jako některé jiné fluoridy kovů, RhF6 je vysoce oxidující. Napadá dokonce i sklo bez přítomnosti vody.[3] Může dokonce reagovat s elementy kyslík.[4]
Reference
- ^ A b C CRC Handbook of Chemistry and Physics, 90. vydání, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Oddíl 4, Fyzikální konstanty anorganických sloučenin, str. 4-85.
- ^ A b Drews, T .; Supeł, J .; Hagenbach, A .; Seppelt, K. (2006). "Molekulární struktury pevných látek hexafluoridů přechodných kovů". Anorganická chemie. 45 (9): 3782–3788. doi:10.1021 / ic052029f. PMID 16634614.
- ^ A b 《无机 化学 丛书》 第九卷 : 锰 分 族 、 铁 系 、 铂 系 (v čínštině).北京: 科学 出版社. p. 478. ISBN 7-03-002238-6.
- ^ Riedel, Sebastian; Kaupp, Martin (2009). „Nejvyšší oxidační stavy prvků přechodných kovů“ (PDF). Recenze koordinační chemie. Elsevier. 253: 606–624. doi:10.1016 / j.ccr.2008.07.014.[trvalý mrtvý odkaz ]
Další čtení
- Gmelins Handbuch der anorganischen Chemie, System Nr. 63, Rhodium, část B1, s. 266–268.
