Technetium hexafluorid - Technetium hexafluoride
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| |
| Vlastnosti | |
| TcF6 | |
| Molární hmotnost | 212 g / mol (98Tc) |
| Vzhled | zlatožluté krystaly[1] |
| Hustota | 3,58 g / cm3 (-140 ° C), pevný[2] |
| Bod tání | 37,4 ° C (99,3 ° F; 310,5 K)[1] |
| Bod varu | 55,3 ° C (131,5 ° F; 328,4 K)[1] |
| Struktura | |
| krychlový | |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | nezapsáno |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Technetium hexafluorid nebo technecium (VI) fluorid (TcF6 ) je žlutá anorganická sloučenina s nízkým bod tání. Poprvé byl identifikován v roce 1961.[3] V této sloučenině má technecium oxidační stav +6, nejvyšší oxidační stav nalezený v techneciu halogenidy. Druhou takovou sloučeninou je chlorid technecium (VI), TcCl6. V tomto ohledu se technecium liší od rhenia, které tvoří heptafluorid, Odkaz7.[4] Technetium hexafluorid se vyskytuje jako nečistota v hexafluorid uranu, protože technecium je štěpný produkt z uran.
Příprava
Hexafluorid technecia se připravuje zahříváním kovového technecia s přebytkem F2 při 400 ° C.[3]
- Tc + 3 F
2 → TcF
6
Popis
Techneciumhexafluorid je zlatavě žlutá pevná látka při teplotě místnosti. Jeho teplota tání je 37,4 ° C a teplota varu je 55,3 ° C.[1]
Techneciumhexafluorid podléhá pevné látce fázový přechod při -4,54 ° C. Nad touto teplotou (měřeno při 10 ° C) je pevná struktura krychlový. Příhradové parametry jsou A = 6,16 Å. Existují dva vzorec jednotek (v tomto případě diskrétní molekuly) na jednotková buňka, což dává hustotu 3,02 g · cm−3. Pod touto teplotou (měřeno při -19 ° C) je pevná struktura ortorombický vesmírná skupina Pnma. Příhradové parametry jsou A = 9.55 A, b = 8,74 Á a C = 5,02 Å. Jsou čtyři vzorec jednotek (v tomto případě diskrétní molekuly) na jednotková buňka, což dává hustotu 3,38 g · cm−3. Při -140 ° C je pevná struktura stále ortotomická, ale parametry mřížky jsou nyní A = 9.360 A, b = 8,517 Á a C = 4,934 A, což dává hustotu 3,58 g · cm−3.[2]
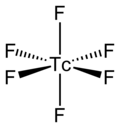
TcF6 samotná molekula (forma důležitá pro kapalnou nebo plynnou fázi) oktaedrická molekulární geometrie, který má bodovou skupinu (Óh ). Tc – F délka vazby je 1,812 Å.[2] Své magnetický moment bylo naměřeno 0,45 μB.[5]
Vlastnosti
Fyzický
TcF6 je osmistěn, jak ukazuje infračervený a Ramanova spektra.[6][7] Je to nízká teplota ortorombický forma převádí na vyšší symetrii centrovaný na tělo se tvoří při teplotě místnosti, jako jiné hexafluoridy kovů, jako je RhF6 a OsF6.[8] Předběžná měření magnetický moment výtěžek hodnotu 0,45 µB, který je nižší, než se očekávalo pro d1 oktaedrická sloučenina.[9]
Chemikálie
TcF6 reaguje s alkalickým chloridy v jod pentafluorid (LI5) roztok za vzniku hexafluorotechnetátů.[10][11] TcF6 nepřiměřené hydrolýza s vodným NaOH za vzniku černé sraženiny TcO2.[3] v fluorovodík řešení, TcF6 reaguje s hydrazinium fluorid výtěžek N2H6TcF6 nebo N2H6(TcF6)2.[12]
Reference
- ^ A b C d CRC Handbook of Chemistry and Physics, 90. vydání, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Oddíl 4, Fyzikální konstanty anorganických sloučenin, str. 4-93.
- ^ A b C Drews, T .; Supeł, J .; Hagenbach, A .; Seppelt, K. (2006). "Molekulární struktury pevných látek hexafluoridů přechodných kovů". Anorganická chemie. 45 (9): 3782–3788. doi:10.1021 / ic052029f. PMID 16634614.
- ^ A b C Selig, H .; Chernick, C.L .; Malm, J.G. (1961). "Příprava a vlastnosti TcF6". Journal of Anorganic and Nuclear Chemistry. 19 (3–4): 377–381. doi:10.1016/0022-1902(61)80132-2.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Selig, H .; Cafasso, F. A .; Gruen, D. M.; Malm, J. G. (1962). „Magnetická citlivost ReF6". Journal of Chemical Physics. 36 (12): 3440. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- ^ Howard H. Claassen; Henry Selig a John G. Malm (1962). "Vibrační spektrum MF6 a TcF6". Journal of Chemical Physics. 36 (11): 2888–2890. Bibcode:1962JChPh..36.2888C. doi:10.1063/1.1732396.
- ^ Howard H. Claassen; Gordon L. Goodman; John H. Holloway a Henry Selig (1970). „Ramanovo spektrum MF6, TcF6, ReF6, UF6, SF6, SeF6a TeF6 ve stavu páry “. Journal of Chemical Physics. 53 (1): 341–348. Bibcode:1970JChPh..53..341C. doi:10.1063/1.1673786.
- ^ Siegel S, Northrop DA (1966). „Rentgenové difrakční studie některých hexafluoridů přechodných kovů“. Anorganická chemie. 5 (12): 2187–2188. doi:10.1021 / ic50046a025.
- ^ Selig, H; Cafasso, F .; Gruen, DM; Malm, J. G. (1962). „Magnetická citlivost ReF6". Journal of Chemical Physics. 36 (12): 3440–3444. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- ^ Edwards, A. J .; Hugill, D .; Peacock, R. D. (1963). "Nové fluorované sloučeniny technecia". Příroda. 200 (4907): 672. Bibcode:1963 Natur.200..672E. doi:10.1038 / 200672a0. S2CID 4259399.
- ^ D. Hugill a R. D. Peacock (1966). "Některé kvadvalentní fluorotechnetáty". Journal of the Chemical Society A: 1339–1341. doi:10.1039 / J19660001339.
- ^ Frlec B; Selig H & Hyman H.H (1967). „Hydrazinium (+2) hexafluorometalates (IV) and - (V) in the 4d and 5d Transition Series“. Anorganická chemie. 6 (10): 1775–1783. doi:10.1021 / ic50056a004.
