Titan diselenid - Titanium diselenide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC bis (selanyliden) titan | |
| Ostatní jména selenid titanu, diselenid titanu | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.031.876 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| TiSe2 | |
| Molární hmotnost | 205.787 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Titan diselenid (TiSe2) známý také jako selenid titaničitý, je an anorganická sloučenina z titan a selen. V tomto materiálu je selen považován za selenid (Se2−), který vyžaduje, aby titan existoval jako Ti4+. Titan diselenid je členem kovové dichalkogenidy, sloučeniny, které se skládají z kovu a prvku z chalkogen sloupec v periodické tabulce. Mnoho vykazuje vlastnosti potenciální hodnoty v bateriové technologii, jako např interkalace a elektrická vodivost, ačkoli většina aplikací se zaměřuje na méně toxické a lehčí disulfidy, např. TiS2.
Struktura
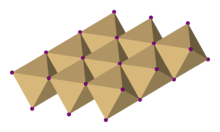
V systému titan-selen bylo identifikováno mnoho stechiometrií. Titan diselenid krystalizuje s CdI2 -typová struktura, ve které jsou oktaedrické otvory mezi střídavou šestihrannou těsně zabalenou vrstvou Se2− vrstvy (to je polovina z celkového počtu oktaedrických děr) jsou obsazeny Ti4+ centra. CdI2 struktura se často označuje jako struktura vrstvy, protože opakující se vrstvy atomů kolmé k těsně zabalené vrstvě tvoří sekvenci Se-Ti-Se…Se-Ti-Se…Se-Ti-Se se slabým van der Waalsovy interakce mezi atomy selenu v sousedních vrstvách. Struktura má (6,3) -koordinaci, je oktaedrická pro kation a trigonální pyramidová pro anionty. Typ struktury se běžně vyskytuje u mnoha přechodových kovů halogenidy také.[1] Je známo, že tato vrstvená struktura prochází interkalace alkalickými kovy (M), což vede k tvorbě MXTiSe2 (x ≤ 1), čímž se rozšíří slabé van der Waalsovy mezery mezi 2D vrstvami.[2]
Syntéza
Směs titanu a selenu se zahřívá pod argon atmosféra k produkci surových vzorků. Surový produkt se obvykle čistí pomocí transport chemických par pomocí jodu jako transportního agenta.[3]
- Ti + 2 Se → TiSe2
Reference
- ^ Riekel, C (1976). "Zdokonalení struktury TiSe2 Neutronovou difrakcí ". Journal of Solid State Chemistry. 17 (4): 389–92. Bibcode:1976JSSCh..17..389R. doi:10.1016 / S0022-4596 (76) 80008-4.
- ^ Bouroushian, M. „Elektrochemie kovových chalkogenidů“ ISBN 978-3-642-03967-6
- ^ Hagenmuller, P. "Preparativní metody v chemii pevných látek" ISBN 978-0-323-14436-0
