Selenid sodný - Sodium selenide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC selenid sodný | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| Informační karta ECHA | 100.013.830 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Na2Se | |
| Molární hmotnost | 124.951 g · mol−1 |
| Hustota | 2,62 g cm−3[1] |
| Bod tání | > 875 ° C [1] |
| reaguje s vodou | |
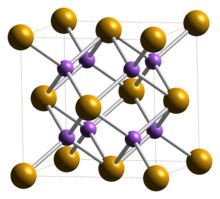
| Struktura[2] | |
| Krychlový (fluorit ), cF12 | |
| Fm3m, č. 225 | |
A = 0,6825 nm | |
Jednotky vzorce (Z) | 4 |
| Související sloučeniny | |
jiný anionty | Sulfid sodný Tellurid sodný Oxid sodný |
jiný kationty | Selenid vodíku Selenid antimonitý Selenid hlinitý |
Související sloučeniny | Seleničitan sodný Selenát sodný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Selenid sodný je anorganická sloučenina z sodík a selen s chemický vzorec Na2Se.
Příprava
Tato bezbarvá pevná látka se připraví reakcí selenu s roztokem sodíku v kapalném amoniaku při teplotě -40 ° C.[3] Alternativně lze selenid sodný připravit reakcí plynných látek selenid vodíku s kovovým sodíkem při 100 ° C.
Reakce
Stejně jako ostatní alkalické kovy chalkogenidy Tento materiál je vysoce citlivý na vodu a snadno podléhá hydrolýze za vzniku směsí biselenid sodný (NaSeH) a hydroxid. K této hydrolýze dochází z důvodu extrémní bazicity Se2− ion.
- Na2Se + H2O → NaHSe + NaOH
Podobně se selenid sodný snadno oxiduje na polyselenidy, převod signalizovaný špinavě bílými vzorky.
Selenid sodný reaguje s kyseliny produkovat toxické selenid vodíku plyn.
- Na2Se + 2 HCl → H2Se + 2 NaCl
Sloučenina reaguje s elektrofily za vzniku sloučenin selenu. S alkylhalogenidy se získá řada organoseleniové sloučeniny:
- Na2Se + 2 RBr → R2Se + 2 NaBr
Organotin a organokřemík halogenidy reagují podobně, aby poskytly očekávané deriváty:
- Na2Se + 2 Me3XCl → (Me3X)2Se + 2 NaCl (X ∈ Si, Ge, Sn)
Reference
- ^ A b Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97. vydání). CRC Press. p. 4,87. ISBN 9781498754293.
- ^ Bonneau, Philippe R .; Jarvis, Robert F .; Kaner, Richard B. (1992). „Solid-state metathesis as a quick way to transition-metal mixed dichalcogenides“. Anorganická chemie. 31 (11): 2127–2132. doi:10.1021 / ic00037a027.
- ^ Brauer, G. ed. (1963) Příručka preparativní anorganické chemie, 2. vyd., Academic Press, NY., Sv. 1. str. 421.
| Tento anorganické sloučenina –Příbuzný článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
