Jodový heptafluorid - Iodine heptafluoride
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Ostatní jména Jod (VII) fluorid Heptafluoroiodine | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.037.241 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| LI7 | |||
| Molární hmotnost | 259,90 g / mol | ||
| Vzhled | bezbarvý plyn | ||
| Hustota | 2,6 g / cm3 (6 ° C) 2,7 g / cm3 (25 ° C) | ||
| Bod tání | 4,5 ° C (40,1 ° F; 277,6 K) (trojitý bod) | ||
| Bod varu | 4,8 ° C (40,6 ° F; 277,9 K) (sublimuje při 1 atm) | ||
| rozpustný [1] | |||
| Související sloučeniny | |||
Související sloučeniny | jodpentafluorid | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
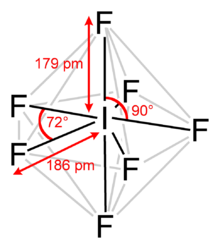
Jodový heptafluorid, také známý jako jod (VII) fluorid nebo jodfluorid, je interhalogenová sloučenina s chemickým vzorcem JáF7.[2][3] Má to neobvyklé pětiboká bipyramidová struktura, jak předpovídá Teorie VSEPR.[4] Molekula může podstoupit a pseudorotační přeskupení zvané Mechanismus Bartell, který je jako Berry mechanismus ale pro heptacoordinovaný systém.[5]Vytváří bezbarvé krystaly, které tají při 4,5 ° C: rozmezí kapalin je extrémně úzké, s bodem varu při 4,77 ° C. Hustá pára má plesnivý štiplavý zápach. Molekula má D5h symetrie.
Příprava
LI7 je připraven předáním F2 kapalinou LI5 při 90 ° C, potom zahřívání par na 270 ° C. Alternativně lze tuto sloučeninu připravit z fluoru a vysušit palladium nebo jodid draselný minimalizovat tvorbu IOF5, nečistota vznikající hydrolýzou.[6][7] Jodový heptafluorid se také vyrábí jako vedlejší produkt, když dioxygenyl hexafluoroplatinát se používá k přípravě dalších platinových (V) sloučenin, jako je hexafluoroplatinát draselný (V), použitím fluorid draselný v roztoku pentafluoridu jodného:[8]
- 2 O.2PtF6 + 2 KF + IF5 → 2 KPtF6 + 2 O.2 + POKUD7
Bezpečnostní hlediska
LI7 je vysoce dráždivý jak pro pokožku, tak pro pokožku sliznice. Je to také silný oxidant a může způsobit požár při kontaktu s organickým materiálem.
Reference
- ^ Pradyot Patnaik. Handbook of Anorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Macintyre, J. E. (vyd.). (1992). Slovník anorganických sloučenin (Sv. 3). London: Chapman & Hall.
- ^ O'Neil, Maryadele J. (vyd.). (2001). Index Merck (13. vydání). Whitehouse Station, NJ: Merck.
- ^ K. O. Christe; E. C. Curtis; D. A. Dixon (1993). "K problému heptakoordinace: vibrační spektra, struktura a fluxionalita jodového heptafluoridu". Journal of the American Chemical Society. 115 (4): 1520–1526. doi:10.1021 / ja00057a044.
- ^ W. J. Adams; H. Bradford Thompson; L. S. Bartell (1970). "Struktura, pseudorotace a vazba ve vibračním režimu v IF7: Studie elektronové difrakce “ (PDF). Journal of Chemical Physics. 53 (10): 4040–4046. doi:10.1063/1.1673876.
- ^ Schumb, W. C .; Lynch, M. A. (1950). „Jod heptafluorid“. Průmyslová a inženýrská chemie. 42 (7): 1383–1386. doi:10.1021 / ie50487a035.
- ^ Ruff, O .; Keim, R. (1930). ""Das Jod-7-fluorid „(Jod-7-fluorid)“. Zeitschrift für Anorganische und Allgemeine Chemie (v němčině). 193 (1/2): 176–186. doi:10.1002 / zaac.19301930117.
- ^ Beveridge, A.D .; Clark, H. C. (1967). „Pentahalidy přechodových kovů“. V Gutmann, Viktor (ed.). Halogenová chemie. 3. Akademický tisk. str. 179–226. ISBN 9780323148474.