Karbonylfluorid - Carbonyl fluoride - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Karbonyl difluorid | |||
| Ostatní jména Fluorfosgen; Oxid uhličitý difluorid; Fluoromethanoylfluorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.005.941 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 2417 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| COF2 | |||
| Molární hmotnost | 66,01 g mol−1 | ||
| Vzhled | Bezbarvý plyn | ||
| Hustota | 2,698 g / l (plyn), 1,139 g / cm3 (kapalina v bodu tání) | ||
| Bod tání | -111,26 ° C (-168,27 ° F; 161,89 K) | ||
| Bod varu | −84,57 ° C (−120,23 ° F; 188,58 K) | ||
| prudce reaguje s vodou[1] | |||
| Tlak páry | 55,4 atm (20 ° C)[1] | ||
| Struktura | |||
| C2v | |||
| 0.95 D | |||
| Nebezpečí | |||
| Hlavní nebezpečí | Při vdechnutí smrtelný, reaguje s vodou | ||
| Piktogramy GHS |     | ||
| Signální slovo GHS | Nebezpečí | ||
| H280, H290, H314, H330, H331, H370 | |||
| P234, P260, P261, P264, P270, P271, P280, P284, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P307 + 311, P310, P311, P320, P321, P363, P390, P403 + 233, P404, P405, P410 + 403, P501 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | Nehořlavé | ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | žádný[1] | ||
REL (Doporučeno) | TWA 2 ppm (5 mg / m3) ST 5 ppm (15 mg / m.)3)[1] | ||
IDLH (Okamžité nebezpečí) | N.D.[1] | ||
| Související sloučeniny | |||
Související sloučeniny | Fosgen Karbonylbromid Formylfluorid Thiokarbonylchlorid Aceton Močovina Kyselina uhličitá | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
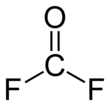
Karbonylfluorid je chemická sloučenina s vzorec COF2. Tento plyn, jako jeho analog fosgen, je bezbarvý a vysoce toxický. Molekula je rovinná s C2v symetrie.
Příprava a vlastnosti
Karbonylfluorid se obvykle vyrábí jako produkt rozkladu fluorovaných uhlovodíků při jeho tepelném rozkladu, například z trifluormethanolu nebo tetrafluormethan v přítomnosti vody:
- CF
4 + H
2Ó → COF
2 + 2HF
Karbonylfluorid lze také připravit reakcí fosgenu s fluorovodík a oxidace kysličník uhelnatý, i když toto má sklon k nadměrné oxidaci na tetrafluorid uhličitý. Oxidace oxidu uhelnatého s difluorid stříbrný je výhodné:
- CO + 2AgF
2 → COF
2 + 2AgF
Karbonylfluorid je v přítomnosti vody nestabilní, hydrolyzuje na oxid uhličitý a fluorovodík:[2]
- COF
2 + H
2Ó → CO
2 + 2HF
Bezpečnost
Karbonylfluorid je toxický s a doporučený expoziční limit 2 ppm jako 8hodinový časově vážený průměr a 5 ppm jako krátkodobá (průměr 15 minut) expozice.[3]
Reference
- ^ A b C d E NIOSH Kapesní průvodce chemickými nebezpečími. "#0108". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ M. W. Farlow; E. H. Man; C. W. Tullock (1960). „Karbonylfluorid“. Anorganické syntézy. 6: 155–158. doi:10.1002 / 9780470132371.ch48.
- ^ "Karbonylfluorid". NIOSH Kapesní průvodce chemickými nebezpečími. Centra CDC pro kontrolu a prevenci nemocí. Citováno 2013-09-10.