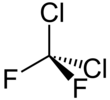
Dichlorodifluormethan - Dichlorodifluoromethane
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Dichlor (difluor) metan | |||
| Ostatní jména Dichlorodifluormethan Dichlorid uhličitý difluorid Dichlor-difluor-methan Difluorodichlormethan Freon 12 R-12 CFC-12 P-12 Pohonná hmota 12 Halon 122 Arcton 6 Arcton 12 E940 Fluorocarbon 12 Genetron 12 Chladivo 12 | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.000.813 | ||
| Číslo ES |
| ||
| Číslo E. | E940 (zasklívací prostředky, ...) | ||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1028 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| CCl2F2 | |||
| Molární hmotnost | 120.91 g · mol−1 | ||
| Vzhled | Bezbarvý plyn | ||
| Zápach | éterový jako ve velmi vysokých koncentracích | ||
| Hustota | 1,486 g / cm3 (-29,8 ° C (-21,6 ° F)) | ||
| Bod tání | -157,7 ° C (-251,9 ° F; 115,5 K) | ||
| Bod varu | -29,8 ° C (-21,6 ° F; 243,3 K) | ||
| 0,286 g / l při 20 ° C (68 ° F) | |||
| Rozpustnost v alkoholu, etheru, benzenu, kyselině octové | Rozpustný | ||
| log P | 2.16 | ||
| Tlak páry | 568 kPa (20 ° C (68 ° F)) | ||
| 0,0025 mol kg−1 bar−1 | |||
| −52.2·10−6 cm3/ mol | |||
| Tepelná vodivost | 0,0097 W / (m · K) (300 K)[1] | ||
| Struktura | |||
| Čtyřboká | |||
| 0.51 D[2] | |||
| Nebezpečí | |||
| Bezpečnostní list | Vidět: datová stránka | ||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Varování | ||
| H280, H420 | |||
| P410, P403 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | Nehořlavé [3] | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LC50 (střední koncentrace ) | 760 000 ppm (myš, 30 min) 800 000 ppm (králík, 30 min) 800 000 ppm (morče, 30 minut) 600 000 ppm (krysa, 2h )[4] | ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | PEL 1000 ppm (4950 mg / m3)[3] | ||
REL (Doporučeno) | PEL 1000 ppm (4950 mg / m3)[3] | ||
IDLH (Okamžité nebezpečí) | 15 000 ppm[3] | ||
| Stránka s doplňkovými údaji | |||
| Index lomu (n), Dielektrická konstanta (εr), atd. | |||
Termodynamické data | Fázové chování pevná látka - kapalina - plyn | ||
| UV, IR, NMR, SLEČNA | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Dichlorodifluormethan (R-12) je bezbarvý plyn obvykle prodávaný pod jméno značky Freon-12a chlorfluoruhlovodík halomethan (CFC) použitý jako a chladivo a hnací plyn ve spreji. V souladu s Montrealský protokol, byla jeho výroba zakázána ve vyspělých zemích (země mimo článek 5) v roce 1996 a v rozvojových zemích (země podle článku 5) v roce 2010 z důvodu obav z jejího škodlivého účinku na ozónová vrstva.[5] Jeho jediné povolené použití je jako retardér hoření v ponorkách a letadlech. Je rozpustný v mnoha organických rozpouštědlech. Dichlorodifluormethan byl jedním z původních pohonných hmot pro Bláznivý provázek. Válce R-12 jsou barevné bílý.
Příprava
Může být připraven reakcí chlorid uhličitý s fluorovodík v přítomnosti a katalytické množství chlorid antimonitý:
- CCl4 + 2 HF → CCl2F2 + 2HCl
Tato reakce může také vyvolat trichlorfluormethan (CCl3F), chlorotrifluormethan (CClF3) a tetrafluormethan (CF4).[6]
Dějiny
Charles (Boss) Kettering, viceprezident společnosti General Motors Research Corporation, hledal náhradu chladiva, která by byla bezbarvá, bez zápachu, bez chuti, netoxická a nehořlavá. Sestavil tým, který zahrnoval Thomas Midgley, Jr., Albert Leon Henne a Robert McNary. V letech 1930 až 1935 vyvinuli dichlorodifluormethan (CCl2F2 nebo R12), trichlorfluormethan (CCl3F nebo R11), chlorodifluormethan (CHCIF2 nebo R22), trichlortrifluorethan (CCl2FCClF2 nebo R113) a dichlortetrafluorethan (CClF2CClF2 nebo R114), skrz Kinetické chemikálie což byl společný podnik mezi DuPont a General Motors.[7]
Používejte jako aerosol
Použití chlorfluoruhlovodíků jako aerosolů v medicíně, jako je např USP -schválený salbutamol, byl vyřazen US Food and Drug Administration. Jiný hnací plyn známý jako hydrofluoralkan nebo HFA, o kterém není známo, že by poškodil životní prostředí, byl vybrán, aby jej nahradil.[8]
Dodatečné vybavení
R-12 se používal ve většině aplikací v oblasti chlazení a klimatizace vozidel před rokem 1994 a poté byl nahrazen 1,1,1,2-tetrafluorethan (R-134a), který má nevýznamný potenciál poškozování ozonové vrstvy. Výrobci automobilů začali používat R-134a místo R-12 v letech 1992–1994. Pokud starší jednotky netěsní nebo vyžadují opravu zahrnující odstranění chladiva, dovybavení v některých jurisdikcích je vyžadováno jiné chladivo než R-12 (nejčastěji R-134a). USA nepožadují, aby vlastníci automobilů dovybavili své systémy; daně z chemikálií poškozujících ozonovou vrstvu spolu s relativním nedostatkem původních chladiv na otevřeném trhu však činí dovybavení jedinou ekonomickou možností. Dodatečné vybavení vyžaduje propláchnutí systému a nový filtr / sušičku nebo akumulátor a může také zahrnovat instalaci nových těsnění a / nebo hadic z materiálů kompatibilních s instalovaným chladivem. Minerální olej používaný s R-12 není kompatibilní s R-134a. Některé oleje určené pro konverzi na R-134a jsou inzerovány jako kompatibilní se zbytkovým minerálním olejem R-12.
Galerie

Hemisférické a globální průměrné koncentrace CFC-12 (NOAA / ESRL)

Časová řada atmosférických koncentrací CFC-12 (Walker et al., 2000)

Koncentrace CFC-12 na hladině moře v 90. letech

Oceánský vertikální inventář 90. let CFC-12

CFC-12, CFC-11, H-1211 a SF6 svislé profily
Reference
- ^ Touloukian, Y. S., Liley, P. E. a Saxena, S. C. Termofyzikální vlastnosti hmoty - datová řada TPRC. Svazek 3. Tepelná vodivost - nekovové kapaliny a plyny. Datová kniha. 1970.
- ^ Khristenko, Sergei V .; Maslov, Alexander I. a Viatcheslav P. Shevelko; Molekuly a jejich spektroskopické vlastnosti, str. 74 ISBN 3642719481.
- ^ A b C d NIOSH Kapesní průvodce chemickými nebezpečími. "#0192". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ „Dichlorodifluoromethane“. Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ „1: Aktualizace látek poškozujících ozonovou vrstvu (ODS) a dalších zajímavých plynů Montrealského protokolu“. Vědecké hodnocení poškozování ozonu: 2018 (PDF) (Global Ozone Research and Monitoring Project - Report No. 58 ed.). Ženeva, Švýcarsko: Světová meteorologická organizace. 2018. str. 1.10. ISBN 978-1-7329317-1-8. Citováno 22. listopadu 2020.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. str. 304. ISBN 978-0-08-037941-8.
- ^ Plunkett, Roy J. (1986). Vysoce výkonné polymery: jejich původ a vývoj. Elsevier Science Publishing Co., Inc., str. 261–262. ISBN 978-94-011-7073-4.
- ^ „Záchranné“ náhrady inhalátoru astmatu přicházející do Pa. Archivováno 16. února 2007, na Wayback Machine