Rtuťnatý (I) fluorid - Mercury(I) fluoride - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC Difluorid dimerný | |
| Ostatní jména Rtuťnatý (I) fluorid Rtuťnatý fluorid | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.034.302 |
PubChem CID | |
| UNII | |
| |
| |
| Vlastnosti | |
| Hg2F2 | |
| Molární hmotnost | 439,177 g / mol |
| Vzhled | žluté krychlové krystaly |
| Hustota | 8,73 g / cm3, pevná látka |
| rozkládá se[1] | |
| −26.5·10−6 cm3/ mol | |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | Velmi toxický (T +) Nebezpečný pro prostředí (N) |
| R-věty (zastaralý) | R26 / 27/28, R33, R50 / 53 |
| S-věty (zastaralý) | S13, S28, S45, S60, S61[2] |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | nehořlavé |
| Související sloučeniny | |
jiný anionty | Chlorid rtuťnatý Bromid rtuťnatý Jodid rtuťnatý |
jiný kationty | Fluorid zinečnatý Fluorid kademnatý |
Související sloučeniny | Rtuťnatý (II) fluorid |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Rtuťnatý (I) fluorid nebo rtuťnatý fluorid je chemická sloučenina složen z rtuť a fluor s vzorec Hg2F2. Skládá se z malých žlutých krychlových krystalů, které při vystavení světlu zčernají.[1]
Syntéza
Fluorid rtuťnatý se připravuje reakcí uhličitan rtuťnatý s kyselina fluorovodíková:
- Hg2CO3 + 2 HF → Hg2F2 + CO2 + H2Ó
Reakce
Po přidání do vody fluorid rtuťnatý hydrolyzuje na elementární kapalnou rtuť, oxid rtuťnatý a kyselina fluorovodíková:[1]
- Hg2F2 + H2O → Hg + HgO + 2 HF
Může být použit v Swartova reakce převést alkylhalogenidy na alkylfluoridy:[3]
Struktura
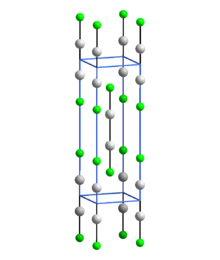
Společně s jinými sloučeninami Hg (I) (rtuťnatými), které obsahují lineární jednotky X-Hg-Hg-X, Hg2F2 obsahuje lineární FHg2F jednotky s délkou vazby Hg-Hg 251 pm (Hg-Hg v kovu je 300 pm) a délkou vazby Hg-F 214 pm.[4] Celková koordinace každého atomu Hg je zkreslená osmistěn; kromě vázaného F a dalšího Hg molekuly existují další čtyři atomy F ve 272 pm.[4] Sloučenina je často formulována jako Hg22+ 2F−.[5]
Reference
- ^ A b C Perry, Dale L .; Phillips, Sidney L. (1995), Příručka anorganických sloučenin, CRC Press, str. 256, ISBN 0-8493-8671-3, vyvoláno 2008-06-17
- ^ 339318 Rtuťnatý (I) technický fluorid, Sigma-Aldrich, vyvoláno 2008-06-17
- ^ Beyer, Hans; Walter, Wolfgang; Lloyd, Douglas (1997), Organická chemie, Horwood Publishing, str. 136, ISBN 1-898563-37-3, vyvoláno 2008-06-17
- ^ A b Wells A.F. (1984) Strukturní anorganická chemie 5. vydání Oxford Science Publications ISBN 0-19-855370-6
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A .; Bochmann, Manfred (1999), Pokročilá anorganická chemie (6. vydání), New York: Wiley-Interscience, ISBN 0-471-19957-5

