Xenon tetrafluorid - Xenon tetrafluoride
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Xenon tetrafluorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.033.858 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| XeF 4 | |||
| Molární hmotnost | 207,2836 g mol−1 | ||
| Vzhled | Bílá pevná látka | ||
| Hustota | 4,040 g cm−3, pevný | ||
| Bod tání | 117 ° C (243 ° F; 390 K) sublimuje[1] | ||
| Reaguje | |||
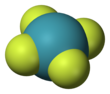
| Struktura | |||
| D4h | |||
| čtvercový rovinný | |||
| 0 D | |||
| Termochemie | |||
Std molární entropie (S | 146 J · mol−1· K.−1[2] | ||
Std entalpie of formace (ΔFH⦵298) | -251 kJ · mol−1[2] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Xenon tetrafluorid je chemická sloučenina s chemický vzorec XeF
4. Byl to první objevený binární sloučenina a ušlechtilý plyn.[3] Vyrábí se chemická reakce z xenon s fluor, F
2, podle chemická rovnice:[4][5]
- Xe + 2F
2 → XeF
4
Tato reakce je exotermické, uvolnění energie z 251kJ / mol.[3]
Xenon tetrafluorid je bezbarvý krystalický látka. Jeho strukturu určovali oba NMR spektroskopie a Rentgenová krystalografie v roce 1963.[6][7] Struktura je čtvercový rovinný, jak bylo potvrzeno neutronová difrakce studie,[8] Podle Teorie VSEPR Kromě čtyř fluoridových ligandů má střed xenonu dva volné páry elektronů. Tyto osamělé páry jsou vzájemně trans.
Xenon tetrafluorid vznešené při teplotě 115,7° C.
Syntéza
Xenon tetrafluorid se vyrábí zahříváním směsi xenonu a fluoru v poměru 1: 5 v nikl nádobu na 400 ° C. Nějaký xenon hexafluorid, XeF
6Rovněž se vyrábí, a tato produkce se zvyšuje se zvýšenou koncentrací fluoru ve vstupní směsi.[9] Nikl není katalyzátor pro tuto reakci; niklové nádoby se používají, protože reagují s fluorem a vytvářejí ochrannou vrstvu, která se neloupá nikl (II) fluorid NiF
2 na jejich vnitřních površích.
Reakce
Xenon tetrafluorid hydrolyzuje při nízkých teplotách za vzniku elementárního xenonu, kyslík, kyselina fluorovodíková a vodné oxid xenonový.[10]
Reakce s tetramethylamoniumfluorid dává tetramethylamonium pentafluoroxenát, který obsahuje pětiúhelník XeF−
5 anion. The XeF−
5 anion se také tvoří reakcí s fluorid cesný:[11]
- CsF + XeF
4 → CsXeF
5
Reakce s pentafluorid bismutitý (BiF
5) tvoří XeF+
3 kation:[12]
- BiF
5 + XeF
4 → XeF3BiF6
The XeF+
3 kation v soli XeF3Sb2F11 byla charakterizována NMR spektroskopií.[13]
Při 400 ° C, XeF
4 reaguje s xenonem za vzniku XeF
2:[9]
- XeF4 + Xe → 2 XeF2
Reakce xenon-tetrafluoridu s Platina výnosy tetrafluorid platiny a xenon:[9]
- XeF4 + Pt → PtF4 + Xe
Aplikace
Xenon tetrafluorid má několik aplikací. Ukázalo se, že degraduje silikonová guma pro analýzu stopových kovových nečistot v kaučuku. XeF
4 reaguje se silikonem za vzniku jednoduchých plynných produktů a zanechává zbytky kovových nečistot.[14]
Reference
- ^ Holleman, Arnold F .; Wiberg, Egon (2001). Wiberg, Nils (ed.). Anorganická chemie. Přeložil Eagleson, Mary; Sládek, William. Akademický tisk. str. 394. ISBN 0-12-352651-5.
- ^ A b Zumdahl, Steven S. (2009). Chemické principy (6. vydání). Společnost Houghton Mifflin. str. A23. ISBN 0-618-94690-X.
- ^ A b Zumdahl (2007). Chemie. Boston: Houghton Mifflin. str. 243. ISBN 0-618-52844-X.
- ^ Claassen, H. H .; Selig, H .; Malm, J. G. (1962). „Xenon Tetrafluoride“. J. Am. Chem. Soc. 84 (18): 3593. doi:10.1021 / ja00877a042.
- ^ Chernick, C. L .; Claassen, H. H .; Fields, P. R .; Hyman, H. H .; Malm, J. G .; Manning, W. M .; Matheson, M. S .; Quarterman, L. A .; Schreiner, F .; Selig, H. H .; Sheft, I .; Siegel, S .; Lenost, E. N .; Stein, L .; Studier, M. H .; Weeks, J. L .; Zirin, M. H. (1962). "Fluorové sloučeniny xenonu a radonu". Věda. 138 (3537): 136–138. Bibcode:1962Sci ... 138..136C. doi:10.1126 / science.138.3537.136. PMID 17818399.
- ^ Brown, Thomas H .; Whipple, E. B .; Verdier, Peter H. (1963). „Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum“. Věda. 140 (3563): 178. Bibcode:1963Sci ... 140..178B. doi:10.1126 / science.140.3563.178. PMID 17819836.
- ^ Ibers, James A .; Hamilton, Walter C. (1963). „Xenon Tetrafluoride: Crystal Structure“. Věda. 139 (3550): 106–107. Bibcode:1963Sci ... 139..106I. doi:10.1126 / science.139.3550.106. PMID 17798707.
- ^ Burns, John H .; Agron, P. A .; Levy, Henri A (1963). „Xenon Tetrafluoride Molecule and its Thermal Motion: A Neutron Diffraction Study“. Věda. 139 (3560): 1208–1209. Bibcode:1963Sci ... 139.1208B. doi:10.1126 / science.139.3560.1208. PMID 17757912.
- ^ A b C Bard, Allen J .; Parsons, Roger; Jordan, Joseph; International Union of Pure and Applied Chemistry (1985). Standardní potenciály ve vodném roztoku. CRC Press. str.767–768. ISBN 0-8247-7291-1.
- ^ Williamson; Koch, C. W. (březen 1963). „Tetenfluorid xenonu: reakce s vodnými roztoky“. Věda. 139 (3559): 1046–1047. Bibcode:1963Sci ... 139.1046W. doi:10.1126 / science.139.3559.1046. ISSN 0036-8075. PMID 17812981.
- ^ Harding, Charlie; Johnson, David Arthur; Janes, Rob (2002). Prvky p Blok. Molekulární svět. 9. Royal Society of Chemistry. str. 93. ISBN 0-85404-690-9.
- ^ Suzuki, Hitomi; Matano, Yoshihiro (2001). Organobismutová chemie. Elsevier. str. 8. ISBN 0-444-20528-4.
- ^ Gillespie, R. J .; Landa, B .; Schrobilgen, G. J. (1971). „Trifluoroxenon (IV) µ-fluor-bispentafluoroantimonát (V): XeF+
3 kation". Journal of the Chemical Society D: Chemical Communications (23): 1543–1544. doi:10.1039 / C29710001543. - ^ Rigin, V .; Skvortsov, N. K.; Rigin, V. V. (březen 1997). „Xenon-tetrafluorid jako rozkladné činidlo pro silikonový kaučuk pro izolaci a atomové emisní spektrometrické stanovení stopových kovů“. Analytica Chimica Acta. 340 (1–3): 1–3. doi:10.1016 / S0003-2670 (96) 00563-6.