Cobalt (II) fluorid - Cobalt(II) fluoride
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Cobalt (II) fluorid | |
| Ostatní jména kobalt-difluorid | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.030.044 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| SpolF2 | |
| Molární hmotnost | 96,93 g / mol |
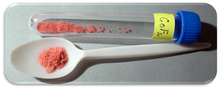
| Vzhled | Červená krystalická pevná látka |
| Hustota | 4,46 g / cm3 (bezvodý) 2,22 g / cm3 (tetrahydrát) |
| Bod tání | 1217 ° C (2223 ° F; 1490 K) |
| Bod varu | 1400 ° C (2550 ° F; 1670 K) |
| 1,4 g / 100 ml (25 ° C) | |
| Rozpustnost | rozpustný v HF nerozpustný v alkohol, éter, benzen |
| +9490.0·10−6 cm3/ mol | |
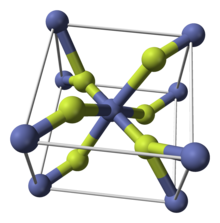
| Struktura | |
| čtyřúhelníkový (a, vodní) ortorombický (tetrahydrát) | |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | orálně (potkan): 150 mg / kg |
| Související sloučeniny | |
jiný anionty | oxid kobaltnatý, chlorid kobaltnatý |
jiný kationty | fluorid železitý, nikl (II) fluorid |
Související sloučeniny | trifluorid kobaltnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Cobalt (II) fluorid je chemická sloučenina se vzorcem (CoF2). Je to růžová krystalická pevná sloučenina[1][2] který je antiferomagnetický při nízkých teplotách (TN= 37,7 K)[3] Vzorec je uveden pro červený tetragonální krystal (CoF2) a tetrahydrátový červený ortogonální krystal (CoF2· 4H2Ó). CoF2 se používá v oblastech citlivých na kyslík, zejména při výrobě kovů. V nízkých koncentracích má využití v oblasti veřejného zdraví2 je těžko rozpustný ve vodě. Sloučenina může být rozpuštěna v teplé minerální kyselině a rozloží se ve vroucí vodě. Hydrát je přesto rozpustný ve vodě, zejména dihydrát CoF2· 2H2 O a trihydrát CoF2· 3H2O formy sloučeniny. Hydrát se také teplem rozloží.
Příprava
Fluorid kobaltnatý lze připravit z bezvodého chloridu kobaltnatého nebo oxidu kobaltnatého v proudu fluorovodík:
- CoCl2 + 2 HF → CoF2 + 2HCl
- CoO + 2HF → CoF2 + H2Ó
Vyrábí se při reakci fluoridu kobaltnatého s vodou.
The tetrahydrát kobalt (II) fluorid vzniká rozpuštěním kobaltu (II) v kyselině fluorovodíkové. Bezvodý fluorid lze z toho extrahovat dehydratací. Další syntéza může nastat při vyšších teplotách. Ukázalo se, že při 500 ° C se bude fluor kombinovat s kobaltem a vytvoří směs CoF2 a CoF3.[4]
Použití
Jako katalyzátor pro legování kovů lze použít fluorid kobaltnatý. Používá se také k optické depozici, což výrazně zlepšuje optickou kvalitu. Cobalt (II) fluorid je k dispozici ve většině objemů v ultra vysoké čistotě složení. Vysoce čisté kompozice standardně zlepšují optické vlastnosti a jeho užitečnost.
Analýza
Pro analýzu této sloučeniny může být fluorid kobaltnatý rozpuštěn v kyselině dusičné. Roztok se poté zředí vodou až do vhodné koncentrace pro AA nebo ICP spektrofotometrie pro kobalt. Malé množství soli lze rozpustit ve studené vodě a analyzovat na fluoridový iont pomocí fluoridové iontově selektivní elektrody nebo iontu chromatografie.
Chemické vlastnosti
CoF2 je slabý Lewisova kyselina. Kobaltové (II) komplexy jsou obvykle oktaedrické nebo čtyřboká. Jako 19-elektronový druh je to dobré redukční činidlo, docela oxidovatelné na 18-elektronovou sloučeninu. Fluorid kobaltnatý lze redukovat vodíkem při 300 ° C.
Reference
- ^ Pradyot Patnaik (2002), Handbook of Anorganic Chemicals, McGraw-Hill Professional, ISBN 978-0-07-049439-8
- ^ Pashkevich, D. S .; Radchenko S. M .; Mukhortov, D. A., „Název článku Výměna tepla mezi práškem fluoridu kobaltnatého a stěnou rotujícího válce“ (PDF), Russian Journal of Applied Chemistry, Kancelář konzultantů, ISSN 1070-4272, archivovány z originál (PDF) dne 2004-09-29, vyvoláno 2007-03-07
- ^ Ashcroft / Mermin: Fyzika pevných látek (Tab. 33.2)
- ^ J.C.Bailar (1973), Komplexní anorganická chemie, Pergoamon

