Vanrafetrafluorid - Vanadium tetrafluoride
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC vanad tetrafluorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.030.143 | ||
| Číslo ES |
| ||
PubChem CID | |||
| UNII | |||
| UN číslo | UN2923 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| F4PROTI | |||
| Molární hmotnost | 126.9351 g · mol−1 | ||
| Vzhled | Limetkově zelený prášek, hygroskopický[1] | ||
| Zápach | Bez zápachu | ||
| Hustota | 3,15 g / cm3 (20 ° C)[1] 2,975 g / cm3 (23 ° C)[2] | ||
| Bod tání | 325 ° C (617 ° F; 598 K) při 760 mmHg se rozkládá[1] | ||
| Bod varu | Vznešené[1] | ||
| Velmi rozpustný[1] | |||
| Rozpustnost | Rozpustný v aceton, octová kyselina Velmi málo rozpustný v TAK2Cl2, alkoholy, CHCI3[2] | ||
| Struktura | |||
| Monoklinický, mP10 | |||
| P21/ c, č. 14 | |||
| Termochemie | |||
Std molární entropie (S | 126 J / mol · K.[3] | ||
Std entalpie of formace (ΔFH⦵298) | -1412 kJ / mol[3] | ||
Gibbsova volná energie (ΔFG˚) | -1312 kJ / mol[3] | ||
| Nebezpečí | |||
| Piktogramy GHS |   [4] [4] | ||
| Signální slovo GHS | Nebezpečí | ||
| H300, H330, H314, H318[4] | |||
| P260, P301 + 310, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P320, P330, P405, P501[4] | |||
| Oko nebezpečí | Způsobuje vážné škody | ||
| Kůže nebezpečí | Způsobuje popáleniny | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Vanad (IV) fluorid (PROTIF4 ) je anorganická sloučenina z vanadium a fluor. to je paramagnetické žluto-hnědá pevná látka, která je velmi hygroskopický.[2] Na rozdíl od odpovídajících chlorid vanaditý tetrafluorid není těkavý, protože přijímá polymerní strukturu. Rozkládá se před roztavením.
Příprava a reakce
VF4 lze připravit zpracováním VCI4 s HF:
- VCl4 + 4 HF → VF4 + 4 HCl
Nejprve to bylo připraveno tímto způsobem.[5]
Rozkládá se při 325 ° C a je podroben disproporci tri- a pentafluoridy:[2]
- 2 VF4 → VF3 + VF5
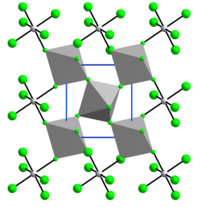
Struktura
Struktura VF4 souvisí s tím z SnF4. Každé centrum vanadu je oktaedrické, obklopené šesti fluoridovými ligandy. Čtyři z fluoridových center most do sousedních center vanadu.[6]
Reference
- ^ A b C d E Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90. vydání). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ A b C d Kwasnik, W. (1963). Brauer, Georg (ed.). Příručka preparativní anorganické chemie (UK ed.). London: Academic Press. str.252 –253.
- ^ A b C Anatolievich, Kiper Ruslan. „fluorid vanaditý“. http://chemister.ru. Citováno 2014-06-25. Externí odkaz v
| web =(Pomoc) - ^ A b C „Vanad (IV) fluorid, 95%“. http://www.alfa.com. Alfa Aesar. Citováno 2014-06-25. Externí odkaz v
| web =(Pomoc) - ^ Otto Ruff, Herbert Lickfett „Vanadinfluoride“ Chemische Berichte 1911, roč. 44, strany 2539–2549. doi:10.1002 / cber.19110440379
- ^ Becker S., Muller B. G. Tetrafluorid vanaduAngew. Chem. Intnl. Vyd. Engl. 1990, roč. 29, strana 406
- Webové prvky
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A .; Bochmann, Manfred (1999), Pokročilá anorganická chemie (6. vydání), New York: Wiley-Interscience, ISBN 0-471-19957-5
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |